(2018)技术通告第41总第367号-截止2018年第2季度发布的规范指南清单(20180709)(1)
- 格式:pdf
- 大小:273.68 KB
- 文档页数:7

北京市国防科学技术工业办公室关于发布《核能开发科研2018-2019年项目申报指南(公开版)》的通告
文章属性
•【制定机关】北京市国防科学技术工业办公室
•【公布日期】2018.02.22
•【字号】
•【施行日期】2018.02.22
•【效力等级】地方规范性文件
•【时效性】失效
•【主题分类】科学技术其他规定
正文
北京市国防科学技术工业办公室关于发布《核能开发科研2018-2019年项目申报指南(公开版)》的通告国家国防科工局已印发《核能开发科研2018-2019年项目申报指南(公开版)》,有关单位可依此申报相关项目,并于3月28日前将项目建议书(一式三份)及电子文档报送我办。
附件:核能开发科研2018-2019年项目申报指南(公开版)
北京市国防科学技术工业办公室
2018年2月22日。

危险性较大的分部分项工程安全管理规定-第37号令建办质【2018】31号危险性较大的分部分项工程安全管理规定XXX令第37号《危险性较大的分部分项工程安全管理规定》已经2018年2月12日第37次部常务会议审议通过,现予发布,自2018年6月1日起施行。
XXX部长XXX2018年3月8日危险性较大的分部分项工程安全管理规定第一章总则第一条为加强对房屋建筑和市政基础设施工程中危险性较大的分部分项工程安全管理,有效防范生产安全事故,依据《中华人民共和国建筑法》《中华人民共和国安全生产法》《建设工程安全生产管理条例》等法律法规,制定本规定。
第二条本规定适用于房屋建筑和市政基础设施工程中危险性较大的分部分项工程安全管理。
第三条本规定所称危险性较大的分部分项工程(以下简称“危大工程”),是指房屋建筑和市政基础设施工程在施工过程中,容易导致人员群死群伤或者造成重大经济损失的分部分项工程。
危大工程及超过一定规模的危大工程范围由国务院住房城乡建设主管部门制定。
省级住房城乡建设主管部门可以结合本地区实际情况,补充本地区危大工程范围。
第四条国务院住房城乡建设主管部门负责全国危大工程安全管理的指导监督。
县级以上地方人民政府住房城乡建设主管部门负责本行政区域内危大工程的安全监督管理。
第二章前期保障第五条建设单元应当依法提供真实、正确、完整的工程地质、水文地质和工程周边环境等资料。
第六条勘察单元应当根据工程实际及工程周边环境资料,在勘察文件中说明地质条件可能形成的工程风险。
设计单位应当在设计文件中注明涉及危大工程的重点部位和环节,提出保障工程周边环境安全和工程施工安全的意见,必要时进行专项设计。
第七条建设单位应当组织勘察、设计等单位在施工招标文件中列出危大工程清单,要求施工单位在投标时补充完善危大工程清单并明确相应的安全管理措施。
第八条建设单位应当按照施工合同约定及时支付危大工程施工技术措施费以及相应的安全防护文明施工措施费,保障危大工程施工安全。

工业和信息化部关于电信服务质量的通告(2018年第2号)文章属性•【制定机关】工业和信息化部•【公布日期】2018.06.13•【文号】工信部信管函〔2018〕191号•【施行日期】2018.06.13•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】通信业正文工业和信息化部关于电信服务质量的通告(2018年第2号)工信部信管函〔2018〕191号为推进电信服务质量持续改善,根据《中华人民共和国电信条例》相关规定,现将2018年第一季度电信服务有关情况通告如下:一、电信服务基本情况(一)服务能力稳步提升。
截至一季度末,全国电话用户总数达到16.6亿户,其中移动电话用户14.7亿户。
“宽带中国”战略稳步推进,宽带提速效果日益显著。
固定宽带用户达到3.61亿户,其中50Mbps及以上用户占比达75.2%,100Mbps及以上用户占比达45.2%。
光纤宽带加快普及,光纤接入(FTTH/O)用户总数达到3.08亿户,占固定宽带用户总数的85.3%。
移动宽带用户近12亿户,占比达81.5%,其中4G用户保持稳定增长,总数达到10.6亿户。
(二)网络运行安全畅通。
一季度,全国电信网和互联网运行平稳,通信服务质量整体稳定,电话接通率、互联网可接入率等符合《电信服务规范》指标要求。
通信行业圆满完成春节、“两会”通信保障任务,及时妥善应对江苏、重庆、湖南、安徽、浙江等地地震和气象类突发事件,共投入应急通信保障人员20.4万人次、抢修车辆4.2万台次、油机4.7万台次,快速抢修恢复受损通信设施,累计恢复基站2.1万站次、光缆3390公里,保障抗灾救灾指挥及党政军等重要部门通信畅通,迅速恢复灾区的通信服务,有力保障了公众通信网络整体平稳运行。
(三)推动互联网与经济社会各领域深度融合。
工业互联网建设稳步推进。
国家制造强国建设领导小组设立工业互联网专项工作组,统筹推进工业互联网相关工作。
部省沟通协作进一步加强,吉林、河北、广东、安徽、福建、天津等地发布贯彻落实《国务院关于深化“互联网+先进制造业”发展工业互联网的指导意见》实施方案,深入推动工业互联网创新发展。

国家认监委关于发布2018年第一批认证认可行业标准的通知正文:----------------------------------------------------------------------------------------------------------------------------------------------------国家认监委关于发布2018年第一批认证认可行业标准的通知国认科〔2018〕21号研究所、认可中心、认证认可协会,各相关认证机构、检验检测机构:经审查,现将《有机产品认证目录评估准则》等23项认证认可行业标准予以发布。
国家认监委2018年3月23日2018年第一批认证认可行业标准目录序号标准编号标准名称实施日期1RB/T164-2018有机产品认证目录评估准则2018-10-12RB/T165.1-2018有机产品产地环境适宜性评价技术规范第1部分:植物类产品2018-10-13RB/T165.2-2018有机产品产地环境适宜性评价技术规范第2部分:畜禽养殖2018-10-14RB/T165.3-2018有机产品产地环境适宜性评价技术规范第3部分:淡水水产养殖2018-10-15RB/T166-2018有机羊毛地毯认证技术规范2018-10-16RB/T167-2018有机葡萄酒加工技术规范2018-10-17RB/T168-2018有机液态乳加工技术规范2018-10-18RB/T169-2018有机产品(植物类)认证风险评估管理通用规范2018-10-19RB/T170-2018区域特色有机产品生产优势产地评价技术指南2018-10-110RB/T171-2018实验室测量审核结果评价指南2018-10-111RB/T172-2018实验动物机构标识系统要求2018-10-112RB/T173-2018实验动物人道终点评审指南2018-10-113RB/T174-2018司法鉴定/法庭科学机构能力认可专业要求2018-10-114RB/T175-2018生物质能可持续性认证要求2018-10-115RB/T220-2018检验检测机构资质认定能力评价信息安全检验检测机构要求2018-10-116RB/T251-2018钢铁企业温室气体排放核查技术规范2018-10-117RB/T252-2018化工企业温室气体排放核查技术规范2018-10-118RB/T253-2018电网企业温室气体排放核查技术规范2018-10-119RB/T254-2018发电企业温室气体排放核查技术规范2018-10-120RB/T255-2018电石企业温室气体排放核查技术规范2018-10-121RB/T256-2018合成氨企业温室气体排放核查技术规范2018-10-122RB/T257-2018甲醇企业温室气体排放核查技术规范2018-10-123RB/T258-2018乙烯企业温室气体排放核查技术规范2018-10-1——结束——。

厦门市环境保护局关于加强挥发性有机物污染防治(第三阶段)的通告文章属性•【制定机关】厦门市环境保护局•【公布日期】2018.06.01•【字号】厦环控〔2018〕26号•【施行日期】2018.06.01•【效力等级】地方规范性文件•【时效性】失效•【主题分类】固体废弃物与有毒化学品污染防治正文厦门市环境保护局关于加强挥发性有机物污染防治(第三阶段)的通告厦环控〔2018〕26号各有关企业:为加强我市挥发性有机物(以下简称VOCs)污染防治,提升环境空气质量,根据《中华人民共和国环境保护法》、《中华人民共和国大气污染防治法》和《厦门市环境保护条例》等相关法律法规规定,结合我市实际,通告如下:一、厦门市所有在生产、服务活动中产生VOCs污染物的船舶制造维修行业、橡胶制品业、制鞋业、工艺品制造的已建、在建和新建企业(含个体工商户,下同)都应遵守本通告要求,减少VOCs排放。
本次整治行业国民经济行业分类代码分别是:船舶制造维修行业为C373、C4342,橡胶制品业为C291、制鞋业为C195、工艺品制造为C243。
二、各企业应建立物料管理台账,详实记录含VOCs的原辅材料的采购及使用情况,妥善保存原辅材料成分说明书、检验报告、发票等原始单据,保存期限不得少于三年。
三、源头控制根据国家相关产业政策,提出以下要求:1.禁止新建、改扩建溶剂型氯丁橡胶类、丁苯热塑性橡胶类、聚氨酯类和聚丙烯酸酯类等通用型胶粘剂生产装置。
禁止新建、改扩建3万吨/年以下普通合成胶乳—羧基丁苯胶(含丁苯胶乳)生产装置。
禁止新建斜交轮胎和力车胎(手推车胎)、锦纶帘线、3万吨/年以下钢丝帘线、常规法再生胶(动态连续脱硫工艺除外)、橡胶塑解剂五氯硫酚、橡胶促进剂二硫化四甲基秋兰姆(TMTD)生产装置。
禁止新建、改扩建药用丁基橡胶塞、二步法生产输液用塑料瓶生产装置。
2.淘汰50万条/年及以下的斜交轮胎和以天然棉帘子布为骨架的轮胎、1.5万吨/年及以下的干法造粒炭黑(特种炭黑和半补强炭黑除外)、3亿只/年以下的天然胶乳安全套,橡胶硫化促进剂N-氧联二(1,2-亚乙基)-2-苯并噻唑次磺酰胺(NOBS)和橡胶防老剂D生产装置。

国家市场监督管理总局通告2018年第12号——市场监管总局关于18批次食品不合格情况的通告文章属性•【制定机关】国家市场监督管理总局•【公布日期】2018.06.04•【文号】国家市场监督管理总局通告2018年第12号•【施行日期】2018.06.04•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】食品安全正文国家市场监督管理总局通告2018年第12号市场监管总局关于18批次食品不合格情况的通告近期,原国家食品药品监督管理总局组织抽检炒货食品及坚果制品,方便食品,糕点,酒类,肉制品,食用油、油脂及其制品,蔬菜制品,蜂产品,水果制品,特殊膳食食品和食用农产品等11类食品556批次样品,抽样检验项目合格样品538批次,不合格样品18批次,检测项目见附件。
根据食品安全国家标准,个别项目不合格,其产品即判定为不合格产品。
具体情况通告如下:一、总体情况:炒货食品及坚果制品45批次,不合格样品2批次。
方便食品36批次,不合格样品3批次。
糕点26批次,不合格样品3批次。
酒类38批次,不合格样品1批次。
肉制品20批次,不合格样品1批次。
食用油、油脂及其制品18批次,不合格样品1批次。
蔬菜制品113批次,不合格样品1批次。
食用农产品156批次,不合格样品6批次。
蜂产品34批次,水果制品35批次,特殊膳食食品35批次,均未检出不合格样品。
二、不合格产品情况如下:(一)宁波市鄞州下应美购超市销售的标称厦门好士多食品有限公司出品、龙海市真好意食品有限公司生产的青豆(蒜香味),酸价(以脂肪计)检出值为5.2mgKOH/g,比国家标准规定(不超过3mgKOH/g)高出73.3%。
初检机构为宁波出入境检验检疫局检验检疫技术中心,复检机构为福建中检华日食品安全检测有限公司。
(二)深圳沃尔玛百货零售有限公司成都交大路分店销售的标称贵阳恒昌生态农业有限公司生产的巴旦木,二氧化硫残留量检出值为0.85g/kg。
国家标准规定不得使用。

工业和信息化部关于电信服务质量的通告(2019年第1号)正文:----------------------------------------------------------------------------------------------------------------------------------------------------工业和信息化部关于电信服务质量的通告(2019年第1号)工信部信管函〔2019〕48号根据《中华人民共和国电信条例》相关规定,现将2018年第四季度电信服务有关情况通告如下:2018年,全国电话用户总数达到17.5亿户,其中移动电话用户15.7亿户,4G用户保持稳定增长,总数达到11.7亿户。
全国电信网和互联网运行平稳,服务质量稳步提升。
一、电信用户申诉举报情况(一)电信服务申诉情况。
四季度,工业和信息化部及各省(自治区、直辖市)电信用户申诉受理机构受理电信用户申诉17552件,环比下降5.3%,同比下降22.8%;季度百万用户申诉率为8.2人次,环比下降3.5人次,同比下降0.6人次(详见附件1、2)。
收费争议类申诉占比39.2%,环比上升2.5个百分点;用户服务申诉占比39.0%,环比上升0.4个百分点;网络质量类申诉占比21.8%,环比下降2.9个百分点。
各级申诉受理机构按照《电信用户申诉处理办法》相关规定,对用户申诉进行了处理和调解,有效维护了电信用户合法权益。
(二)垃圾信息投诉举报情况。
四季度,12321网络不良与垃圾信息举报受理中心(以下简称12321举报受理中心)受理用户关于骚扰电话的投诉举报230694件次,环比下降5.1%,投诉举报量虽有所下降,但仍处于历史高位。
其中,电话轰炸类型的投诉举报量9187件次,增速明显,环比上升171.9%。
受理用户关于垃圾短信的投诉举报123678件次,环比上升6.9%,投诉举报量小幅上升。
其中,金融保险类端口垃圾短信投诉举报量35065件次,环比上升53.4%;博彩类点对点投诉举报25651件次,环比上升121.0%。

医疗器械注册员必备法规《医疗器械监督管理条例》(国务院令第650号)自2014年6月1日正式实施,条例配套的规章及规范性文件陆续密集出台。
新法规的出台意味着医疗器械企业面临新的机遇和挑战,作为医疗器械注册人熟悉这些必备的法规,对企业正常运行、产品如期顺利上市起到至关重要的作用国家食品药品监督管理总局已经发布和正在征求意见的系列法规文件目录如下,具体内容参见国家食品药品监督管理总局网站。
行政法规1. 医疗器械监督管理条例(国务院令第650号)2. 国务院关于修改《医疗器械监督管理条例》的决定(国务院令第680号)部门规章1. 医疗器械注册管理办法(CFDA局令第4号)2. 体外诊断试剂注册管理办法(CFDA局令第5号)3. 医疗器械说明书和标签管理规定(CFDA局令第6号)4. 医疗器械生产监督管理办法(CFDA局令第7号)医疗器械生产监督管理办法(修正版)(2017年11月21日发布)5. 医疗器械经营监督管理办法(CFDA局令第8号)医疗器械经营监督管理办法(修正版)(2017年11月21日发布)6. 药品医疗器械飞行检查办法(CFDA局令第14号)7. 医疗器械分类规则(CFDA局令第15号)8. 医疗器械使用质量监督管理办法(CFDA局令第18号)9. 医疗器械通用名称命名规则(CFDA局令第19号)10. 医疗器械临床试验质量管理规范(CFDA 国家卫计委令第25号)11. 医疗器械召回管理办法(CFDA局令第29号)12. 体外诊断试剂注册管理办法修正案(CFDA局令第30号)13. 关于调整部分医疗器械行政审批事项审批程序的决定(CFDA局令第32号)14. 医疗器械标准管理办法(CFDA局令第33号)15. 医疗器械网络销售监督管理办法(CFDA局令第38号)产品分类界定1. 关于可降解泪道栓子等53个产品分类界定的通知(食药监办〔2013〕11号)2. 关于体外高频治疗机等47个产品分类界定的通知(食药监办械管〔2013〕31号)3. 关于血细胞分离机用耗材等11个产品分类界定的通知(食药监办械管〔2013〕68号)4. 关于自体富血小板凝胶制备用套装等23个产品分类界定的通知(食药监办械管〔2013〕69号)5. 关于重症及麻醉临床信息系统等9个产品分类界定的通知(食药监办械管〔2013〕109号)6. 关于基因分析仪等3个产品分类界定的通知(食药监办械管〔2014〕8号)7. 关于生物电导扫描仪等11个产品分类界定的通知(食药监办械管〔2014〕10号)8. 关于角膜治疗仪等12个产品分类界定的通知(食药监办械管〔2014〕103号)9. 关于电子宫腔观察镜等30个产品分类界定的通知(食药监办械管〔2014〕149号)10. 关于交联胺化聚乙烯醇泡沫封堵肺减容系统等34个产品分类界定的通知(食药监办械管〔2014〕177号)11. 关于腹腔镜手术用内窥镜自动调控定位装置等61个产品分类界定的通知(食药监办械管〔2014〕198号)12. 关于乳腺摄影立体定位装置等153个产品分类界定的通知(食药监办械管〔2015〕49号)13. 关于人工血管接环等172个产品分类界定的通知(食药监办械管〔2015〕69号)14. 关于恒温核酸扩增检测仪等22个产品分类界定的通知(食药监办械管〔2015〕75号)15. 关于多功能超声骨刀等127个产品分类界定的通知(食药监办械管〔2015〕104号)16. 关于阴茎增大增粗拉伸器具产品分类界定事项的复函(食药监办械管函〔2016〕480号)通告1. 关于发布第一类医疗器械产品目录的通告(CFDA通告2014年第8号)2. 关于发布医疗器械产品技术要求编写指导原则的通告(CFDA通告2014年第9号)3. 关于发布免于进行临床试验的第二类医疗器械目录的通告(CFDA通告2014年第12号)4. 关于发布免于进行临床试验的第三类医疗器械目录的通告(CFDA通告2014年第13号)5. 关于发布需进行临床试验审批的第三类医疗器械目录的通告(CFDA通告2014年第14号)6. 关于医疗器械生产质量管理规范执行有关事宜的通告(CFDA通告2014年第15号)7. 关于发布体外诊断试剂临床试验技术指导原则的通告(CFDA通告2014年第16号)8. 关于发布体外诊断试剂说明书编写指导原则的通告(CFDA通告2014年第17号)9. 关于发布禁止委托生产医疗器械目录的通告(CFDA通告2014年第18号)10. 关于发布医疗器械生产企业供应商审核指南的通告(CFDA通告2015年第1号)11. 关于发布医疗器械临床评价技术指导原则的通告(CFDA通告2015年第14号)12. 关于发布医疗器械产品出口销售证明管理规定的通告(CFDA通告2015年第18号)13. 关于贯彻落实小微企业行政事业性收费优惠政策的通告(CFDA通告2015年第31号)14. 关于生产一次性使用无菌注、输器具产品有关事项的通告(CFDA通告2015年第71号)15. 关于发布医疗器械注册证补办程序等5个相关工作程序的通告(CFDA通告2015年第91号)16. 关于发布医疗器械注册指定检验工作管理规定的通告(CFDA通告2015年第94号)17. 关于发布医疗器械工艺用水质量管理指南的通告(CFDA通告2016年第14号)18. 关于第三类医疗器械生产企业实施医疗器械生产质量管理规范有关事宜的通告(CFDA通告2016年第19号)19. 关于发布《医疗器械临床试验伦理审查申请与审批表范本》等六个文件的通告(CFDA通告2016年第58号)20. 关于发布医疗器械生产企业质量管理体系年度自查报告编写指南的通告(CFDA 通告2016年第76号)21. 关于发布第二批免于进行临床试验医疗器械目录的通告(CFDA通告2016年第133号)22. 关于发布2016年第二批医疗器械临床试验监督抽查项目的通告(CFDA通告2016年第143号)23. 总局关于发布医疗器械生产企业质量控制与成品放行指南的通告(CFDA通告2016年第173号)24. 总局关于发布医疗器械审评沟通交流管理办法(试行)的通告(CFDA通告2017年第19号)25.总局关于发布第三批免于进行临床试验医疗器械目录的通告(CFDA通告2017年第170号)26. 总局关于需审批的医疗器械临床试验申请沟通交流有关事项的通告(CFDA通告2017年第184号)27. 总局关于发布医疗器械注册单元划分指导原则的通告(CFDA通告2017年第187号)28. 总局关于发布移动医疗器械注册技术审查指导原则的通告(CFDA通告2017年第222号)29. 总局关于发布接受医疗器械境外临床试验数据技术指导原则的通告(CFDA通告2018年第13号)政策解读1. 医疗器械抽验和不良事件监测部分(一)(2015年01月22日发布)2. 《医疗器械经营监督管理办法》部分(一)(2015年01月22日发布)3. 《医疗器械生产监督管理办法》部分(一)(2015年01月22日发布)4. 医疗器械注册管理法规解读之一(《医疗器械注册管理办法》和《体外诊断试剂注册管理办法》部分)(2015年02月05日发布)5. 医疗器械注册管理法规解读之二(《医疗器械说明书和标签管理规定》部分)(2015年02月05日发布)6. 关于《药品医疗器械飞行检查办法》的说明(2015年07月08日发布)7. 医疗器械注册管理法规解读之三(关于《医疗器械分类规则》的修订说明)(2015年07月16日)8. 医疗器械注册管理法规解读之四(2015年11月02日发布)9. 医疗器械注册管理法规解读之五(2015年11月19日发布)10. 医疗器械不良事件监测的主要目的和意义(2015年11月25日发布)11. 关于《医疗器械使用质量监督管理办法》的说明(2015年11月30日发布)12. 医疗器械注册管理法规解读之六(2016年01月07日发布)13. 关于《医疗器械通用名称命名规则》的说明(2016年01月27日发布)14. 《医疗器械临床试验质量管理规范》解读(2016年03月23日发布)15. 关于《医疗器械优先审批程序》的说明(2016年10月26日发布)16. 《医疗器械质量管理体系用于法规的要求》标准解读(一)(2017年02月04日发布)17. 《医疗器械质量管理体系用于法规的要求》标准解读(二)(2017年02月04日发布)18. 《医疗器械召回管理办法》解读(2017年02月08日发布)19. 《体外诊断试剂注册管理办法修正案》解读(2017年02月08日发布)20. 《医疗器械网络安全注册技术审查指导原则》解读(2017年03月02日发布)21. 《关于调整部分医疗器械行政审批事项审批程序的决定》解读(2017年04月06日发布)22. 《医疗器械标准管理办法》解读(2017年04月26日发布)23. 《医疗器械召回管理办法》解读之二(2017年05月24日发布)24. 图解政策:2017年器械注册管理改革有这4项重要举措(2017年07月14日发布)25. 图解政策:体外诊断试剂注册管理办法修正案(2017年07月28日发布)26. 创新医疗器械特别审批程序相关问题解读(2017年07月31日发布)27. 医疗器械临床试验质量管理相关问题解读(2017年07月31日发布)28. 《医疗器械标准管理办法》解读之一(2017年08月09日发布)29. 《医疗器械标准管理办法》解读之二(2017年08月09日发布)30. 《医疗器械网络安全注册技术审查指导原则》解读(2017年08月09日发布)31. 《医疗器械临床试验机构条件和备案管理办法》解读(2017年11月24日发布)32. 《医疗器械网络销售监督管理办法》解读(2017年12月22日发布)33. 《移动医疗器械注册技术审查指导原则》解读(2017年12月29日发布)通知性文件1. 关于进一步做好医疗器械产品分类界定工作的通知(食药监办械〔2013〕36号)2. 关于小型医用吸氧器监管有关问题的通知(食药监办法〔2013〕63号)3. 关于实施避孕套出口备案管理的通知(食药监办械监〔2013〕72号)4. 关于进一步加强医疗器械不良事件监测体系建设的指导意见(食药监械监〔2013〕205号)5. 关于印发医疗器械质量监督抽查检验管理规定的通知(食药监械监〔2013〕212号)6. 关于加强省级医疗器械技术审评能力建设的指导意见(食药监械管〔2013〕220号)7. 关于印发医疗器械生产日常监督现场检查工作指南的通知(食药监办械监〔2014〕7号)8. 关于印发创新医疗器械特别审批程序(试行)的通知(食药监械管〔2014〕13号)9. 关于认真贯彻实施《医疗器械监督管理条例》的通知(食药监法〔2014〕31号)10. 关于进一步做好医疗器械召回信息公开工作的通知(食药监办械监〔2014〕107号)11. 关于实施《医疗器械生产监督管理办法》和《医疗器械经营监督管理办法》有关事项的通知(食药监械监〔2014〕143号)12. 关于实施《医疗器械注册管理办法》和《体外诊断试剂注册管理办法》有关事项的通知(食药监械管〔2014〕144号)13. 关于实施第一类医疗器械备案有关事项的通知(食药监办械管〔2014〕174号)14. 关于印发医疗器械检验机构开展医疗器械产品技术要求预评价工作规定的通知(食药监械管〔2014〕192号)15. 关于印发境内第三类和进口医疗器械注册审批操作规范的通知(食药监械管〔2014〕208号)16. 关于印发境内第二类医疗器械注册审批操作规范的通知(食药监械管〔2014〕209号)17. 关于印发医疗器械生产企业分类分级监督管理规定的通知(食药监械监〔2014〕234号)18. 关于印发国家重点监管医疗器械目录的通知(食药监械监〔2014〕235号)19. 关于启用医疗器械生产经营许可备案信息系统的通知(食药监办械监函〔2014〕476号)20. 关于加强避孕套质量安全管理的通知(食药监械监〔2015〕30号)21. 关于印发体外诊断试剂质量评估和综合治理工作方案的通知(食药监办械监〔2015〕55号)22. 关于印发境内第三类医疗器械注册质量管理体系核查工作程序(暂行)的通知(食药监械管〔2015〕63号)23. 关于对取消和下放行政审批事项加强事中事后监管的意见(食药监法〔2015〕65号)24. 关于印发医疗器械经营企业分类分级监督管理规定的通知(食药监械监〔2015〕158号)25. 关于印发医疗器械经营环节重点监管目录及现场检查重点内容的通知(食药监械监〔2015〕159号)26. 关于印发医疗器械生产质量管理规范现场检查指导原则等4个指导原则的通知(食药监械监〔2015〕218号)27. 关于印发医疗器械经营质量管理规范现场检查指导原则的通知(食药监械监〔2015〕239号)28. 关于执行医疗器械和体外诊断试剂注册管理办法有关问题的通知(食药监械管〔2015〕247号)29. 关于印发医疗器械检验机构资质认定条件的通知(食药监科〔2015〕249号)30. 关于成立医疗器械分类技术委员会的通知(食药监械管〔2015〕259号)31. 关于进一步加强医疗器械抽验工作的通知(食药监办械监〔2016〕9号)32. 关于切实做好第三类医疗器械生产企业实施医疗器械生产质量管理规范有关工作的通知(食药监办械监〔2016〕12号)33. 关于医疗器械产品技术要求有关问题的通知(食药监办械管〔2016〕22号)34. 总局关于实施《医疗器械通用名称命名规则》有关事项的通知(食药监械管〔2016〕35号)35. 总局关于印发一次性使用无菌注射器等25种医疗器械生产环节风险清单和检查要点的通知(食药监械监〔2016〕37号)。

2021年NMPA医疗器械法律法规清单一、行政法规1. 《医疗器械监督管理条例》(国务院令第 739 号)二、部门规章1. 医疗器械注册与备案管理办法(市场监督管理总局令第 47 号)2. 体外诊断试剂注册与备案管理办法(市场监督管理总局令第 48 号)3.药品、医疗器械、保健食品、特殊医学用途配方食品广告审查管理暂行办法(市场监督管理总局令第 21 号)4. 医疗器械不良事件监测和再评价管理办法(市场监督管理总局、卫健委令第 1号)5. 医疗器械说明书和标签管理规定(总局令第 6 号)6. 医疗器械生产监督管理办法(总局令第 7 号)7. 医疗器械经营监督管理办法(总局令第 8 号)8.药品医疗器械飞行检查办法(总局令第 14 号)9.医疗器械分类规则(总局令第 15 号)10.医疗器械使用质量监督管理办法(总局令第 18 号)11.医疗器械通用名称命名规则(总局令第 19 号)12.医疗器械临床试验质量管理规范(总局国家卫计委令第 25 号)13.医疗器械召回管理办法(总局令第 29 号)14.关于调整部分医疗器械行政审批事项审批程序的决定(总局令第 32 号)15.医疗器械标准管理办法(总局令第 33 号)16.医疗器械网络销售监督管理办法(总局令第 38 号)三、通告文件1.国家药监局关于实施《第一类医疗器械产品目录》有关事项的通告(2021年第107号)(国家局通告 2021 年第 107 号)2.国家药监局关于发布医疗器械临床试验数据递交要求等 2 项注册审查指导原则的通告(国家局通告 2021 年第 91 号)3.国家药品监督管理局关于实施《医疗器械注册与备案管理办法》《体外诊断试剂注册与备案管理办法》有关事项的通告(国家局通告 2021 年第 76 号)4.国家药监局关于发布免于临床试验的体外诊断试剂临床评价技术指导原则的通告(国家局通告 2021 年第 74 号)5.国家药监局关于发布医疗器械临床评价技术指导原则等 5 项技术指导原则的通告(国家局通告 2021 年第 73 号)6.国家药监局关于发布体外诊断试剂临床试验技术指导原则的通告(国家局通告2021 年第 72 号)7.国家药监局关于发布免于临床评价医疗器械目录的通告(国家局通告 2021 年第 71 号)8.国家药监局关于发布免于临床试验体外诊断试剂目录的通告(国家局通告2021 年第 70 号)9.国家药监局关于发布血管内导管同品种对比临床评价技术审查指导原则的通告(国家局通告 2021 年第 68 号)10.国家药监局关于发布神经和心血管手术器械通用名称命名指导原则等 2 项指导原则的通告(国家局通告 2021 年第 62 号)11.国家药监局关于发布医用康复器械通用名称命名指导原则等 6 项指导原则的通告(国家局通告 2021 年第 48 号)12.国家药监局关于发布人工智能医用软件产品分类界定指导原则的通告(国家局通告 2021 年第 47 号)13.国家药监局关于发布重组胶原蛋白类医疗产品分类界定原则的通告(国家局通告 2021 年第 27 号)14.国家药监局关于发布医疗器械注册人开展产品不良事件风险评价指导原则的通告(国家局通告2020 年第 78 号)15.国家药监局关于发布需进行临床试验审批的第三类医疗器械目录(2020 年修订版)的通告(国家局通告 2020 年第 61 号)16.国家药监局关于发布医疗器械定期风险评价报告撰写规范的通告(国家局通告 2020 年第 46 号)17.国家药监局关于发布无源医疗器械产品原材料变化评价指南的通告(国家局通告 2020 年第 33 号)18.国家药监局关于发布医疗器械注册人开展不良事件监测工作指南的通告(国家局通告 2020年第 25 号)19.国家药监局关于发布医疗器械注册质量管理体系核查指南的通告(国家局通告 2020 年第 19 号)20.国家药监局关于发布医疗器械安全和性能基本原则的通告(国家局通告2020 年第 18 号)21.国家药监局关于做好第一批实施医疗器械唯一标识工作有关事项的通告(国家局通告 2019年第 72 号)22.国家药监局关于发布医疗器械生产质量管理规范附录独立软件的通告(国家局通告 2019 年第 43 号)23.国家药监局关于发布《医疗器械产品注册项目立卷审查要求(试行)》等文件的通告(国家局通告 2019 年第 42 号)24.国家药监局关于医疗器械电子申报有关资料要求的通告(国家局通告 2019年第 41 号)25.关于发布医疗器械注册申请电子提交技术指南的通告(国家局通告 2019 年第 29 号)26.关于发布创新医疗器械特别审查申报资料编写指南的通告(国家局通告2018 年第 127 号)27.国家药品监督管理局关于医疗器械经营企业跨行政区域设置库房办理事项的通告(国家局通告2018 年第 108 号)28.国家药品监督管理局关于发布医疗器械生产企业管理者代表管理指南的通告(国家局通告2018年第 96 号)29.总局关于过敏原类、流式细胞仪配套用、免疫组化和原位杂交类体外诊断试剂产品属性及类别调整的通告(国家局通告 2017 年第 226 号)30. 总局关于需审批的医疗器械临床试验申请沟通交流有关事项的通告(国家局通告 2017 年第 184 号31.总局关于实施《医疗器械分类目录》有关事项的通告(国家局通告 2017 年第 143 号)32.总局关于发布医疗器械优先审批申报资料编写指南(试行)的通告(国家局通告 2017 年第 28 号)33.总局关于发布医疗器械审评沟通交流管理办法(试行)的通告(国家局通告2017 年第 19 号)34.总局关于发布医疗器械生产企业质量控制与成品放行指南的通告(国家局通告 2016 年第 173 号)35.总局关于发布医疗器械生产企业质量管理体系年度自查报告编写指南的通告(国家局通告2016 年第 76 号)36.总局关于发布《医疗器械临床试验伦理审查申请与审批表范本》等六个文件的通告(国家局通告2016 年第 58 号)37.国家食品药品监督管理总局关于发布医疗器械工艺用水质量管理指南的通告(国家局通告2016 年第 14 号)38.国家食品药品监督管理总局关于发布医疗器械注册证补办程序等 5 个相关工作程序的通告(国家局通告 2015 年第 91 号)39.国家食品药品监督管理总局关于生产一次性使用无菌注、输器具产品有关事项的通告(国家局通告 2015 年第 71 号)40.国家食品药品监督管理总局关于贯彻落实小微企业行政事业性收费优惠政策的通告(国家局通告2015 年第 31 号)41.国家食品药品监督管理总局关于发布医疗器械产品出口销售证明管理规定的通告(国家局通告2015 年第 18 号)42.国家食品药品监督管理总局关于发布医疗器械生产企业供应商审核指南的通告(国家局通告2015 年第 1 号)43.国家食品药品监督管理总局关于发布禁止委托生产医疗器械目录的通告(国家局通告 2014年第 18 号)44.国家食品药品监督管理总局关于医疗器械生产质量管理规范执行有关事宜的通告(国家局通告2014 年第 15 号)四、公告文件1.国家药监局关于发布第一类医疗器械产品目录的公告(国家局 2021年第158号)2.医疗器械应急审批程序(国家局 2021年第157号)3.国家药监局关于发布《体外诊断试剂分类规则》的公告(国家局公告 2021 年第 129 号)4.国家药监局关于发布《医疗器械注册自检管理规定》的公告(国家局公告2021 年第 126 号)5.关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告(国家局公告 2021 年第 122 号)6.关于公布医疗器械注册申报资料要求和批准证明文件格式的公告(国家局公告2021 年第 121 号)7.国家药监局国家卫生健康委国家医保局关于做好第二批实施医疗器械唯一标识工作的公告(国家局公告 2021 年第 114 号)8.国家药监局关于公布《免于经营备案的第二类医疗器械产品目录》的公告(国家局公告 2021 年第 86 号)9.国家药监局关于贯彻实施《医疗器械监督管理条例》有关事项的公告(国家局公告 2021 年第 76 号)10.国家药监局关于发布医疗器械分类目录动态调整工作程序的公告(国家局公告 2021 年第 60 号)11.国家药监局关于医疗器械主文档登记事项的公告(国家局公告 2021 年第 36号)12.家药监局关于调整《医疗器械分类目录》部分内容的公告(国家局公告2020 年第 147 号)13.国家药监局关于进一步规范医用超声耦合剂说明书等有关内容的公告(国家局公告 2020 年第 143 号)14.国家药监局关于发布《可重复使用医用防护服技术要求》的公告(国家局公告 2020 年第 140 号)15.国家药监局关于试点启用医疗器械电子注册证的公告(国家局公告 2020 年第 117 号)16.国家药监局关于调整《6840 体外诊断试剂分类子目录(2013 版)》部分内容的公告(国家局公告 2020 年第 112 号)17.国家药监局国家卫生健康委国家医保局关于深入推进试点做好第一批实施医疗器械唯一标识工作的公告(国家局公告2020 年第 106 号)18.国家药监局关于进口医疗器械产品在中国境内企业生产有关事项的公告(国家局公告 2020年第 104 号)19.国家药监局国家卫生健康委关于发布 2020 年版《中华人民共和国药典》的公告(国家局公告 2020 年第 78 号)20.国家药监局国家卫生健康委关于发布医疗器械拓展性临床试验管理规定(试行)的公告(国家局公告 2020 年第 41 号)21.国家药监局关于修改一次性使用无菌导尿管(包)说明书等有关内容的公告(国家局公告2019 年第 94 号)22.国家药监局关于发布医疗器械唯一标识系统规则的公告(国家局公告 2019年第 66 号)23.国家药监局国家卫生健康委关于发布定制式医疗器械监督管理规定(试行)的公告(国家局公告 2019 年第 53 号)24.国家药监局关于实施医疗器械注册电子申报的公告(国家局公告 2019 年第46 号)25.关于发布药品医疗器械境外检查管理规定的公告(国家局公告 2018 年第101 号)26.国家药监局关于发布创新医疗器械特别审查程序的公告(国家局公告 2018年第 83 号)27.总局关于发布医疗器械标准制修订工作管理规范的公告(国家局公告 2017年第 156 号)28.国家食品药品监督管理总局国家卫生和计划生育委员会关于发布医疗器械临床试验机构条件和备案管理办法的公告(国家局公告 2017 年第 145 号)29.总局关于进口医疗器械注册申请人和备案人名称使用中文的公告(国家局公告 2017 年第 131 号)30.总局关于医疗器械经营备案有关事宜的公告(国家局公告 2017 年第 129号)31.总局关于发布医疗器械分类目录的公告(国家局公告 2017 年第 104 号)32.总局关于发布医疗器械技术审评专家咨询委员会管理办法的公告(国家局公告 2017 年第 36 号)33.总局关于发布医疗器械生产质量管理规范附录定制式义齿的公告(国家局公告 2016 年第 195 号)34.总局关于发布医疗器械优先审批程序的公告(国家局公告 2016 年第 168号)35.总局关于发布医疗器械冷链(运输、贮存)管理指南的公告(国家局公告2016 年第 154 号)36.国家食品药品监督管理总局关于规范含银盐医疗器械注册管理有关事宜的公告(国家局公告2015 年第 225 号)37.国家食品药品监督管理总局关于境内医疗器械生产企业跨省新开办企业时办理产品注册及生产许可有关事宜的公告(国家局公告 2015 年第 203 号)38. 国家食品药品监督管理总局关于发布医疗器械生产质量管理规范附录体外诊断试剂的公告(国家局公告 2015 年第 103 号)39.国家食品药品监督管理总局关于发布医疗器械生产质量管理规范附录植入性医疗器械的公告(国家局公告 2015 年第 102 号)40.国家食品药品监督管理总局关于发布医疗器械生产质量管理规范附录无菌医疗器械的公告(国家局公告 2015 年第 101 号)41.国家食品药品监督管理总局关于医疗器械临床试验备案有关事宜的公告(国家局公告 2015年第 87 号)42.国家食品药品监督管理总局关于发布医疗器械生产质量管理规范的公告(国家局公告 2014年第 64 号)43. 国家食品药品监督管理总局关于发布药品、医疗器械产品注册收费标准的公告(国家局公告2015 年第 53 号)44.国家食品药品监督管理总局关于第一类医疗器械备案有关事项的公告(国家局公告 2014 年第 26 号)45.国家食品药品监督管理总局关于医疗器械生产经营备案有关事宜的公告(国家局公告 2014年第 25 号)五、国家局器审中心通告1.关于医疗器械注册申请缴纳费用有关事宜的通告(2021 年第 16 号)2.关于发布医疗器械注册电子申报目录文件夹结构的通告(2021 年第 15 号)3.关于办理医疗器械主文档登记有关事宜的通告(2021 年第 2 号)4.关于在 eRPS 系统提交医疗器械唯一标识有关事项的通告(2020 年第 26号)5.关于临床急需医疗器械注册申报有关事宜的通告(2020 年第 22 号)6.关于进口医疗器械注册申报资料试行电子签名有关事宜的通告(2020 年第 20号)7.关于进口医疗器械按第二类申请产品注册经技术审评确认为第三类的退出注册程序及后续处理方式的通告(2020 年第 17 号)8.关于进一步规范受理环节立卷审查工作有关事宜的通告(2020 年第 16 号)9.关于补正资料期间充分利用沟通交流途径提高补充资料质量的通告(2020 年第 15 号)10.关于调整部分医疗器械注册申请事项公证文件提交时间和形式的通告(2020年第 13 号)11.关于调整医疗器械注册电子申报信息化系统数字认证(CA)证书业务办理方式的通告(2020 年第 12 号)12.关于发布《肺炎 CT 影像辅助分诊与评估软件审评要点(试行)》的通告(2020 年第 8 号)13. 关于发布《2019 新型冠状病毒抗原/抗体检测试剂注册技术审评要点(试行)》的通告(2020 年第 6 号)14.关于发布《2019 新型冠状病毒核酸检测试剂注册技术审评要点》的通告(2020 年第 4 号)15.关于发布医疗器械注册审评补正资料要求管理规范的通告(2020 年第 1号)16.关于医疗器械注册电子申报关联提交及禁止重复提交的通告(2019 年第 15号)17. 关于调整部分医疗器械申请事项行政许可文书送达方式的通告(2019 年第12 号)18.关于发布深度学习辅助决策医疗器械软件审评要点的通告(2019 年第 7号)19.关于发布医疗器械注册电子申报信息化系统电子申报目录(RPS ToC)文件夹结构的通告(2019 年第 5 号)20.关于医疗器械注册电子申报信息化系统业务办理有关事宜的通告(2019 年第 4 号)21.关于发布医疗器械技术审评中心创新医疗器械特别审查申请审查操作规范的通告(2018 年第 11 号)22.关于提供医疗器械技术审评补正资料预审查服务的通告(2018 年第 8 号)23.关于启用技术审评咨询平台新增功能的通告(2018 年第 7 号)。
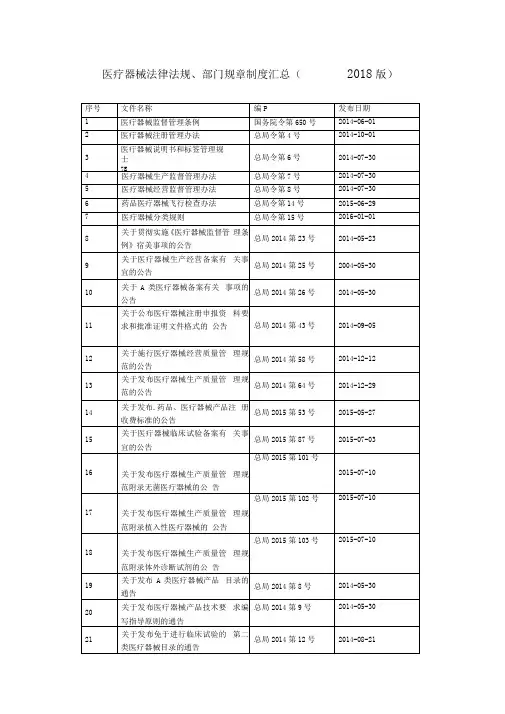
医疗器械法律法规、部门规章制度汇总(2018版)医疗器械重点法律法规解读1.《医疗器械监督管理条例》已经2014年2月12日国务院第39次常务会议修订通过,现将修订后的《医疗器械监督管理条例》(以下简称“《条例》”)公布,自2014年6月1日起施行。
2.《医疗器械标准管理办法》已于2017年2月21日经国家食品药品监督管理总局局务会议审议通过,现予公布,自2017年7月1日起施行。
医疗器械标准,是指由国家食品药品监督管理总局依据职责组织制定、修订,依法定程序发布,在医疗器械研制、生产、经营、使用、监督管理等活动中遵循的统一的技术要求。
在中华人民共和国境内从事医疗器械标准的制定、修订、实施及监督管理,应当遵守法律、行政法规及本办法的规定。
医疗器械标准按照其效力分为强制性标准和推荐性标准。
3.《大型医用设备配置与使用管理办法》卫生部、国家发展和改革委员会、财政部联合制定并下发(卫规财发〔2004〕474号)。
大型医用设备是指列入国务院卫生行政部门管理品目的医用设备以及尚未列入管理品目、省级区域内首次配置的整套单价在500万元人民币以上的医用设备。
大型医用设备的管理实行配置规划和配置证制度。
甲类大型医用设备的配置许可证由国务院卫生行政部门颁发;乙类大型医用设备的配置许可证由省级卫生行政部门颁发。
医疗器械安全使用指南疗机构要加强大型医用设备使用管理,严格操作规范, 保证设备使用安全、有效。
4.《体外诊断试剂注册管理办法修正案》已于2017年1月5日经国家食品药品监督管理总局局务会议审议通过,现予公布,自公布之日起施行。
本办法所称的体外诊断试剂,是指按医疗器械管理的体外诊断试剂,包括在疾病的预测、预防、诊断、治疗监测、预后观察和健康状态评价的过程中,用于人体样本体外检测的试剂、试剂盒、校准品、质控品等产品。
可以单独使用,也可以与仪器、器具、设备或者系统组合使用。
按照药品管理的用于血源筛查的体外诊断试剂和采用放射性核素标记的体外诊断试剂,不属于本办法管理范围。

山东省农业农村厅关于发布2018年度耕地质量监测报告的通告正文:---------------------------------------------------------------------------------------------------------------------------------------------------- 关于发布2018年度耕地质量监测报告的通告为摸清我省耕地质量现状和演变趋势,指导科学施肥和耕地质量提升,推进藏粮于地、藏粮于技战略实施,保障粮食安全,根据《耕地质量调查监测与评价办法》(农业部令2016年第2号)要求,我厅在调查取样检测的基础上,组织编写了《山东省耕地质量监测报告(2018年度)》,现予通告。
附件:山东省耕地质量监测报告(2018年度)山东省农业农村厅2020年3月25日附件山东省耕地质量监测报告(2018年度)耕地质量监测是《农业法》《基本农田保护条例》和《耕地质量调查监测与评价办法》赋予农业农村部门的重要职责,是粮食生产责任制考核的重要内容,也是农业农村部门的一项基础性、公益性和长期性工作。
根据农业农村部和省委省政府有关部署和文件要求,全省土肥系统认真运行、维护监测网络,规范取样检测,全面摸清了耕地质量现状和演变趋势,为全省科学施肥和耕地质量建设提供了重要技术支撑。
一、概述山东省耕地质量监测工作起始于第二次土壤普查,历经起步探索(1986~1997年)、徘徊发展(1998~2004年)、快速织网(2005~2016年)、规范提升(2016年~)四个阶段。
特别是2005年山东省实施测土配方施肥项目以来,定位监测点数量快速增加,2006~2007年在粮田监测的基础上,逐步在果园、菜地上设点监测,到2015年全省耕地质量监测网络基本建成,网点总数达到了2300多个。
2016年根据“全国农技中心关于做好耕地质量监测点布局规划的通知(农技土肥水函〔2016〕399号)”要求,对以前的网点规划调整,分级管理,进一步健全完善了国家、省、市、县四级耕地质量监测网络,点位数2839个。
2014年1.国家食品药品监督管理总局关于发布医疗器械生产质量管理规范的公告(2014年第64号)/WS01/CL0087/111642.html2.《国家食品药品监督管理总局关于施行医疗器械经营质量管理规范的公告》(2014年第58号)/WS01/CL1294/110920.html3.关于医疗器械(含体外诊断试剂)注册申报有关问题的公告(2014年第129号)/WS01/CL0068/109780.html4.食品药品监管总局关于印发国家重点监管医疗器械目录的通知食药监械监〔2014〕235号/WS01/CL0845/107405.html5.食品药品监管总局关于印发医疗器械生产企业分类分级监督管理规定的通知食药监械监〔2014〕234号/WS01/CL0845/107404.html6.国家食品药品监督管理总局关于发布禁止委托生产医疗器械目录的通告(2014年第18号)/WS01/CL0087/107065.html7.食品药品监管总局办公厅关于实施第一类医疗器械备案有关事项的通知食药监办械管〔2014〕174号/WS01/CL0845/106435.html8.食品药品监管总局关于印发境内第二类医疗器械注册审批操作规范的通知食药监械管〔2014〕209号/WS01/CL0845/106258.html9.食品药品监管总局关于印发境内第三类和进口医疗器械注册审批操作规范的通知食药监械管〔2014〕208号/WS01/CL0845/106257.html10.国家食品药品监督管理总局关于发布体外诊断试剂说明书编写指导原则的通告(2014年第17号)/WS01/CL0087/106242.html11.国家食品药品监督管理总局关于发布体外诊断试剂临床试验技术指导原则的通告(2014年第16号)/WS01/CL0087/106241.html12.国家食品药品监督管理总局关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告(2014年第44号)/WS01/CL0087/106096.html13.国家食品药品监督管理总局关于公布医疗器械注册申报资料要求和批准证明文件格式的公告(2014年第43号)/WS01/CL0087/106095.html14.国家食品药品监督管理总局关于医疗器械生产质量管理规范执行有关事宜的通告(2014年第15号)/WS01/CL0087/106114.html15.国家食品药品监督管理总局关于发布需进行临床试验审批的第三类医疗器械目录的通告(2014年第14号)/WS01/CL0087/105374.html16.食品药品监管总局关于印发医疗器械检验机构开展医疗器械产品技术要求预评价工作规定的通知(食药监械管〔2014〕192号)/WS01/CL0845/105194.html17.国家食品药品监督管理总局关于发布免于进行临床试验的第三类医疗器械目录的通告(2014年第13号)/WS01/CL0087/105225.html18.国家食品药品监督管理总局关于发布免于进行临床试验的第二类医疗器械目录的通告(2014年第12号)/WS01/CL0087/105224.html19.食品药品监管总局关于实施《医疗器械注册管理办法》和《体外诊断试剂注册管理办法》有关事项的通知(食药监械管〔2014〕144号)/WS01/CL0845/103802.html20.食品药品监管总局关于实施《医疗器械生产监督管理办法》和《医疗器械经营监督管理办法》有关事项的通知(食药监械监〔2014〕143号)/WS01/CL0845/103801.html21.《医疗器械说明书和标签管理规定》(总局令第6号)/WS01/CL0053/103758.html22.《体外诊断试剂注册管理办法》(总局令第5号)/WS01/CL0053/103757.html23.《医疗器械注册管理办法》(总局令第4号)/WS01/CL0053/103756.html24.国家食品药品监督管理总局关于发布医疗器械产品技术要求编写指导原则的通告(2014年第9号)/WS01/CL0087/100814.html25.国家食品药品监督管理总局关于发布第一类医疗器械产品目录的通告(2014年第8号)/WS01/CL0087/100815.html26.国家食品药品监督管理总局关于第一类医疗器械备案有关事项的公告(2014年第26号)/WS01/CL0087/100816.html27.国家食品药品监督管理总局关于医疗器械生产经营备案有关事宜的公告(2014年第25号)/WS01/CL0087/100800.html28.国家食品药品监督管理总局关于贯彻实施《医疗器械监督管理条例》有关事项的公告(2014年第23号)/WS01/CL0087/100480.html29.《医疗器械监督管理条例》(国务院令第650号)/WS01/CL0784/97814.html30.总局关于印发创新医疗器械特别审批程序(试行)的通知(食药监械管〔2014〕13号)/WS01/CL0845/96654.html2015年1.《医疗器械通用名称命名规则》(总局令第19号)/WS01/CL0053/139000.html2.国家食品药品监督管理总局关于发布医疗器械注册指定检验工作管理规定的通告(2015年第94号)/WS01/CL0087/136660.html3.国家食品药品监督管理总局关于发布医疗器械注册证补办程序等5个相关程序的通告(2015年第91号)/WS01/CL0087/135860.html4.国家食品药品监督管理总局关于规范含银盐医疗器械注册管理有关事宜的公告(2015年第225号)/WS01/CL0087/134580.html5.食品药品监管总局关于执行医疗器械和体外诊断试剂注册管理办法有关问题的的通知(食药监械管〔2015〕247号)/WS01/CL0845/134021.html6.国家食品药品监督管理总局关于境内医疗器械生产企业跨省新开办企业时办理产品注册及生产许可有关事宜的公告(2015年第203号)/WS01/CL0087/133069.html7.《医疗器械使用质量监督管理办法》(总局令第18号)/WS01/CL0053/132880.html8.食品药品监管总局关于印发医疗器械医疗器械生产质量管理规范现场检查指导原则等4个指导原则的通知(食药监械监〔2015〕218号)/WS01/CL0845/130869.html9.关于体外诊断试剂临床试验机构盖章有关事宜的公告(2015年第154号)/WS01/CL0068/128860.html10.《医疗器械分类规则》(总局令第15号)/WS01/CL0053/124222.html11.国家食品药品监督管理总局关于发布医疗器械生产质量管理规范附录体外诊断试剂的公告(2015年第103号)/WS01/CL0087/124119.html12.国家食品药品监督管理总局关于发布医疗器械生产质量管理规范附录植入性医疗器械的公告(2015年第102号)/WS01/CL0087/124118.html13.国家食品药品监督管理总局关于发布医疗器械生产质量管理规范附录无菌医疗器械的公告(2015年第101号)/WS01/CL0087/124117.html14.国家食品药品监督管理总局关于发布医疗器械临床试验备案有关事宜的公告(2015年第87号)/WS01/CL0087/123460.html15.食品药品监管总局关于印发境内第三类医疗器械注册质量管理体系核查工作程序(暂行)的通知(食药监械管〔2015〕63号)/WS01/CL0845/121049.html16.《国家食品药品监督管理总局关于发布药品、医疗器械产品注册收费标准的公告》(2015年第53号)/WS01/CL1294/120201.html17.国家食品药品监督管理总局关于发布医疗器械临床评价技术指导原则的通告(2015年第14号)/WS01/CL0087/119643.html18.国家食品药品监督管理总局关于发布医疗器械生产企业供应商审核指南的通告(2015年第1号)/WS01/CL0087/112629.html2016年1.总局关于发布医疗器械生产企业质量控制与成品放行指南的通告(2016年第173号)/WS01/CL1294/168287.html2.总局关于发布医疗器械优先审批程序的公告(2016年第168号)/WS01/CL0087/165582.html3.总局关于发布第二批免于进行临床试验医疗器械目录的通告(2016年第133号)/WS01/CL0087/164956.html4.总局办公厅关于体外诊断试剂说明书文字性变更有关问题的通知(食药监办械管〔2016〕117号)/WS01/CL0845/161645.html5.总局办公厅关于贯彻实施《医疗器械临床试验质量管理规范》的通知(食药监办械管〔2016〕41号)/WS01/CL0845/149540.html6.总局关于实施《医疗器械通用名称命名规则》有关事项的通知(食药监械管〔2016〕35号)/WS01/CL0845/148881.html7.《医疗器械临床试验质量管理规范》(总局、卫计委令第25号)/WS01/CL0053/148101.html8.总局关于发布《医疗器械临床试验伦理审查申请与审批表范本》等六个文件的通告(2016年第58号)/WS01/CL0087/148126.html9.总局办公厅关于医疗器械产品技术要求有关问题的通知(食药监办械管〔2016〕22号)/WS01/CL0845/145601.html10.总局关于第三类医疗器械生产企业实施医疗器械生产质量管理规范有关事宜的通告(2016年第19号)/WS01/CL1294/144100.html2017年1.总局办公厅关于做好医疗器械检验有关工作的通知(食药监办械管〔2017〕187号)/WS01/CL0845/221407.html2.总局关于过敏原类、流式细胞仪配套用、免疫组化和原位杂交类体外诊断试剂产品属性及类别调整的通告(2017年第226号)/WS01/CL1294/220850.html3.《医疗器械网络销售监督管理办法》(总局令第38号)/WS01/CL1101/220098.html4.国家食品药品监督管理总局国家卫生和计划生育委员会关于发布医疗器械临床试验机构条件和备案管理办法的公告(2017年第145号)/WS01/CL0087/217367.html5.总局办公厅关于做好医疗器械临床试验机构备案工作的通知(食药监办械管〔2017〕161号)/WS01/CL0845/217380.html6.《医疗器械经营监督管理办法》(总局令第8号)(2017-11-21修订)/WS01/CL0053/217162.html7.《医疗器械生产监督管理办法》(总局令第7号)(2017-11-21修订)/WS01/CL1101/217161.html8.总局关于需审批的医疗器械临床试验申请沟通交流有关事项的通告(2017年第184号)/WS01/CL0087/216841.html9.总局关于进口医疗器械注册申请人和备案人名称使用中文的公告(2017年第131号)/WS01/CL0087/216229.html10.总局关于医疗器械经营备案有关事宜的公告(2017年第129号)/WS01/CL0050/216296.html11.总局办公厅关于规范医疗器械产品分类有关工作的通知(食药监办械管〔2017〕127号)/WS01/CL0845/177958.html12.总局关于发布聚氯乙烯输液输血器具中荧光物质识别及定量补充检验方法的公告(2017年第110号)/WS01/CL1294/177496.html13.总局关于实施《医疗器械分类目录》有关事项的通告(2017年第143号)/WS01/CL0087/177087.html14.总局关于发布医疗器械分类目录的公告(2017年第104号)/WS01/CL0087/177089.html15.总局办公厅关于印发2017年医疗器械行业标准制修订项目的通知(食药监办械管〔2017〕94号)/WS01/CL0845/174746.html16.总局关于贯彻实施《国务院关于修改〈医疗器械监督管理条例〉的决定》有关事项的公告(2017年第78号)/WS01/CL0087/174096.html17.《医疗器械标准管理办法》(总局令第33号)/WS01/CL0053/172049.html18.总局办公厅关于印发国家食品药品监督管理总局医疗器械分类技术委员会工作规则的通知(食药监办械管〔2017〕56号)/WS01/CL0845/171682.html19.《国家食品药品监督管理总局关于调整部分医疗器械行政审批事项审批程序的决定》(总局令第32号)/WS01/CL0053/171404.html20.总局关于成立医疗器械分类技术委员会专业组的通知(食药监械管〔2017〕27号)/WS01/CL0845/171324.html21.总局关于发布医疗器械技术审评专家咨询委员会管理办法的公告(2017年第36号)/WS01/CL0087/171212.html22.总局关于发布医疗器械优先审批申报资料编写指南(试行)的通告(2017年第28号)/WS01/CL0087/169620.html23.《体外诊断试剂注册管理办法修正案》(总局令第30号)/WS01/CL0053/169364.html24.《医疗器械召回管理办法》(总局令第29号)/WS01/CL0053/169345.html25.总局关于发布医疗器械审评沟通交流管理办法(试行)的通告(2017年第19号)/WS01/CL0087/169361.html2018年(截至5月7日)1. 总局办公厅关于实施《医疗器械网络销售监督管理办法》有关事项的通知(食药监办械监〔2018〕31号)/WS01/CL0050/225541.html2. 关于发布《自行取消进口第一类医疗器械备案工作程序》的公告(第206号)/WS01/CL0068/224399.html3. 国家药品监督管理局办公室关于公开征求《创新医疗器械特别审批程序(修订稿征求意见稿)》的意见/WS04/CL2051/227922.html。
国家市场监督管理总局通告2019年第16号——市场监管总局关于2018年全国汽车安全与召回状况的通告文章属性•【制定机关】国家市场监督管理总局•【公布日期】2019.05.14•【文号】国家市场监督管理总局通告2019年第16号•【施行日期】2019.05.14•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】市场规范管理正文国家市场监督管理总局通告2019年第16号市场监管总局关于2018年全国汽车安全与召回状况的通告汽车召回是国际通行的产品安全监管制度,是加强事中事后监管的重要举措。
我国汽车召回制度实施15年来,消除了大量的安全隐患,维护了消费者人身财产和社会公共安全,同时引导企业实施技术改进,有效提升了产品质量总体水平。
根据《缺陷汽车产品召回管理条例》及其实施办法,现将2018年全国汽车安全与召回状况通告如下。
一、汽车安全状况我国机动车产销量超过美国,连续10年位居世界第一。
2018年,我国汽车制造业工业增加值比上年增长4.9%;汽车产量达到2781.9万辆,下降4.1%。
其中,基本型乘用车(轿车)1160.1万辆,运动型多用途乘用车(SUV)927.4万辆。
新能源汽车作为工业战略性新兴产业,产业规模发展迅速。
2018年,新能源汽车产量115万辆,比上年增长66.2%。
2018年汽车出口115万辆,进口113万辆[1]。
截至2018年底,全国机动车保有量已达3.27亿辆[2],比上年增长10.5%;全国民用汽车保有量2.4亿辆,其中私人汽车保有量2.07亿辆[3]。
新能源汽车保有量达到261万辆,占汽车总数的1.09%。
机动车驾驶人达4.09亿人,其中汽车驾驶人3.69亿人[4]。
截至2018年底,921家汽车生产企业按照《缺陷汽车产品召回管理条例》要求备案了产品技术资料、技术服务活动等信息。
随着机动车保有量不断增加,机动车产品安全问题也备受关注。
2018年我国道路交通事故万车死亡人数为1.93人,比上年下降6.3%[5]。
中国医疗器械法规清单(更新至2020/01)《医疗器械监督管理条例》于2014年6月1日起正式实施,并于2017年5月4日修订,各类配套规章及规范性文件亦于近年来陆续制修订并发布。
各医疗器械企业作为受法规变化影响最大的相关方,应积极应对新法规政策下的挑战,密切关注最新法规动态,提前做好攻略规划,确保产品尽快获批上市!完善自身法规体系,确保企业合法合规生产经营!为方便各企业检索最新法规,本协会特收集、整理、编制国家药品监督管理局(NMPA)已发布的医疗器械法规文件(包括但不限于)清单,供大家参考。
各企业应根据自身实际情况及产品领域,对各类法规进行识别、收集、评估、导入、宣贯培训。
一、行政法规1. 《医疗器械监督管理条例》(国务院令第680号)二、部门规章1. 医疗器械注册管理办法(CFDA局令第4号)2. 体外诊断试剂注册管理办法(CFDA局令第5号)3. 医疗器械说明书和标签管理规定(CFDA局令第6号)4. 医疗器械生产监督管理办法(CFDA局令第7号)5. 医疗器械经营监督管理办法(CFDA局令第8号)6. 药品医疗器械飞行检查办法(CFDA局令第14号)7. 医疗器械分类规则(CFDA局令第15号)8. 医疗器械使用质量监督管理办法(CFDA局令第18号)9. 医疗器械通用名称命名规则(CFDA局令第19号)10. 医疗器械临床试验质量管理规范(CFDA国家卫计委令第25号)11. 医疗器械召回管理办法(CFDA局令第29号)12. 体外诊断试剂注册管理办法修正案(CFDA局令第30号)13. 关于调整部分医疗器械行政审批事项审批程序的决定(CFDA局令第32号)14. 医疗器械标准管理办法(CFDA局令第33号)15. 医疗器械网络销售监督管理办法(CFDA局令第38号)16. 医疗器械不良事件监测和再评价管理办法(国家市场监督管理总局令第1号)三、通告1. 关于发布第一类医疗器械产品目录的通告(CFDA通告2014年第8号)2. 关于发布医疗器械产品技术要求编写指导原则的通告(CFDA通告2014年第9号)3. 关于发布需进行临床试验审批的第三类医疗器械目录的通告(CFDA通告2014年第14号)4. 关于发布体外诊断试剂临床试验技术指导原则的通告(CFDA通告2014年第16号)5. 关于发布体外诊断试剂说明书编写指导原则的通告(CFDA通告2014年第17号)6. 关于发布禁止委托生产医疗器械目录的通告(CFDA 通告2014年第18号)7. 关于发布医疗器械生产企业供应商审核指南的通告(CFDA通告2015年第1号)8. 关于发布医疗器械临床评价技术指导原则的通告(CFDA通告2015年第14号)9. 关于发布医疗器械产品出口销售证明管理规定的通告(CFDA通告2015年第18号)10. 关于贯彻落实小微企业行政事业性收费优惠政策的通告(CFDA通告2015年第31号)11. 关于生产一次性使用无菌注、输器具产品有关事项的通告(CFDA通告2015年第71号)12. 关于发布医疗器械注册证补办程序等5个相关工作程序的通告(CFDA通告2015年第91号)13. 关于发布医疗器械注册指定检验工作管理规定的通告(CFDA通告2015年第94号)14. 关于发布医疗器械工艺用水质量管理指南的通告(CFDA通告2016年第14号)15. 关于发布《医疗器械临床试验伦理审查申请与审批表范本》等六个文件的通告(CFDA通告2016年第58号)16. 关于发布医疗器械生产企业质量管理体系年度自查报告编写指南的通告(CFDA通告2016年第76号)17. 关于发布医疗器械生产企业质量控制与成品放行指南的通告(CFDA通告2016年第173号)18. 关于发布医疗器械网络安全注册技术审查指导原则的通告(CFDA通告2017年第13号)19. 关于发布医疗器械审评沟通交流管理办法(试行)的通告(CFDA通告2017年第19号)20. 关于发布医疗器械优先审批申报资料编写指南(试行)的通告(CFDA通告2017年第28号)21. 关于实施《医疗器械分类目录》有关事项的通告(CFDA通告2017年第143号)22. 关于发布免于进行临床试验的体外诊断试剂临床评价资料基本要求(试行)的通告(CFDA通告2017年第179号)23. 关于需审批的医疗器械临床试验申请沟通交流有关事项的通告(CFDA通告2017年第184号)24. 关于发布医疗器械注册单元划分指导原则的通告(CFDA通告2017年第187号)25. 关于发布移动医疗器械注册技术审查指导原则的通告(CFDA通告2017年第222号)26. 关于过敏原类、流式细胞仪配套用、免疫组化和原位杂交类体外诊断试剂产品属性及类别调整的通告(CFDA通告2017年第226号)27. 关于发布接受医疗器械境外临床试验数据技术指导原则的通告(CFDA通告2018年第13号)28. 关于公布新修订免于进行临床试验医疗器械目录的通告(NMPA通告2018年第94号)29. 关于发布医疗器械生产企业管理者代表管理指南的通告(NMPA通告2018年第96号)30. 关于医疗器械经营企业跨行政区域设置库房办理事项的通告(NMPA通告2018年第108号)31. 关于发布创新医疗器械特别审查申报资料编写指南的通告(NMPA通告2018年第127号)32. 关于调整药械组合产品属性界定有关事项的通告(NMPA通告2019年第28号)33. 关于发布医疗器械注册申请电子提交技术指南的通告(NMPA通告2019年第29号)34. 关于医疗器械电子申报有关资料要求的通告(NMPA 通告2019年第41号)35. 关于发布《医疗器械产品注册项目立卷审查要求(试行)》等文件的通告(NMPA通告2019年第42号)36. 关于发布医疗器械生产质量管理规范附录独立软件的通告(NMPA通告2019年第43号)37. 关于做好第一批实施医疗器械唯一标识工作有关事项的通告(NMPA通告2019年第72号)38. 关于公布新增和修订的免于进行临床试验医疗器械目录的通告(NMPA通告2019年第91号)39. 关于发布医疗器械附条件批准上市指导原则的通告(NMPA通告2019年第93号)40. 关于发布医疗器械通用名称命名指导原则的通告(NMPA通告2019年第99号)四、公告1. 关于医疗器械生产经营备案有关事宜的公告(CFDA 公告2014年第25号)2. 关于第一类医疗器械备案有关事项的公告(CFDA公告2014年第26号)3. 关于公布医疗器械注册申报资料要求和批准证明文件格式的公告(CFDA公告2014年第43号)4. 关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告(CFDA公告2014年第44号)5. 关于施行医疗器械经营质量管理规范的公告(CFDA 公告2014年第58号)6. 关于发布医疗器械生产质量管理规范的公告(CFDA 公告2014年第64号)7. 关于发布药品、医疗器械产品注册收费标准的公告(CFDA公告2015年第53号)8. 关于医疗器械临床试验备案有关事宜的公告(CFDA 公告2015年第87号)9. 关于发布医疗器械生产质量管理规范附录无菌医疗器械的公告(CFDA公告2015年第101号)10. 关于发布医疗器械生产质量管理规范附录植入性医疗器械的公告(CFDA公告2015年第102号)11. 关于发布医疗器械生产质量管理规范附录体外诊断试剂的公告(CFDA公告2015年第103号)12. 关于境内医疗器械生产企业跨省新开办企业时办理产品注册及生产许可有关事宜的公告(CFDA公告2015年第203号)13. 关于规范含银盐医疗器械注册管理有关事宜的公告(CFDA公告2015年第225号)14. 关于发布医疗器械冷链(运输、贮存)管理指南的公告(CFDA公告2016年第154号)15. 关于发布医疗器械优先审批程序的公告(CFDA公告2016年第168号)16. 关于发布医疗器械生产质量管理规范附录定制式义齿的公告(CFDA公告2016年第195号)17. 关于发布医疗器械技术审评专家咨询委员会管理办法的公告(CFDA公告2017年第36号)18. 关于第二批规范性文件清理结果的公告(CFDA公告2017年第88号)19. 关于发布医疗器械分类目录的公告(CFDA公告2017年第104号)20. 关于医疗器械经营备案有关事宜的公告(CFDA公告2017年第129号)21. 关于进口医疗器械注册申请人和备案人名称使用中文的公告(CFDA公告2017年第131号)22. 关于发布医疗器械临床试验机构条件和备案管理办法的公告(CFDA公告2017年第145号)23. 关于发布医疗器械标准制修订工作管理规范的公告(CFDA公告2017年第156号)24. 关于修改医疗器械延续注册等部分申报资料要求的公告(NMPA公告2018年第53号)25. 关于医疗器械规范性文件(1998—2013年)清理结果的公告(NMPA公告2018年第37号)26. 关于发布创新医疗器械特别审查程序的公告(NMPA 公告2018年第83号)27. 关于发布药品医疗器械境外检查管理规定的公告(NMPA公告2018年第101号)28. 关于调整医疗器械临床试验审批程序的公告(NMPA 公告2019年第26号)29. 关于实施医疗器械注册电子申报的公告(NMPA公告2019年第46号)30. 关于发布定制式医疗器械监督管理规定(试行)的公告(NMPA公告2019年第53号)31. 关于发布医疗器械唯一标识系统规则的公告(NMPA 公告2019年第66号)32. 关于修改一次性使用无菌导尿管(包)说明书等有关内容的公告(NMPA公告2019年第94号)五、通知性文件1. 关于印发医疗器械质量监督抽查检验管理规定的通知(食药监械监〔2013〕212号)2. 关于印发医疗器械生产日常监督现场检查工作指南的通知(食药监办械监〔2014〕7号)3. 关于实施《医疗器械生产监督管理办法》和《医疗器械经营监督管理办法》有关事项的通知(食药监械监〔2014〕143号)4. 关于实施《医疗器械注册管理办法》和《体外诊断试剂注册管理办法》有关事项的通知(食药监械管〔2014〕144号)5. 关于实施第一类医疗器械备案有关事项的通知(食药监办械管〔2014〕174号)6. 关于印发医疗器械检验机构开展医疗器械产品技术要求预评价工作规定的通知(食药监械管〔2014〕192号)7. 关于印发境内第三类和进口医疗器械注册审批操作规范的通知(食药监械管〔2014〕208号)8. 关于印发境内第二类医疗器械注册审批操作规范的通知(食药监械管〔2014〕209号)9. 关于印发医疗器械生产企业分类分级监督管理规定的通知(食药监械监〔2014〕234号)10. 关于印发国家重点监管医疗器械目录的通知(食药监械监〔2014〕235号)11. 关于启用医疗器械生产经营许可备案信息系统的通知(食药监办械监函〔2014〕476号)12. 关于印发境内第三类医疗器械注册质量管理体系核查工作程序(暂行)的通知(食药监械管〔2015〕63号)13. 关于印发医疗器械经营企业分类分级监督管理规定的通知(食药监械监〔2015〕158号)14. 关于印发医疗器械经营环节重点监管目录及现场检查重点内容的通知(食药监械监〔2015〕159号)15. 关于印发医疗器械生产质量管理规范现场检查指导原则等4个指导原则的通知(食药监械监〔2015〕218号)16. 关于印发医疗器械经营质量管理规范现场检查指导原则的通知(食药监械监〔2015〕239号)17. 关于执行医疗器械和体外诊断试剂注册管理办法有关问题的通知(食药监械管〔2015〕247号)18. 关于印发医疗器械检验机构资质认定条件的通知(食药监科〔2015〕249号)19. 关于成立医疗器械分类技术委员会的通知(食药监械管〔2015〕259号)20. 关于启用医疗器械注册管理信息系统备案子系统的通知(食药监办械管函〔2015〕534号)21. 关于启用医疗器械注册管理信息系统受理和制证、技术审评、行政审批子系统的通知(食药监办械管函〔2015〕804号)22. 关于医疗器械产品技术要求有关问题的通知(食药监办械管〔2016〕22号)23. 关于实施《医疗器械通用名称命名规则》有关事项的通知(食药监械管〔2016〕35号)24. 关于印发一次性使用无菌注射器等25种医疗器械生产环节风险清单和检查要点的通知(食药监械监〔2016〕37号)25. 关于及时公开第二类医疗器械注册信息和第一类医疗器械产品备案信息的通知(食药监办械管〔2016〕65号)26. 关于体外诊断试剂说明书文字性变更有关问题的通知(食药监办械管〔2016〕117号)27. 关于印发医疗器械生产质量管理规范定制式义齿现场检查指导原则的通知(食药监械监〔2016〕165号)28. 关于印发一次性使用塑料血袋等21种医疗器械生产环节风险清单和检查要点的通知(食药监械监〔2017〕14号)29. 关于第一类、第二类医疗器械生产企业实施医疗器械生产质量管理规范有关工作的通知(食药监办械监〔2017〕120号)30. 关于规范医疗器械产品分类有关工作的通知(食药监办械管〔2017〕127号)31. 关于做好医疗器械临床试验机构备案工作的通知(食药监办械管〔2017〕161号)32. 关于做好医疗器械检验有关工作的通知(食药监办械管〔2017〕187号)33. 关于实施《医疗器械网络销售监督管理办法》有关事项的通知(食药监办械监〔2018〕31号)34. 关于印发医疗器械注册技术审查指导原则制修订工作管理规范的通知(药监办〔2018〕13号)35. 关于加强医疗器械生产经营许可(备案)信息管理有关工作的通知(2018年08月02日发布)36. 关于贯彻落实国务院“证照分离”改革要求做好医疗器械上市后监管审批相关工作的通知(药监综械管〔2018〕39号)37. 关于贯彻落实“证照分离”改革措施进一步推进医疗器械审评审批制度改革的通知(药监综械注〔2018〕43号)38. 关于印发医疗器械临床试验检查要点及判定原则的通知(药监综械注〔2018〕45号)39. 关于扩大医疗器械注册人制度试点工作的通知(国药监械注〔2019〕33号)40. 关于印发医疗器械检验工作规范的通知(国药监科外〔2019〕41号)41. 关于印发医疗器械唯一标识系统试点工作方案的通知(药监综械注〔2019〕56号)42. 2018年医疗器械产品分类界定结果汇总(2019年02月18日发布)43. 2019年第一批医疗器械产品分类界定结果汇总(2019年07月18日发布)44. 2019年第二批医疗器械产品分类界定结果汇总(2019年11月25日发布)六、政策解读1. 《医疗器械经营监督管理办法》部分(一)(2015年01月22日发布)2. 《医疗器械生产监督管理办法》部分(一)(2015年01月22日发布)3. 医疗器械注册管理法规解读之一(《医疗器械注册管理办法》和《体外诊断试剂注册管理办法》部分)(2015年02月05日发布)4. 医疗器械注册管理法规解读之二(《医疗器械说明书和标签管理规定》部分)(2015年02月05日发布)5. 关于《药品医疗器械飞行检查办法》的说明(2015年07月08日发布)6. 医疗器械注册管理法规解读之三(关于《医疗器械分类规则》的修订说明)(2015年07月16日发布)7. 医疗器械注册管理法规解读之四(2015年11月02日发布)8. 医疗器械注册管理法规解读之五(2015年11月19日发布)9. 关于《医疗器械使用质量监督管理办法》的说明(2015年11月30日发布)10. 医疗器械注册管理法规解读之六(2016年01月07日发布)11. 关于《医疗器械通用名称命名规则》的说明(2016年01月27日发布)12. 《医疗器械临床试验质量管理规范》解读(2016年03月23日发布)13. 关于《医疗器械优先审批程序》的说明(2016年10月26日发布)14. YY/T0287-2017idt ISO13485:2016《医疗器械质量管理体系用于法规的要求》标准解读(一)(2017年02月04日发布)15. YY/T0287-2017idt ISO13485:2016《医疗器械质量管理体系用于法规的要求》标准解读(二)(2017年02月04日发布)16. 《医疗器械召回管理办法》解读(2017年02月08日发布)17. 《体外诊断试剂注册管理办法修正案》解读(2017年02月08日发布)18. 《医疗器械网络安全注册技术审查指导原则》解读(2017年03月02日发布)19. 《医疗器械标准管理办法》解读(2017年04月26日发布)20. 《医疗器械召回管理办法》解读之二(2017年05月24日发布)21. 图解政策:《医疗器械召回管理办法》解读(2017年06月22日发布)22. 图解政策:医疗器械不良事件那些事(2017年06月24日发布)23. 图解政策:体外诊断试剂注册管理办法修正案(2017年07月28日发布)24. 创新医疗器械特别审批程序相关问题解读(2017年07月31日发布)25. 医疗器械临床试验质量管理相关问题解读(2017年07月31日发布)26. 《医疗器械标准管理办法》解读之一(2017年08月09日发布)27. 《医疗器械标准管理办法》解读之二(2017年08月09日发布)28. 《医疗器械网络安全注册技术审查指导原则》解读(2017年08月09日发布)29. 图解政策:医疗器械临床试验质量管理相关问题解读(2017年09月04日发布)30. 图解政策:创新医疗器械特别审批程序相关问题解读(2017年09月04日发布)31. 图解政策:ISO13485:2016《医疗器械质量管理体系用于法规的要求》标准解读(一)(2017年09月12日发布)32. 图解政策:ISO13485:2016《医疗器械质量管理体系用于法规的要求》标准解读(二)(2017年09月12日发布)33. 《免于进行临床试验的体外诊断试剂临床评价资料基本要求(试行)》解读(2017年11月08日发布)34. 《医疗器械临床试验机构条件和备案管理办法》解读(2017年11月24日发布)35. 《医疗器械网络销售监督管理办法》解读(2017年12月22日发布)36. 《移动医疗器械注册技术审查指导原则》解读(2017年12月29日发布)37. 图解政策:医疗器械网络销售监督管理办法解读一(2018年01月12日发布)38. 图解政策:医疗器械网络销售监督管理办法解读二(2018年01月15日发布)39. 医疗器械临床试验质量管理相关问题解读之二(2018年04月18日发布)40. 《医疗器械分类目录》实施有关问题解读(2018年08月01日发布)41. 图解政策:国家药品监督管理局办公室关于强脉冲光脱毛类产品分类界定的通知(2018年09月26日发布)42. 图解政策:医疗器械注册技术审查指导原则制修订工作管理规范(2018年09月28日发布)43. 图解政策:关于加强医疗器械生产经营许可(备案)信息管理有关工作的通知(2018年09月28日发布)44. 免于进行临床试验医疗器械目录解读(2018年09月30日发布)45. 图解政策:《医疗器械分类目录》实施有关问题解读(2018年10月09日发布)46. 图解政策:新修订的《免于进行临床试验医疗器械目录》解读(2018年10月19日发布)47. 图解政策:《医疗器械不良事件监测和再评价监督管理办法》之一(2018年10月24日发布)48. 图解政策:《医疗器械不良事件监测和再评价监督管理办法》之二(2018年10月25日发布)49. 图解政策:《医疗器械不良事件监测和再评价监督管理办法》之三(2018年10月26日发布)50. 图解政策:《医疗器械不良事件监测和再评价监督管理办法》之四(2018年10月29日发布)51. 图解政策:《医疗器械不良事件监测和再评价监督管理办法》之五(2018年10月30日发布)52. 图解政策:《医疗器械不良事件监测和再评价监督管理办法》之六(2018年10月31日发布)53. 图解政策:《医疗器械不良事件监测和再评价监督管理办法》之七(2018年11月01日发布)54. 图解政策:《医疗器械不良事件监测和再评价监督管理办法》之八(2018年11月02日发布)55. 《创新医疗器械特别审查程序》解读(2018年11月05日发布)56. 图解政策:医疗器械生产企业管理者代表管理指南之一(2018年11月06日发布)57. 图解政策:医疗器械生产企业管理者代表管理指南之二(2018年11月06日发布)58. 图解政策:医疗器械生产企业管理者代表管理指南之三(2018年11月07日发布)59. 图解政策:关于优化优先审评申请审核工作程序的通知(2018年11月14日发布)60. 图解政策:用于罕见病防治医疗器械注册审查指导原则(之一)(2018年11月29日发布)61. 图解政策:用于罕见病防治医疗器械注册审查指导原则(之二)(2018年11月30日发布)62. 图解政策:关于贯彻落实“证照分离”改革措施进一步推进医疗器械审评审批制度改革的通知(2018年12月03日发布)63. 图解政策:创新医疗器械特别审查程序之一(2018年12月14日发布)64. 图解政策:创新医疗器械特别审查程序之二(2018年12月19日发布)65. 图解政策:创新医疗器械特别审查程序之三(2018年12月19日发布)66. 图解政策:药品医疗器械境外检查管理规定(一)(2019年02月01日发布)67. 图解政策:药品医疗器械境外检查管理规定(二)(2019年02月12日发布)68. 《定制式医疗器械监督管理规定(试行)》解读(2019年07月04日发布)69. 《医疗器械唯一标识系统规则》解读(2019年08月27日发布)70. 免于进行临床试验医疗器械目录汇总(2019年12月23日发布)71. 图解政策:国家药监局关于发布医疗器械附条件批准上市指导原则的通告(2019年第93号)(一)(2020年01月02日发布)72. 图解政策:国家药监局关于发布医疗器械附条件批准上市指导原则的通告(2019年第93号)(二)(2020年01月02日发布)73. 图解政策:国家药监局关于发布医疗器械附条件批准上市指导原则的通告(2019年第93号)(三)(2020年01月02日发布)七、相关法律法规1. 中华人民共和国广告法(2018年11月05日发布)2. 药品、医疗器械、保健食品、特殊医学用途配方食品广告审查管理暂行办法(国家市场监督管理总局令第21号)。
国家市场监督管理总局通告2018年第39号——市场监管总局关于33批次食品不合格情况的通告文章属性•【制定机关】国家市场监督管理总局•【公布日期】2018.11.06•【文号】国家市场监督管理总局通告2018年第39号•【施行日期】2018.11.06•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】食品安全正文国家市场监督管理总局通告2018年第39号市场监管总局关于33批次食品不合格情况的通告近期,市场监管总局组织抽检肉制品、水产制品、乳制品、婴幼儿配方食品和食用农产品等5类食品1209批次样品。
根据食品安全国家标准检验和判定,其中抽样检验项目合格样品1176批次、不合格样品33批次(见附件)。
具体情况通告如下:一、四川省成都市大邑百伦商贸有限公司销售的标称成都利顿食品有限公司生产的烤卤鸡翅(香辣味),菌落总数不符合食品安全国家标准规定。
检验机构为南京市产品质量监督检验院。
二、中兴_沈阳商业大厦(集团)股份有限公司中兴超市大东店销售的标称金百味集团·大连金百味食品有限公司生产的金百味里脊火腿,菌落总数不符合食品安全国家标准规定。
检验机构为黑龙江省质量监督检测研究院。
三、天猫汉味黑鸭旗舰店(经营者为武汉汉哈哈食品有限公司)在天猫(网站)销售的标称武汉汉哈哈食品有限公司生产的汉味黑鸭(全鸭),菌落总数不符合食品安全国家标准规定。
检验机构为国家肉类食品质量监督检验中心。
四、1号店(经营者为上海京东才奥电子商务有限公司)在1号店(网站)销售的标称佳木斯市哈尔香食品有限公司生产的林道斯哈尔滨风味红肠,菌落总数不符合食品安全国家标准规定。
检验机构为国家肉类食品质量监督检验中心。
五、京东桂花鸭官方旗舰店(经营者为南京桂雨鸭食品有限公司)在京东商城(网站)销售的标称南京桂雨鸭食品有限公司生产的490g盐水鸭,菌落总数不符合食品安全国家标准规定。
检验机构为国家肉类食品质量监督检验中心。
六、天猫互惠食品专营店(经营者为福建沙县郑湖垚香胡记板鸭食品厂)在天猫(网站)销售的标称福建沙县郑湖垚香胡记板鸭食品厂生产的板鸭,菌落总数不符合食品安全国家标准规定。
中国气象局关于发布2018年度气象行业标准复审结论的通告正文:----------------------------------------------------------------------------------------------------------------------------------------------------中国气象局关于发布2018年度气象行业标准复审结论的通告气发〔2019〕3号中国民用航空局,联合参谋部战场环境保障局,黑龙江省农垦总局、黑龙江省森林工业管理总局、中国盐业总公司,新疆生产建设兵团气象局,南京信息工程大学、成都信息工程大学,各省、自治区、直辖市气象局,各直属单位,各内设机构:按照有关规定,中国气象局组织对2018年以前发布的现行有效气象行业标准进行了复审,现将复审结论予以公布。
附件:气象行业标准2018年度复审结论附件2018年度气象行业标准复审结论序号标准编号标准名称复审结论备注1QX/T 1—2000Ⅱ型自动气象站继续有效2QX/T 2—2016新一代天气雷达站防雷技术规范继续有效3QX 3—2000气象信息系统雷击电磁脉冲防护规范废止4QX 4—2015气象台(站)防雷技术规范修订待修订。
修订后转为推荐性标准5QX/T 6—2013气象仪器型号与命名方法修订待修订6QX/T 8—2002气象仪器术语修订正在修订。
项目编号: QX/T—2010—07,项目负责单位:长春气象仪器研究所7QX 10.1—2002电涌保护器第1部分:性能要求和试验方法修订完成修订。
QX/T 10.1—2018已发布,2019年3月1日实施8QX/T 10.2—2007电涌保护器第2部分:在低压电气系统中的选择和使用原则修订完成修订。
QX/T 10.2—2018已发布,2019年3月1日实施9QX/T 10.3—2007电涌保护器第3部分:在电子系统信号网络中的选择和使用原则修订正在修订。