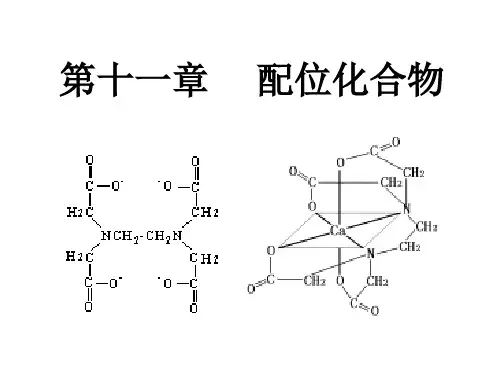
奠基时期:1893-----1940 1893年仅26岁化学家Werner (1913年获得诺贝尔化学奖) 提出了配位学说。 1931年Pauling提出了价键理论,将杂化 轨道理论运用于配合物,成功解释了其磁性。 获1954年诺贝尔化学奖。 美国的H.Taube阐述了配合物电子转移反应 机理,获1983年诺贝尔化学奖。
n(n 2)B , n为单电子数
玻尔磁子B = 9.27 10-24 A· 2 m
n μ/μB 0 1 2 3 0.00 1.73 2.83 3.87 4 4.90 5 5.92
通过测定磁矩,可计算出未成对电子数n ,与 中心原子基态的未成对电子数n0比较,进而判断中心 原子空轨道的杂化类型及配离子的空间构型
这些习惯名称均不符合系统命名法。
第二节 配合物的化学键理论
配合物的各种理化性质都取决于它们
的特殊结构, 其结构特点主要是中心离子与
配位原子之间的特殊结合方式.
价键理论(Valence Bonding Theory)
(1931年,美国化学家Pauling提出)
晶体场理论(Crystal Field Theory)
sp,sp3,sp3d2
一般规律:1.中心原子:d9 d10 2.中心原子:d4 ~ d8时 配位原子:电负性较大 易形成外轨型配合物 特点:空轨道杂化--成键, 不稳定,磁矩较大。
2. 内轨型配合物 —— 有次外层d轨道参与的 价电子空轨道进行的杂化 ——(n-1)d,ns,np
dsp2,d2sp3
例如:[Cu(NH3)4]2+ 四氨合铜(II)配离子
3.配体的命名次序为:
(1) 先无机配体,后有机配体 顺—二氯· 乙二胺合铂(Ⅱ) Cis—[PtCl2(en)] (2) 无机配体中,先离子, 后分子 K[PtCl3(NH3)]


![基础化学第十一章配位化合物[可修改版ppt]](https://uimg.taocdn.com/71a374f1376baf1ffd4fad3c.webp)




