金纳米微粒表面能量转移及半胱氨酸的高灵敏度高选择性分析法_刘春
- 格式:pdf
- 大小:1.13 MB
- 文档页数:7

文章编号: 1008-9357(2022)01-0077-08DOI: 10.14133/KI.1008-9357.20210411002金纳米粒子/聚吡咯-聚多巴胺电化学免疫传感器曲春波1, 张静怡1, 那立欣1, 罗 静2(1. 上海健康医学院,上海 201318;2. 江南大学化学与材料工程学院,江苏 无锡 214122)摘 要: 以金纳米粒子功能化的聚吡咯-聚多巴胺(PPy-PDA )为基质材料,构建了电化学免疫传感器用于癌胚抗原(CEA )的检测。
首先制备了PPy-PDA 复合物,通过聚多巴胺的弱还原性原位还原氯金酸,得到纳米金/聚吡咯-聚多巴胺(Au/PPy-PDA )纳米复合材料。
该复合材料具有优异的导电性、水分散性和黏附性,能够在电极表面形成均一、稳定且生物相容性优良的导电膜,利用纳米金与癌胚抗体的特殊作用固定癌胚抗体,并通过牛血清白蛋白屏蔽电极表面的非特异性吸附点,从而构筑了一种用于检测CEA 的电化学免疫传感器。
所制备的传感器对CEA 具有特异性、识别性,在最优条件下,对CEA 的线性检测范围为10−12 ~5×10−7 g/mL ,检测下限为0.2 pg/mL 。
此外,还考察了该传感器的重现性和稳定性,并进行了实际样品中CEA 的回收实验。
该传感器具有检测范围宽、检测限低且稳定性好的特点,在生物医学、临床诊断等方面具有潜在的应用价值。
关键词: 电化学免疫传感器;聚吡咯;聚多巴胺;癌胚抗原中图分类号: O632.6 文献标志码: AElectrochemical Immunosensor Based on Gold Nanoparticles/Polypyrrole-PolydopamineQU Chunbo 1, ZHANG Jingyi 1, NA Lixin 1, LUO Jing 2(1. Shanghai University of Medicine & Health Sciences, Shanghai 201318, China; 2. School of Chemical and MaterialEngineering, Jiangnan University, Wuxi 214122, Jiangsu, China )AuCl −4Abstract: A novel ultrasensitive impedimetric immunosensor was constructed for the detection of carcino-embryonic antigen (CEA) using conductive and adhesive bio-inspired gold/polypyrrole-polydopamine nanocomposites as an immobilization matrix. A polypyrrole-polydopamine (PPy-PDA) complex was first prepared by the polymerization of pyrrole and dopamine, which was then blended with the chloroauric acid solution (HAuCl 4). The in-situ reduction of to gold nanoparticles (Au NPs) by polydopamine led to the successful preparation of gold/polypyrrole-polydopamine nanocomposites (Au/PPy-PDA). Au/PPy-PDA was characterized by Fourier transmission infrared (FT-IR) spectroscopy, scanning electronic microscopy (SEM) coupled with energy dispersive X-ray spectroscopy (EDX) and electrical conductivity test. The dispersion test and adhesion test showed that PPy-PDA possessed good dispersibility in water and outstanding adhesion performance.The electrochemical measurement showed that Au/PPy-PDA not only provided a highly stable and biocompatible matrix for 收稿日期: 2021-04-11基金项目: 国家自然科学基金(51573072)作者简介: 曲春波(1980—),山东青岛人,副教授,从事生物医用高分子的研究。

发光金纳米粒子测定曲通X-100及其临界胶束浓度刘玫瑰;曹春;曹明;朱昌青【期刊名称】《分析化学》【年(卷),期】2009(37)10【摘要】参照文献方法合成了BSA保护的水溶性发光金纳米粒子, 并考察了此探针在非离子表面活性剂曲通X-100中的发光行为.根据观察到的发光增强效应, 建立了一种简单的测定曲通X-100的方法.考察了发光金纳米粒子的浓度、体系酸度、反应时间及共存物质对测定的影响.在最佳条件下, 发光强度与曲通X-100的浓度分别在0~150 μmol/L和150~600 μmol/L范围内分段成正比关系.两条工作曲线的交点所对应的浓度与曲通X-100的临界胶束浓度十分吻合, 为胶束形成过程提供了直接的指示.作为一种生物相容性探针, 发光金纳米粒子被用于生物学样品中曲通X-100的分析测定, 结果令人满意.【总页数】4页(P1503-1506)【作者】刘玫瑰;曹春;曹明;朱昌青【作者单位】安徽师范大学化学与材料科学学院,安徽省化学与生物传感重点实验室,芜湖,241000;安徽师范大学化学与材料科学学院,安徽省化学与生物传感重点实验室,芜湖,241000;安徽师范大学化学与材料科学学院,安徽省化学与生物传感重点实验室,芜湖,241000;安徽师范大学化学与材料科学学院,安徽省化学与生物传感重点实验室,芜湖,241000【正文语种】中文【中图分类】O6【相关文献】1.曲拉通X-100与β-环糊精协同增敏-偶氮胂Ⅲ-分光光度法测定镧(Ⅲ) [J], 张立科;张新海;付冰冰;杨风岭2.达旦黄-曲通X-100体系共振光散射法测定蛋白质 [J], 冯素玲;王瑾;樊静3.高效液相色谱法测定质粒pUDKH中曲拉通X-100的含量 [J], 刘佳;张庆林;毕建进;王正平;吴祖泽4.用一种新的疏水共轭聚合物荧光测定曲通X-100及其临界胶束浓度 [J], 李鸣凤;孙礼林;郝丹;朱昌青5.曲拉通X-100稀释直接进样-石墨炉原子吸收光谱法测定牛奶中的铅 [J], 戴瑞平;刘花梅;陈林因版权原因,仅展示原文概要,查看原文内容请购买。
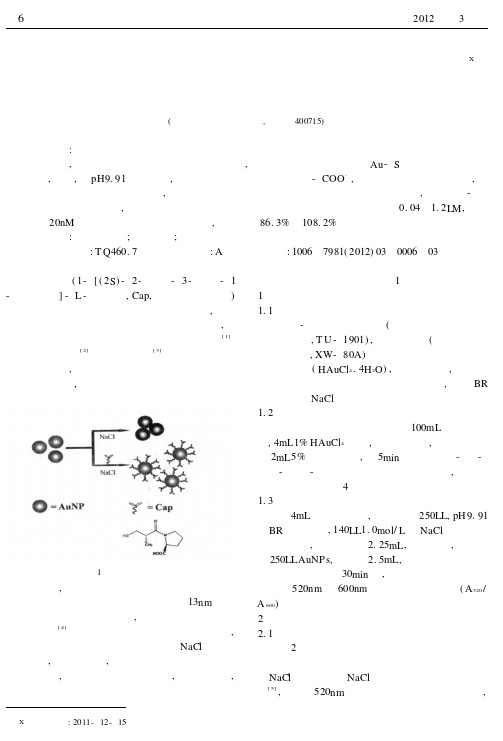
基于金纳米粒子局域表面等离子体共振吸收检测卡托普利X许 丹(西南大学化学化工学院,重庆 400715) 摘 要:柠檬酸根稳定的金胶在一定盐浓度下由于盐的电荷屏蔽效应而发生聚集。
加入一定浓度的卡托普利后,由于卡托普利分子中含有巯基和羧基,其分子中的巯基可以通过Au -S 键连在金纳米粒子表面,同时,在pH9.91的条件下,其分子中的羧基去质子化形成-COO -,导致金胶表面负电荷增多,纳米粒子之间的静电排斥力增大,金胶的聚集得到了抑制。
基于金胶由聚集到分散的现象,利用紫外-可见吸收光谱进行表征,建立了定量检测卡托普利含量的方法。
该方法的线性范围为0.04~1.2L M ,检出限为20nM 。
将此方法用于合成样的检测,回收率在86.3%~108.2%之间。
关键词:金纳米粒子;卡托普利;表面等离子体共振吸收 中图分类号:T Q460.7 文献标识码:A 文章编号:1006—7981(2012)03—0006—03 卡托普利(1-[(2S )-2-甲基-3-巯基-1-氧化丙基]-L -脯氨酸,Cap,结构如下图所示)是一种人工合成的血管紧张素转换酶抑制剂,目前广泛应用于治疗高血压及心力衰竭等疾病。
目前,定量测定卡托普利的分析方法有高效液相色谱法[1]、氧化还原滴定法[2]及化学发光法[3]等。
这些方法虽然灵敏度较高,但存在一些缺点如仪器设备昂贵、操作繁琐等。
因此,建立简便、快速、灵敏度高的检测卡托普利的方法仍然具有十分重要的意义。
图1 实验原理图近年来,金纳米粒子由于其独特的表面等离子体共振吸收性质被广泛用于色度传感。
13nm 柠檬酸根包被的金胶呈现酒红色,一旦发生聚集则呈现紫色或蓝色[4]。
这种颜色的改变很容易用肉眼捕获,不需要复杂的仪器。
金胶在一定浓度的NaCl 溶液中发生聚集,在本研究中,我们发现当体系中同时存在卡托普利后,金胶的聚集能得到抑制,基于此现象,建立了一种金胶由聚集到分散的状态来高灵敏检测卡托普利的新方法。

金纳米粒子富集-高效液相色谱同时测定人血浆中三种氨基硫醇蒙芳;刘承伟;陈敏;卢昕;赵书林【期刊名称】《色谱》【年(卷),期】2012(30)10【摘要】建立了金纳米粒子富集-高效液相色谱-紫外检测( HPLC-UVD)同时测定人血浆中3种氨基硫醇(半胱氨酸( Cys)、高半胱氨酸(Hcys)、谷胱甘肽(GSH))的新方法.以Tween 20修饰的金纳米粒子作为选择探针萃取富集氨基硫醇.经二硫苏糖醇脱附后,采用SpursilTMC18柱(250 mm×4.6 mm,5μm)分离氨基硫醇,以60 mmol/L磷酸盐缓冲溶液(pH 2.0)等度洗脱,检测波长为200 nm.3种氨基硫醇的浓度分别在0.025 ~350 μmol/L、0.02 ~60μmol/L、0.01~50 μmol/L内与峰面积具有良好的线性关系,相关系数均高于0.99.方法检出限(信噪比为3)分别为5.0、6.0和2.5 nmol/L,回收率为92.8%~ 106.0%.该方法能显著降低血浆样品中内源性物质的干扰,提高HPLC-UVD的选择性和灵敏度.将该方法应用于心血管病人血浆中上述氨基硫醇的分离测定,结果显示:与对照组相比,疾病组血浆中的Hcys和GSH水平存在显著性差异,Cys不存在显著性差异.%A high performance liquid chromatography ( HPLC) method with ultraviolet detection (UVD) for the simultaneous determination of cysteine ( Cys) , homocysteine (Hcys) and glutathione ( GSH) in human plasma was established. Tween 20-capped gold nanoparticles (Tween 20-AuNPs) were used as selective probes forthe extraction and enrichment of aminothiols. The aminothiols removed from the Tween 20-AuNPs by dithiothreitol were separated on aSpursil?C18 column (250 mm × 4.6 mm, 5 μm) with a mobile phase of 60 mmol/L phosphate buffer solution (pH 2.0). The column eluent was monitored using UVD at the wavelength of 200 nm. The linear ranges were found between peak area and concentration in the ranges of 0.025 -350 μmol/L for Cys, 0. 02 -60 μmol/L for Hcys and 0. 01 -50 μmol/L for GSH, with linear regression coefficients all above 0. 99. The limits of detection (LOD, signal to noise ratio of 3) for the aminothiols were between 2. 5 nmol/L and 6. 0 nmol/L and the recoveries were between 92. 8% and 106. 0%. Due to the significant interference reduction of endogenous substances in the plasma and the subsequent improvement of the selectivity and sensitivity of HPLC-UVD, the present method was applied for the simultaneous analysis of the forementioned aminothiols in the plasma samples of cardiovascular disease patients. The results showed that the levels of Hcys and GSH had significant differences between the patients and the controls, while that of Cys had no significant difference.【总页数】6页(P1056-1061)【作者】蒙芳;刘承伟;陈敏;卢昕;赵书林【作者单位】药用资源化学与药物分子工程教育部重点实验室广西师范大学化学化工学院,广西桂林541004;桂林医学院基础医学院,广西桂林541004;桂林医学院基础医学院,广西桂林541004;药用资源化学与药物分子工程教育部重点实验室广西师范大学化学化工学院,广西桂林541004;药用资源化学与药物分子工程教育部重点实验室广西师范大学化学化工学院,广西桂林541004【正文语种】中文【中图分类】O658【相关文献】1.高效液相色谱法同时测定人血浆中三种视黄酸同分异构体及其临床应用研究 [J], 杨平;李萍2.金纳米粒子固相萃取-高效液相色谱同时测定人血浆中四种吲哚胺 [J], 聂凡;陈晨;刘承伟;卢昕;赵书林3.人血浆中三种头孢菌素类药物浓度高效液相色谱直接进样测定法 [J], 谢景文;孙卫胜;马骏;张强;贾正平;李爱萍;赵桂荣4.柱前衍生高效液相色谱法测定人血浆中17种氨基酸的含量 [J], 陈蓉;周莉;董吉;张华;缪丽燕5.高效液相(HPLC)荧光法同时测定人血浆中4种硫醇物的浓度 [J], 杨涛;沈杰因版权原因,仅展示原文概要,查看原文内容请购买。

基于金纳米颗粒使用电化学催化原理快速识别和定性检测瘤细胞Alfredo de la Escosura-Muniz Christian Sa nchez-Espinel Bele n Dıaz-FreitasAfrica Gonzalez-Fernandez Marisa Maltez-da Costa and Arben Merkoci纳米生物电化学催化组纳米科学协会CIN2 (ICN-CSIC)这是一个高要求简单,快速,高效,为细胞检测用户友好的替代方法一般来说,特别是,为癌症细胞的检测。
一个细胞的生物传感器能检测将是所有理想装置等应用。
纳米粒子成功融入细胞的检测实验,可能允许这种新型的细胞级开发传感器。
事实上,它们的应用潜力在未来的诊断以及其他领域。
作为一种新型生物传感器的例子,我们在这里报告一个电化学装置的肿瘤细胞特异性鉴定,该定量的(AuNPs)金粒子电诱导转移的平台和传感器。
肿瘤细胞的增殖粘附的实现,电诱导转移探测器,其中包括一个大规模生产的荧光碳电极(SPCE)。
在现场鉴定肿瘤细胞的定量检测与实现,装置限量每700ul 4000个细胞。
这个细胞感应装置实验的创造性和选择性是基于细胞表面蛋白的特异性抗体结与纳米颗粒。
最后的检测只需要几分钟,利用催化性能的优势,纳米金颗粒的演变。
装置的检测方法不需要化学剂AuNPs的使用,对现有的纳米金球检测实验,它允许该系统比其他昂贵和复杂的使用方法肿瘤细胞的检测小型化和便宜得多。
我们设想,这个装置能运作,作为免疫或DNA的简单方法的传感器。
此外,它可以被使用,蛋白质分子或DNA检测股,甚至对缺乏经验工作人员也很方便、生物传感器的开发和应用是一个行业领先的国家的最先进的纳米科学和纳米技术。
生物传感器是根据商业发展的许多应用,包括病原体的检测,测量临床参数、监测环境污染物及其它工业应用。
最有效的生物传感器的方式提供给潜在客户,尤其是对开支有限的人,可能会修改技术。

2021金纳米粒子的性质、制备及运用范文 摘要: 近年来,由于金纳米粒子独特的物理化学性质以及良好的生物相容性和生物安全性,吸引越来越多的科研工作者对其展开广泛的研究和开发。
从金纳米粒子的合成方法、特性以及应用开发等方面的对金纳米粒子近年来的研究进展进行了比较详细的综述。
关键词: 金纳米粒子;合成方法; 应用开发; Abstract: Inrecent years, more and more researchers have been attracted to carry out extensive research and development on gold nanoparticles due to their unique physical-chemical properties,good biocompatibility and biosafety. In this paper, the recent research progress of gold nanoparticles was reviewed in detail from the synthetic methods, properties and application development. Keyword: Goldnanoparticles; Synthetisis method; Application development; 金是一种化学性质非常稳定的金属,常用于装饰和货币,但当其尺寸缩小至纳米级别时性质会发生奇特的变化。
金纳米粒子由于具有小尺寸效应、表面效应、量子尺寸效应和宏观量子隧道效应等,会产生不同于块体金的特殊物理化学性质。
1、金纳米粒子的性质 1.1、表面等离子共振特性 在一束波长远大于金纳米粒子的入射光的影响下,金纳米粒子中的电子重新分布,产生库仑力,在方向相反的内外电场共同作用下其自由电子集体震荡发生共振的现象,即表面等离子共振(SPR)。
激光与光电子学进展47,071702(2010)Las er&Op t oelectronics ProgressΖ2010《中国激光》杂志社doi:10.3788/LOP47.071702金纳米棒的光学性质及其在生物医学成像和光热疗法中的应用杨玉东1,2 徐菁华1 杨林梅1 潘卫三2(1沈阳工业大学理学院,辽宁沈阳110178;2沈阳药科大学药学院,辽宁沈阳110023)摘要 与球形金颗粒相比,棒状金颗粒具有更为特殊的表面等离子体共振(SPR)特性,通过控制不同长短轴比可以实现纵向SPR峰位置的人为调控(从可见光区到近红外光区)。
由于金纳米棒表面SPR的强吸收导致的发光特性,使其在生物组织成像,癌症的诊断和治疗中存在着巨大的应用前景。
结合配体的金纳米棒能够特异性地标记癌症细胞上的受体,并提供特定分子的特有信息,进行生物成像和癌症检测。
另外,金纳米棒能够有效地吸收红外光能量进行局部加热,导致蛋白质变性,并致细胞死亡。
主要回顾各种不同尺寸和形状的金纳米棒的光学特性,综述选择性标记的金纳米棒在生物成像、癌症诊断和光热疗法中的研究进展。
关键词 医用光学与生物技术;金纳米棒;生物成像;光热疗法;癌症中图分类号 R318.51;R392.1 OCIS 170.3880160.4236 文献标识码 AOp t ical P r op e r t ies of Gol d N a n or od a n d It s App lica t i o ni n B i ol ogical I m a gi n g a n d P h ot ot he r m al The r ap yY ang Yudong1,2 Xu J inghua1 Y ang Linmei1 Pa Weisan21College of Scie nce,S he nya ng U niversit y of Tech nology,S he nya ng,Li aoni ng110178,Chi n a2School of Pha r m acy,S he nya ng Pha r m aceutical U niversit y,S he nya ng,Li aoni ng110023,Chi n aAbs t r act Compared with sp herical gold particles,rod2shaped ones exhibit more unique p roperties of surface plasma resonance(SPR).Gold nanorods have two SPR peaks.The lengitudinal suface plasma resonances position depends on rods′aspect ratio.Thus,the LSPR′s position can be cont rolled f rom the visible region to the near inf rared by adjusting the aspect ratio of gold nanorods.Gold nanorods have great potential use in biological tissue imaging,cancer diagnosis and therap y because of it′s SPR and st rong absorption induced luminescence.Au2ligand conjugates can specifically target the receptor on cancer cells,p rovide specific information about specific molecules,and allow molecular2specific imaging and cancer detection.Gold nanorods can efficiently absorb optical energy into localized heat,and induce p rotein denaturation and cells death.The optical p roperties of kinds of gold nanorods are summarized,and the research p rogress of selective targeting of gold nanorods in biological imaging,cancer diagnoses and photothermal therapy is reviewed.Key w or ds medical optics and biotechnology;gold nanorods;biological images;antibody;cancer1 引 言近年来,人们对金纳米材料的研究取得了长足的进步,不但可以制备出不同尺寸的球形粒子,还可以对其形貌加以控制[1],并且发现了一些特殊的实验现象和物理性质[2]。
葡萄糖(Glu)在各种生理活动中起着至关重要的作用,因此Glu的催化氧化及检测具有很高的研究和应用价值。
而金纳米颗粒(AuNPs)可用作葡萄糖氧化酶(GOD)模拟物,AuNPs催化Glu氧化在工业生产、科学研究和生物医学检测中有着广泛应用。
尽管AuNPs具有竞争优势,但缺乏选择性和有限的催化能力一直制约着AuNPs的进一步应用。
近日,东南大学生物科学与医学工程学院的研究团队构建了具有选择性与更高催化活性的金基模拟酶。
他们通过表面涂层和掺杂其他金属来提高AuNPs的类GOD活性。
研究者为研究掺杂不同元素对类GOD活性的影响,制备了四种不同柠檬酸盐修饰的Au-Pt 和Au-Ag摩尔比为1:1的金基纳米颗粒,并以柠檬酸钠-鞣酸法制备的10nmAuNPs作为对照。
用ABTS法检测了金基纳米酶催化Glu的氧化反应。
对Glu浓度依赖性研究表明,所有金基纳米酶催化的Glu氧化反应在实验浓度范围内呈现逐渐增加的趋势。
与平均粒径为10nm的AuNPs相比,粒径在10nm左右的金基掺杂纳米颗粒均能显著提高催化活性。
其中Au-Pt合金纳米颗粒最大提高了类GOD活性。
Au core-Ag shell纳米颗粒在金核外形成了致密的Ag壳层,紧密的包覆在金核表面。
在Au core-Pt shell纳米颗粒中,金核主要与周围铂簇吸附。
铂壳层的疏松结构和铂壳层与金核的不紧密结合,可能增加与基底的接触,也可能导致铂壳层的尺寸增大,分散性和均匀性降低。
结果表明,在相同的10nm 金核条件下,Au@Ag的性能优于Au@Pt。
催化活性的不同不仅是由于元素组成的不同,还可能是由于结构的不同。
接下来研究者制备了Au-Pt摩尔比为3:1-1:3的金铂合金颗粒(AuPtNPs),以进一步探索增强类GOD活性的金基纳米颗粒。
与10nm AuNPs相比,不同掺杂比例的AuPtNPs表现出明显的类GOD活性改善。
纳米材料催化性能受多种内在因素的影响,如元素组成、粒径、形态和表面改性阳离子等。
第1卷第2期2002年淮阴师范学院学报(自然科学版)JOURNAL OF HUAIYIN TEACHERS COLLEGE (NaturaI Science EditiOn )VOI.1NO.22002NAD +在纳米金胶上的组装、表征及其应用研究顾海鹰(南通医学院卫生分析化学教研室,江苏南通226001)摘要:将NAD +固定在纳米金胶-半胱胺修饰的金电极表面构建一种新型的纳米仿生功能界面,用电化学交流阻抗、反射紫外-可见光谱和电化学分析法对其组装过程以及活性进行了表征.基于这种功能界面构建的新型酶生物传感器对乳酸的电催化响应呈现良好的线性,米氏常数为8.8!mOI /L ,检测限为6.0X 10-8mOI /L (!/"=3),且对NAD +的再生和对乳酸的电化学响应机理进行了研究.关键词:烟酰胺腺嘌呤二核苷酸(辅酶,NAD +);乳酸;生物传感器;纳米仿生功能界面;金胶中图分类号:@811.7;@814.2文献标识码:A 文章编号:1671-6876(2002)02-0048-06收稿日期:2002-03-17基金项目:江苏省南通市科委基金资助项目(Z1008)作者简介:顾海鹰(1963-),男,江苏南通人,副教授,博士,现在南京大学从事博士后研究工作,主要研究方向生物电分析化学.纳米金胶自组装技术已有很多报道,这主要是它能使组装在其表面上的蛋白质、酶保持稳定的生物活性的同时[1~10],也使自己保持稳定[11,12].陈洪渊等曾成功地把蛋白质、酶固定在纳米金胶的基础上,保持其生物活性的同时构建了过氧化氢及一氧化氮生物传感器[5~9].在临床诊断和食品生化等领域,乳酸的监测具有重要的意义.通常人们采用化学氧化或酶催化的方法来实现测定.化学氧化法是基于乳酸的氧化产物的光谱、滴定和色谱分析法;酶催化方法是在乳酸脱氢酶(LDH )存在下,乳酸被氧化的同时,形成辅酶(NAD +)的还原态NADH :Lactate +NAD +!"#LDHPyruvate +NADH +H +用吸收和荧光光谱的方法测得NADH 再间接确定乳酸的量.通过固定细胞色素b 2、乳酸氧化酶等在电极表面构建不同类型的安培传感器被用来测定乳酸已有报道[13~16],近来乳酸的电化学传感器是把LDH 和NAD +固定膜修饰在电极表面,通过氧化NADH 再生NAD +,依据电流与乳酸的关系实现乳酸的测定[17].SchIereth [18~22]等报道了一些基于固定辅酶NAD +(及其衍生物)在被一些染料(如CibacrOn BIue 3FG-A 和Triazine Dye )与酶(LDH )修饰的生物亲水性金属界面上的乳酸传感器.WiIIner [23]等也报道了基于LDH 组装在吡咯喹啉并醌-NAD +修饰的金电极上的乳酸传感器.这里,成功地将NAD +组装在纳米金胶-半胱胺修饰的金电极表面,构建一种基于纳米仿生功能界面的乳酸生物传感器.电化学交流阻抗、反射紫外-可见光谱和电化学分析法对其组装过程以及活性进行了表征.这种新型的生物传感器不需要电子媒介体和促进剂,对乳酸呈现电催化活性,用于测定乳酸具有良好的选择性和灵敏度.1实验部分1.1试剂乳酸脱氢酶(LDH )(E.C.1.1.1.27,type XI ,兔肌肉,700U /mg ),烟酰胺腺嘌呤二核苷酸(NAD +)和半胱胺购于Sigma 公司.AuCI 3HCI ·4H 2O (Au%>48%,上海试剂一厂);其它化学试剂均为分析纯.0.1mOI /L 不同pH 值的磷酸盐缓冲溶液(PBS )可通过混合Na 2HPO 4和NaH 2PO 4的贮备液获得(必要时可用0.1mOI /L H 3PO 4或NaOH 调节pH 值).所有实验用水为二次双蒸水$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$.1.2仪器和方法铂丝电极为对电极,饱和甘汞电极为参比电极,工作电极为金盘修饰电极(!=0.5mm )组成的三电极工作系统.CHI 660A 电化学工作站(上海辰华仪器公司)上进行电化学实验,实验温度为2510.2C.循环伏安实验在静止的体系中进行.计时安培实验的施加电压为-250mV ,在搅拌体系中进行.所有测试溶液均经通入高纯氮气除氧15min ,并维持在氮气氛下.反射紫外-可见光谱(UV-Vis )图用UV-240紫外-可见光谱(S1imadzU ,Japan )记录.交流阻抗(EIS )实验在含有1.00X 10-3moI /L K 3fe (CN )6/K 4fe (CN )6(111)-混合物的0.1moI /L 的KCI 溶液中进行.交流阻抗的频率范围为3X 104~1X 105Hz ,所有交流电位的幅度为5mV.1.3电极修饰金丝(纯度大于99.99%)被密封在软玻璃管中,首先用精细砂纸抛光,再用含有AI 203(0.25"m 和0.05"m )浆的毛毡抛光,随后用纯水和乙醇超声波清洗.在含有1.00X 10-3moI /L K 3[fe (CN )6]的0.1moI /L KN03溶液中用循环伏安法测得金电极的几何面积为(1.3010.16)X 10-3cm 2.真实面积可用文献报道的方法测得[24].电极粗糙度是真实面积与几何面积的比值,这里为1.410.2.所有玻璃器具用王水浸泡241,再完全用双蒸水洗涤并用空气吹干.HAUCI 4和Na 3Citrate 在使用前必须用22"m 微孔膜过滤,并置于棕色瓶中保持4C 备用.按文献[3]报道的方法,通过加入一定量的Na 3Citrate 到煮沸的HAUCI 4溶液中制备金胶,当HAUCI 4和Na 3Citrate 面的摩尔比直接影响了金胶粒子的大小,当摩尔比为0.30,0.50,0.75,1.00和1.51,可制得直径为1612.3,2412.1,3112.5,4212.6和5115.1nm 的金胶,可用扫描电子显微镜(SEM ).图1NAD +/金胶-半胱胺修饰全电极的制备过程首先在室温下于黑暗处,将处理好并洗净的金电极浸泡在0.1moI /L 的经过除氧的半胱胺水溶液中21,制得的半胱胺修饰的金电极,经过用双蒸水充分洗涤除去多余物理吸附的半胱胺后,再完全浸泡到胶体金中121(4C ).最后金胶-半胱胺修饰电极被浸泡到含有含有10mg /mL NAD +的pH 7.2PBS 中121(4C ).这样,可获得一种NAD +/金胶-半胱胺-修饰金电极,即一种纳米仿生功能界面.电极的制备过程见图1,制备的修饰电极经洗涤并置于pH 7.2PBS 中4C 保存备用.2结果与讨论2.1固定NAD +条件的优化2.1.1pH 和金胶直径(!)的影响不同尺寸金胶有不同的固定蛋白质能力,研究16,24,31,42和51nm 的金胶对固定NAD +的影响.构建的安培型传感器对乳酸响应与金胶的尺寸有关,实验表明31nm 金胶是最佳的纳米金胶粒子.94第2期顾海鹰:NAD +在纳米金胶上的组装、表征及其应用研究另外NAD +介质的pH 值对组装也有影响.由于NAD +与金胶表面的结合是靠NAD +上的氨基与金胶的化学键作用.NAD +溶液的pH 值会影响NAD +分子的净电荷,将影响与本来带负电荷金胶的作用形成化学键.研究结果表明选择31nm 金胶和pH 7.0的介质,制备的生物传感器有最大的响应电流.事实上当介质pH 值为7.0时,在NAD +中氨基和羟基的氢键被破坏,NAD +中裸露的氨基有利于与金胶结合.因此31nm 金胶和pH 7.0PBS 作为固定基质和NAD +的溶媒.2.1.2自组装时间的影响当用10mg /mL NAD +作为修饰溶液,在金胶(!1)和NAD +(!2)中的自组装时间直接影响制得的传感器对乳酸的响应,当!1和!2均为121,制备的生物传感器对乳酸有较高的电催化活性.2.2NAD +的组装过程及其生物活性表征2.2.1电化学交流阻抗(EIS )在电极修饰过程中,EIS 能给出电极表面阻抗的变化.图2a 是裸金电极的EIS ,正象报道的那样[25],它有非常小的半园直径,表明裸金电极对氧化还原探针有非常小的电子转移阻抗.当用半胱胺修饰后,半胱胺单分子层有较高的阻抗(图2b ),表明半胱胺单分子层阻碍电子的电子传递.当半胱胺修饰电极被浸泡在金胶中,发现金胶-半胱图2金电极的电化学交流阻抗图图3修饰金膜的紫外可见光谱(a )裸金电极;(b )半胱胺修饰金电极;(a )NAD +/金胶-半胱胺膜的反射紫外可见光谱;(c )金胶-半胱胺修饰金电极;(c )NAD +/金胶-半胱胺修饰.(b )含有4.0X 10-5mOI /L NAD +紫外可见光谱.胺修饰的金电极的交流阻抗接近于裸金电极(图2c ).说明了金胶-半胱胺修饰的金电极的传导性与金电极本质上是一致的.也许是固定在半胱胺上的纳米金胶起着类似于导电丝或电子导电隧道的作用,使它更易发生电子转移.图4NAD +/金胶-半胱胺修饰金电极在乳酸中的循环伏安图(a )0.005mg /mL LDH 的pH8.0PBS ;(b )a +3.0X 10-6mOI /L 乳酸;(c )a +6.0X 10-6mOI /L.最后将金胶-半胱胺修饰的金电极浸泡到NAD +溶液,这样可获得NAD +/金胶-半胱胺修饰的金电极.此时电极的界面阻力再度增加(图2c ).电极修饰过程交流阻抗的变化是NAD +已经被组装到电极表面的有力证据.2.2.2紫外可见光谱(UV-Vis )图3为NAD +已经被固定到金胶表面上提供了有力的证据.在PBS 中NAD +的吸收谱带位置为259.5nm (图3b )[30,31],吸收带位置(发生位移或消失)可以提供NAD +是否变异的信息.将NAD +固定在金胶-半胱胺修饰金膜表面,NAD +位于260nm 的吸收带如图3a 所示.说明组装在纳米金胶上的NAD +保持其生物活性.05淮阴师范学院学报(自然科学版)第1卷比较上述EIS 和UV-ViS ,NAD +已经被组装在金胶表面并保持其生物活性.2.3纳米功能界面对乳酸的催化响应研究NAD +固定在金胶-半胱胺修饰金电极,在含有的pH 8.0PBS 中对乳酸的响应,以验证研制的生物传感器的催化活性,研制的修饰电极放在含有0.005mg /mL LDH 的pH 8.0PBS 中,扫描速度1=100mV /S ,检测对乳酸的响应.图4中,阳极峰电流增加和阴极电流完全消失.说明在LDH 存在下固定的NAD +对乳酸呈现电催化特性.阳极峰电位,即在NAD +再生过程中NADH 的氧化电位,是250mV ,而在裸金电极上NADH 的氧化电位为750mV [26].在这样的功能界面上,NADH 的氧化过电位减少约500mV.这些充分说明了NAD +已经被固定在金胶表面,作为乳酸生物传感器,说明仿生功能界面上的NAD +也保持其电化学活性.反应机理可表示如下:制备的传感器对乳酸响应的稳态电流-时间曲线(工作电位:250mV )见图5.乳酸的浓度在1.0X 10-7~8.0X 10-7mOI /L 范围内,其响应是线性的,线性回归方程为I /DA =2.25+13.8C /!mOI /L ,相关系数(r )为0.9978.检测限为6.0X 10-8mOI /L (三倍的信噪比,S /N =3).响应时间约为4S ,6次连续测定浓度为2.0X 10-7mOI /L 乳酸的相对标准偏差(RSD )为3.6%.图5NAD +/金胶-半胱胺修饰金电极对乳酸的电流-时间曲线(a )3.2X 10-5mOI /L AA ;(b )3.0X 10-5mOI /L UA ;(c )1.6X 10-5mOI /L DA ;(c )2.0X 10-5mOI /L 葡萄糖;(e )5.0X 10-5mOI /L CI -和8.0X 10-7mOI /L 乳酸15第2期顾海鹰:NAD +在纳米金胶上的组装、表征及其应用研究当乳酸的浓度高于1.0X 10-5mol /L 时,响应曲线趋于平台,说明具有Michaelis-Menten 动力学机理特性,表观Michaelis-Menten 常数(!m )是酶-底物动力学的表征,可由Lineweaver-Burk 方程的电化学形式得到[27]1"ss =!m "max X 1C +1"max这里,"ss 是加入底物以后测得的稳态电流,#是底物的总体浓度,"max 是加入饱和底物后测得的最大电流.!m 由稳态电流的倒数和乳酸浓度的倒数作图产生的斜率和截距求得,这种乳酸传感器的!m 值为8.8!mol /L.较低的!m 值说明固定的NAD +对乳酸具有较高的生物亲和性,基于这种纳米仿生功能界面的乳酸传感器有较高的灵敏度在此得到证实.2.4纳米功能界面的稳定性和抗干扰能力进一步研究表明这种生物传感器是非常稳定的,在pH 8.0PBS ,4C 至少能保持5d ,电极对乳酸响应至少是初始响应的90%.这种基于纳米功能界面的生物传感器有较强的抗干扰能力.从图5观察到3.2X 10-5mol /L 抗坏血酸(AA ),3.0X 10-5mol /L 尿酸(UA ),1.6X 10-5mol /L 多巴胺(DA ),2.0X 10-5mol /L 葡萄糖(Glucose )和5.0X 10-5mol /L 氯离子(Cl -)不干扰乳酸的测定.2.5结论IES 和UV-Vis 能被成功作为有力的工具用来表征固定在金胶表面上的NAD +.研制的纳米仿生功能界面能保持其生物活性,并对乳酸呈现良好的电催化特性.作为一种新型的生物传感器具有较高的灵敏度和选择性,在临床和生物领域具有良好的应用前景.参考文献:[1]Giersig M ,Mulvaney P.Preparation of ordered colloid monolayers by electrophoretic deposition [J ].Lagmuir ,1993,9:34083413.[2]Hostetler M J ,Green S J ,Stokes J J ,Murray R W.Monolayers in three dimensions :synthesis and electrochemistry of "-func-tionalized alkanethiolate-stabilized gold cluster compounds[J ].J Am Chem Soc ,1996,18:42124213.[3]Doron A ,Katz E ,Willner anization of Au colloids as monolayer films onto ITO glass surfaces :application of the metal col-loid films as base interfaces to construct redox-active monolayers[J ].Langmuir ,1995,11:13131317.[4]Willner I ,Katz E ,Willner B.Electrical contact of redox enzyme layers associated with electrodes :routes to amperometric biosen-sors[J ].Electroanalysis ,1997,9:965977.[5]Hu X Y ,Xiao Y ,Chen H Y.Adsorption characteristics of Fe (CN )63-/4-on Au colloids as monolayer films on cysteamine-modi-fied gold electrode [J ].J Electroanal Chem ,1999,466:2630.[6]Xiao Y ,Ju H X ,Chen H Y.Hydrogen peroxide sensor based on horseradish peroxidase-labeled Au colloids immobilized on goldelectrode surface by cysteamine monolayer[J ].Anal Chim Acta ,1999,391:7382.[7]Xiao Y ,Ju H -X ,Chen H Y.Direct electrochemiistry of horseradish peroxidase immobilized on a colloid /cysteamine-modifiedgold electrode[J ].Anal Biochem ,2000,278:2228.[8]Gu H Y ,Yu A M ,Chen H Y.Direct electron transfer and characterization of hemoglobin immobilized on a Au colloid-cysteaminemodified gold electrode[J ].J Electroanal Chem ,2001,516:119126.[9]Gu H Y ,Yu A M ,Yuan S S ,Chen H Y.Amperometric nitric oxide biosensor based on the immobilization of hemoglobin on ananometer-sized gold colloid modified Au electrode[J ].Anal Lett ,2002,35:647661.[10]Patolsky F ,Gabriel T ,Willner I.Controlled electrocatalysis by microperoxidase-11and Au-nanoparticle superstructures on con-ductive supports [J ].J Electroanal Chem ,1999,479:6973.[11]Bendayan M.in Colloidal Gold :Principles ,Methods ,and Applications (Hayat M A Ed )[M ].San Diego :Academic Press ,1989.[12]Zhao J ,Henkens R W ,Stonehuerner J ,et al.Direct electron transfer at horseradish peroxidase-colloidal gold modified electrodes[J ].J Electroanal Chem ,1992,327:109119.[13]Williams D L ,Doig A R ,Korosi A J.Electrochemical-enzymatic analysis of blood glucose and lactate [J ].Anal Chem ,1970,42:118121.[14]Kulys J J S ,virmickas G J.Reagentless lactate sensor based on cytochrome b 2[J ].Anal Chim Acta ,1980,117:115120.25淮阴师范学院学报(自然科学版)第1卷[15]Mizutani F ,Sasaki K ,Shimura Y.Seguentiai determination of L-iactate and iactate dehydrogenase with immobiiized enzymeeiectrode [J ].Anai Chem ,1983,55:3538.[16]Yao T ,Kobayashi Y ,Musha S.Fiow injection anaiysis for L-iactate with immobiiized iactate dehydrogenase [J ].Anai Chim Ac-ta ,1982,138:8185.[17]Biaedei W J ,Engstrom R C.Reagentiess enzyme eiectrodes for ethanai ,iactate ,and maiate [J ].Anai Chem ,1980,52:16911697.[18]Schiereth D D.Surface-modified goid eiectrodes with biospecific affinity for iactate dehydrogenase based on Cibacron Biue 3FG-A seif-assembied monoiayers[J ].J Eiectroanai Chem ,1997,425:7785.[19]Schiereth D D ,Kooyman R P H.Seif-assembied monoiayers with biospecific affinity for iactate dehydrogenase for the eiectro-enzymatic oxidation of iactate [J ].J Eiectroanai Chem ,1997,431:285295.[20]Schiereth D D ,Kooyman R P H.Seif-assembied monoiayers with biospecific affinity for NAD (H )-dependent dehydrogenases :characterization by surface piasmon resonance combined with eiectrochemistry ‘in situ ’[J ].J Eiectroanai Chem ,1998,444:231240.[21]Bertiisson L ,Butt H ,Neiies G ,et ai.Cibacron Biue F3G-A anchored monoiayers with biospecific affinity for NAD (H )-depen-dent iactate dehydrogenase :characterization by FTIR-spectroscopy and atomic force microscopy[J ].Biosensors Bioeiectronics ,1997,12:839852.[22]Schiereth D D.Preparation of goid surfaces with biospecific affinity for NAD (H )-dependent iactate dehydrogenase [J ].SensorsActuators B ,1997,43:7886.[23]Bardea A ,Katz E ,Bckmann A F ,Wiiiner I.NAD +-dependent enzyme eiectrodes :eiectricai contact of cofactor-dependent enz-ymes and eiectrodes[J ].J Am Chem Soc ,1997,119:91149119.[24]Oesch U ,Janata J.Eiectrochemicai study of goid eiectrodes with anodic oxide fiims-I.Formation and reduction behavior of an-odic oxides on goid[J ].Eiectrochim Acta ,1983,28:12371246.[25]Kharitonov A B ,Aifonta L ,Katz E ,et ai.Probing of bioaffinity interactions at interfaces using impedance spectroscopy andchronopotentiometry[J ].J Eiectroanai Chem ,2000,487:133141.[26]Chen H Y ,Zhou D M ,Xu J J ,et ai.Eiectrocataiytic oxidation of NADH at a goid eiectrode modified by thionine covaientiybound to seif-assembied cysteamine monoiayers[J ].J Eiectroanai Chem ,1997,422:2128.[27]Kamin R A ,Wiison G S.Rotating ring-disk enzyme eiectrode for biocataiysis kinetic studies and characterization of the immobi-iized enzyme iayer[J ].Anai Chem ,1980,52:11981205.Assembly and Characterization of NAD +onNanometer -sized Gold Colloid and Its ApplicationGU Hai-ying(Department of Hygeian Anaiyticai Chemistry ,Nantong Medicai Coiiege ,Nantong 226001,China )Abstract :NAD +was successfuiiy immobiiized on Au coiioid associated with a cysteamine monoiayer on a goid eiectrode surface to construct a nanometer-sized bionic function interface.The preparation process and activity ofthis interface were characterized with eiectrochemicai impedance spectroscopy (EIS ),UV-Vis spectroscopy (UV-Vis )and eiectroanai chemistry.A novei reagentiess enzyme biosensor based on this function interface was fabricated and showed a good eiectrocataiytic activity to iactate with Michaeiis Menten constant !"of 8.8!M and iimiting de-tection of 6.0>10-8moi /L(#/$=3),the mechanism of the regeneration of NAD +and the eiectrochemicai re-sponse to iactate was aiso studied.Key words :nicotinamide adenine dinucieotide(NAD +);iactate ;nanometer-sized bionic function interface ;bio-sensor ;goid coiioid[责任编辑:蒋海龙]35第2期顾海鹰:NAD +在纳米金胶上的组装、表征及其应用研究NAD+在纳米金胶上的组装、表征及其应用研究作者:顾海鹰作者单位:南通医学院,卫生分析化学教研室,江苏,南通,226001刊名:淮阴师范学院学报(自然科学版)英文刊名:JOURNAL OF HUAIYIN TEACHERS COLLEGE (NATURAL SCIENCE EDIITON)年,卷(期):2002,1(2)被引用次数:2次1.Giersig M;Mulvaney P Preparation of ordered colloid monolayers by electrophoretic deposition [外文期刊] 19932.Hostetler M J;Green S J;Stokes J J;Murray R W Monolayers in three dimensions: synthesis and electrochemistry of ω-functionalized alkanethiolate-stabilized gold cluster compounds[外文期刊] 1996(17)3.DORON A;Katz E;Willner I Organization of Au colloids as monolayer films onto ITO glass surfaces: application of the metal colloid films as base interfaces to construct redox-active monolayers[外文期刊] 19954.Willner I;Katz E;Willner B Electrical contact of redox enzyme layers associated with electrodes:routes to amperometric biosensors[外文期刊] 19975.Hu X Y;Xiao Y;Chen H Y Adsorption characteristics of Fe(CN)63-/4- on Au colloids as monolayer films on cysteamine-modified gold electrode 19996.XIAO Y;Ju H X;Chen H Y Hydrogen peroxide sensor based on horseradish peroxidase-labeled Au colloids immobilized on gold electrode surface by cysteamine monolayer[外文期刊] 19997.XIAO Y;Ju H -X;Chen H Y Direct electrochemiistry of horseradish peroxidase immobilized on a colloid/cysteamine-modified gold electrode[外文期刊] 20008.GuHY;Yu A M;Chen H Y Direct electron transfer and characterization of hemoglobin immobilized on a Au colloid-cysteamine modified gold electrode[外文期刊] 20019.GuHY;Yu A M;Yuan S S;Chen H Y Amperometric nitric oxide biosensor based on the immobilization of hemoglobin on a nanometer-sized gold colloid modified Au electrode[外文期刊] 200210.Patolsky F;Gabriel T;Willner I Controlled electrocatalysis by microperoxidase-11 and Au-nanoparticle superstructures on conductive supports 199911.Bendayan M;Hayat M A;ed in Colloidal Gold: Principles, Methods, and Applications 198912.Zhao J;Henkens R W;Stonehuerner J Direct electron transfer at horseradish peroxidase-colloidal gold modified electrodes 199213.Williams D L;Doig A R;Korosi A J Electrochemical-enzymatic analysis of blood glucose and lactate[外文期刊] 197014.Kulys J J S;virmickas G J Reagentless lactate sensor based on cytochrome b2 198015.Mizutani F;Sasaki K;Shimura Y Sequential determination of L-lactate and lactate dehydrogenase with immobilized enzyme electrode[外文期刊] 198316.Yao T;Kobayashi Y;Musha S Flow injection analysis for L-lactate with immobilized lactate dehydrogenase 198217.Blaedel W J;Engstrom R C Reagentless enzyme electrodes for ethanal,lactate,and malate[外文期刊] 198018.SCHLERETH D D Surface-modified gold electrodes with biospecific affinity for lactate dehydrogenase based on Cibacron Blue 3FG-A self-assembled monolayers[外文期刊] 1997(1/2)19.SCHLERETH D D;Kooyman R P H Self-assembled monolayers with biospecific affinity for lactate dehydrogenase for the electroenzymatic oxidation of lactate[外文期刊] 1997(2)20.SCHLERETH D D;Kooyman R P H Self-assembled monolayers with biospecific affinity for NAD(H)-dependent dehydrogenases: characterization by surface plasmon resonance combined with electrochemistry ‘in situ'[外文期刊] 199821.Bertilsson L;Butt H;Nelles G Cibacron Blue F3G-A anchored monolayers with biospecificaffinity for NAD(H)-dependent lactate dehydrogenase: characterization by FTIR-spectroscopy and atomic force microscopy[外文期刊] 1997(12)22.SCHLERETH D D Preparation of gold surfaces with biospecific affinity for NAD(H)-dependent lactate dehydrogenase[外文期刊] 1997(43)23.Bardea A;Katz E;Bckmann A F;Willner I NAD+-dependent enzyme electrodes: electrical contact of cofactor-dependent enzymes and electrodes[外文期刊] 1997(39)24.Oesch U;Janata J Electrochemical study of gold electrodes with anodic oxide films-I.Formation and reduction behavior of anodic oxides on gold[外文期刊] 198325.Kharitonov A B;Alfonta L;Katz E Probing of bioaffinity interactions at interfaces using impedance spectroscopy and chronopotentiometry[外文期刊] 200026.Chen H Y;Zhou D M;XU J J Electrocatalytic oxidation of NADH at a gold electrode modified by thionine covalently bound to self-assembled cysteamine monolayers[外文期刊] 199727.Kamin R A;Wilson G S Rotating ring-disk enzyme electrode for biocatalysis kinetic studies and characterization of the immobilized enzyme layer 19801.顾海鹰.俞爱民.陈洪渊乳酸脱氢酶在纳米金胶上的组装及应用研究[期刊论文]-南通医学院学报2002,22(4)2.秦玉华.郭军.许慧.周力恒.许宏鼎.QIN Yu-hua.GUO Jun.XU Hui.ZHOU Li-heng.XU Hong-ding肌红蛋白-壳聚糖-金胶纳米复合薄膜修饰电极的电化学性质[期刊论文]-吉林大学学报(理学版)2006,44(6)3.刘存兄.倪邦发.田伟之.胡炼.肖才锦.王平生.张桂英.黄东辉.吕鹏.杨伟涛.LIU Cun-xiong.NI Bang-fa. TIAN Wei-zhi.HU Lian.XIAO Cai-jin.WANG Ping-sheng.ZHANG Gui-ying.HUANG Dong-hui.LU Peng.YANGWei-tao固体核径迹对绝缘材料抗反射性能的影响[期刊论文]-原子能科学技术2009,43(2)4.刘锋.黄磊.LIU Feng.HUANG Lei OB纳米结构仿生及光学特性研究进展[期刊论文]-上海师范大学学报(自然科学版)2009,38(5)5.赵凤梅.张向苏.刘守.任雪畅.ZHAO Feng-mei.ZHANG Xiang-su.LIU Shou.REN Xue-chang2维光子晶体抗反膜的制作及其特性分析[期刊论文]-激光技术2009,33(6)6.徐静静基于金胶的紫细菌光合反应中心蛋白的光电化学研究[学位论文]20077.瑞士科学家研制出新型抗反射薄膜[期刊论文]-中国科技产业2001(5)8.刘汉玉.王庆康.LIU Han-yu.WANG Qing-kang亚波长结构的抗反射特性三维TLM方法模拟[期刊论文]-光电子技术2008,28(1)9.TAN En-zhong.FANG Yan纳米金胶的吸收光谱研究[期刊论文]-光散射学报2005,17(1)。
中国科学: 化学 2010年第40卷第5期: 531 ~ 537 SCIENTIA SINICA Chimica 《中国科学》杂志社SCIENCE CHINA PRESS论文金纳米微粒表面能量转移及半胱氨酸的高灵敏度高选择性分析法刘春①, 吴同①, 黄承志①②*①发光与实时分析教育部重点实验室; 西南大学化学化工学院, 重庆 400715②西南大学药学院, 重庆 400715*通讯作者, E-mail: chengzhi@收稿日期: 2009-10-23; 接受日期: 2009-10-27摘要根据荧光染料在金纳米粒子表面的能量转移, 本文建立了一种具有高灵敏和高选择性半胱氨酸分析方法. 研究表明, 通过静电作用吸附在柠檬酸根包被的金纳米粒子表面的阳离子荧光染料如罗丹明B分子在受光激发时, 发生从荧光染料到金属纳米微粒的能量转移, 导致荧光染料的荧光猝灭. 但当体系中存在半胱氨酸时, 由于半胱氨酸与金纳米粒子之间具有更强的共价作用, 罗丹明B分子远离金纳米粒子表面, 降低了能量转移效率, 使得罗丹明B的荧光得到恢复. 恢复的荧光强度与0.025~4.5 µmol/L半胱氨酸呈很好的线性关系, 检测限为8.0 nmol/L(3σ), 而其他十九种基本氨基酸的响应非常微弱. 关键词荧光染料罗丹明B金纳米粒子表面能量转移(SET) 半胱氨酸1引言金纳米粒子(gold nanoparticles, AuNPs)因其特殊的化学物理性质如随颗粒尺寸和颗粒间距离而改变的等离子体共振吸收特性, 比有机染料高几个数量级的消光系数和非线性光学特性而在生物化学、免疫分析等领域成为具有优异灵敏度和高选择性的分子识别探针[1~8]. 近年来, 有研究者报道利用AuNPs建立了纳米材料能量转移(nanomaterials surface energy transfer, NSET)体系[9, 10]. NSET是指有机荧光染料作为能量给体将能量转移给作为能量受体的AuNPs表面[11~13]. 从本质上来看, NSET也是偶极-偶极作用, 但与荧光共振能量转移(fluorescence resonance energy transfer, FRET)有很大不同. NSET的能量受体是纳米粒子表面, 在几何学上各向同性的偶极向量分布, 从而可以接受来自于给体的能量, 因而同一个纳米粒子能猝灭从可见到近红外发射波长的荧光. 这不仅提高了作为给体的有机染料分子与作为受体的纳米粒子之间的能量转移效率, 而且也使得NSET具有比FRET更大的有效作用距离和作用范围, 其能量转移效率与距离的关系从1/R6变成1/R4. 因此, 相同能量转移效率, NSET比FRET传输的距离更长, 因此研究NSET对长距离能量传输具有重要的意义.半胱氨酸是生物体内具有巯基的重要氨基酸, 它对生物体内依靠二硫键来保持结构和功能的蛋白质在分子内的交联起着至关重要的作用. 它也是一个潜在的神经毒素, 是某些疾病的标志化合物. 因此,检测半胱氨酸在生物化学研究及临床诊断上都有重要意义. 目前, 已报道的分析方法有分光光度法[14]、电化学分析法[15]、荧光分析法[16~18]、化学发光分析法[19, 20]等. 我们课题组也曾报道基于半胱氨酸诱导CTAB包被的金纳米粒子聚集导致光散射信号变化[21]以及通过改变银纳米粒子的形态而引起颜色变化[22]来测定半胱氨酸的方法.本文建立了一种基于NSET对半胱氨酸选择性刘春等: 金纳米微粒表面能量转移及半胱氨酸的高灵敏高选择性分析法532响应的“Turn-on”荧光检测方法. 由于NSET 作用, 金纳米粒子可以猝灭吸附于其表面的荧光染料的荧光. 但加入一种与金纳米粒子或与染料作用更强的物质, 竞争反应会使得染料远离金纳米粒子表面, 进而使染料荧光恢复. 此类分析方法现已用于铜离子[23]、汞离子[11, 24, 25]和半胱氨酸[26]的测定. 本文阐述了纳米粒子表面能量转移, 并成功用于半胱氨酸的检测, 而且实验中采用商业上廉价易得的高量子产率的荧光染料, 省去了合成目标染料的复杂步骤及分离过程,因而使本方法成为一个简单、灵敏、快速的半胱氨酸检测方法.实验思路如图示1所示, 罗丹明B 分子通过静电作用吸附在柠檬酸根包被的AuNPs 表面. 当有光激发时, 二者之间发生荧光表面能量转移, 导致罗丹明B 的荧光猝灭. 半胱氨酸加入后, 因为半胱氨酸的巯基与AuNPs 之间更强的共价作用, 使得罗丹明B 分子远离AuNPs 表面, 能量转移效率降低, 从而罗丹明B 的荧光恢复. 以此原理建立起测定半胱氨酸的高灵敏度和高选择性的分析方法.2 实验部分2.1 仪器与试剂F-2500 型荧光分光光度计(日本日立公司), UV- 3600 型紫外-可见-近红外分光光度计(日本岛津公司), MWS-1型漩涡混合器(江苏其林贝尔仪器制造有限公司), PHS-3C 型酸度计(成都方舟科技开发公司). HAuCl 4·4H 2O(上海国药集团化学试剂有限公司),柠檬酸三钠(上海化学试剂公司), 20种基本氨基酸(天津光复精细化工试剂公司). 半胱氨酸配制成 1.0×10−3 mol/L 储备液, 于4 ℃冰箱中保存并且每天更新, 工作液通过1.0 mmol/L 储备液逐级稀释得到. 实验中使用Britton-Robinson 缓冲溶液控制溶液酸度. 实验用水均为超纯水, 试剂均为分析纯.图示1 NSET 法测半胱氨酸的示意图 2.2 金纳米微粒(AuNPs)的合成采用Frens 法合成粒径为13 nm 的AuNPs [27]. 在用王水(盐酸:硝酸=3:1)洗净的100 mL 平底烧瓶中, 依次加入47 mL 超纯水, 2 mL 1% HAuCl 4水溶液, 加热搅拌至沸. 剧烈搅拌下迅速加入1 mL 5%柠檬酸三钠水溶液. 保持溶液沸腾和剧烈搅拌, 大约5分钟后溶液变得鲜红. 停止加热, 再继续剧烈搅拌直至溶液冷却至室温. 用UV-3600 型紫外-可见-近红外分光光度计测定出该溶液最大吸收波长在518.5 nm 左右. 其浓度依照消光光谱和朗伯-比尔定律计算(摩尔消光系数ε(13)520 nm = 2.7×108 cm −1 M −1)[28]为10 nmol/L.2.3 罗丹明B -金纳米粒子(RB-AuNPs )复合物的 制备在用王水洗净、超纯水润洗并烘干的棕色瓶中, 依次加入12 mL 10 nmol/L AuNPs 溶液、2 mL 50.0 mol/L pH 9.0硼砂-盐酸缓冲溶液、6 mL 超纯水. 磁力搅拌下加入20 µL 2 mmol/L 罗丹明B 溶液, 室温下避光搅拌反应2 h. 反应结束后常温下静置保存待用. 如上制得的复合物浓度定义为1×.2.4 实验方法与步骤在 1.5 mL 离心管中, 依次加入400 µL 1×RB-AuNPs 溶液, 100 µL pH 7.24 的B-R 缓冲溶液和一定浓度的半胱氨酸溶液, 用水稀释至 1 mL, 涡旋混合器混合均匀. 所得溶液在室温静置反应30 min 后, 在530 nm 波长激发下扫描545~700 nm 范围的荧光光谱. 3 结果与讨论3.1 从罗丹明B 到AuNPs 表面的NSET在水溶液中, 罗丹明B 是强荧光分子(图1, 曲线(a)), 其荧光量子产率高达0.70, 最大发射峰在575 nm. 当它通过静电作用吸附到带负电荷的金纳米粒子表面时, 由于二者之间发生了能量转移, 罗丹明B 的荧光几乎被完全猝灭(图1, 曲线(c)). 而半胱氨酸的加入使得罗丹明B 的荧光得到部分恢复(图1, 曲线(b)). 证明半胱氨酸可以阻碍罗丹明B 与AuNPs 之间的表面能量转移.NSET 的猝灭常数K sv 可由公式(1)计算[12]:中国科学: 化学 2010年 第40卷 第5期533⎛⎞⎡⎤⎡⎤⎜⎟⎣⎦⎣⎦⎝⎠k ΦF c K c ΦF k k q 00Q sv Q c d==1+=1++ (1) 其中Φ0和F 0分别表示没有猝灭基团时的量子产量和发射强度. Φ和F 是有猝灭基团存在下的参数. k q , k c 和k d 分别指猝灭、发射以及钝化的比率. K sv 是Stern-Volmer 猝灭常数, 而c Q 是猝灭基团的浓度.实验表明, 当罗丹明B 与金纳米粒子的浓度分别为1.0 µmol/L 和3.0 nmol/L 时, 荧光猝灭效率可达为98%. 而根据图2和公式(1), 可计算得出罗丹明B图1 罗丹明B 和RB-AuNPs 在有无半胱氨酸存在下的荧光发射光谱. 实验条件: 0.8 µmol/L 罗丹明 B 溶液; 100 µL pH 7.24 Britton-Robinson 溶液; 0.4× RB-AuNPs 溶液(分别含0.8 µmol/L RB 和2.4 nmol/L AuNPs); 4.0 µmol/L cysteine 溶液. (a) 罗丹明 B; (b) RB-AuNPs + cysteine; (c)RB-AuNPs图2 AuNPs 浓度对RB-AuNPs 复合物荧光强度的影响. 实验条件: 1.0 µmol/L 罗丹明 B 溶液; 5.0 mmol/L pH 9.0 硼砂-盐酸溶液. AuNPs 浓度分别为 (a) 0; (b) 1.5; (c) 2.0; (d) 2.5; (e) 3.0; (f) 3.5 nmol/L. 嵌入图, 随金纳米粒子浓度而变化的猝灭效率; λ, 575 nm和金纳米粒子之间的K sv 约为 1.5×1010 mol −1 L. 如此高的猝灭常数, 使得纳摩尔级的金纳米粒子与荧光染料之间仍可以观察到灵敏的猝灭现象. 这主要是因为: 1)较大的比表面积能够容纳更多的染料分子; (2)金纳米粒子对有机染料达纳摩尔级的键合亲和力[11].如前所述, NSET 和FRET 在本质上都是偶极-偶极相互作用, 仅仅是由于NSET 中的受体是纳米粒子表面, 使得NSET 比FRET 具有更广阔的适用性. 发生FRET 的给体和受体对, 必须满足给体的发射峰与受体的吸收峰高度重叠. 它们重叠程度越大, 给受体之间的能量转移也就越容易发生. NSET 虽然也有这个规律, 但它却并不受此条件限制. 就本实验中的能量给体RB, 其最大发射峰位移在575 nm, 而作为受体的13 nm AuNPs, 其表面等离子共振吸收峰却在520 nm 附近. 按照FRET 的理论, 这样的给受体对之间的能量转移是非常弱的. 然而就实验数据来看, 仅需3.0 nmol/L AuNPs 就可以使1.0 µmol/L 罗丹明B 荧光猝灭效率达98%. 另一个显著的优点在于给受体之间的有效作用距离明显增大. 对于FRET 来说, 给体和受体之间的距离小于10 nm, 才能有效地发生能量转移. 所以, 在常规的FRET 体系中, 给体和受体通常是用DNA 链连接或杂交[29]以保证其在有效作用距离之内. 而NSET 的有效作用距离比FRET 大了一倍, 达20 nm, 这降低了NSET 对给受体之间距离的依赖, 同时拓宽了纳米粒子的应用范围.3.2 半胱氨酸与金纳米粒子的作用在pH 5.0 条件下, 不仅有半胱氨酸的巯基与AuNPs 发生共价作用, 同时其分子内的−NH 3+与AuNPs 也发生静电作用[30]. 此时金纳米粒子自组装成网状结构, 其表面等离子共振吸收峰红移, 表现出从红到蓝或紫的颜色变化. 但我们在整个实验过程中没有观察到金纳米粒子的聚集. 这一方面是因为介质的pH 值高于半胱氨酸的等电点, 使得半胱氨酸分子中几乎没有−NH 3+存在而与AuNPs 发生静电作用; 另一方面也可能是在金纳米粒子表面还吸附有部分罗丹明B 分子, 它保护AuNPs 防止半胱氨酸诱导的交联聚集的发生.3.3 实验条件的优化图2表明13 nm AuNPs 对罗丹明B 的猝灭受AuNPs 量的影响, 溶液的荧光强度随着金纳米粒子刘春等: 金纳米微粒表面能量转移及半胱氨酸的高灵敏高选择性分析法534浓度增大而线性地减弱. 进一步研究表明罗丹明B 与AuNPs 的比例对实验灵敏度影响非常大. 相对AuNPs 来说, 如果RB 量过多, 溶液中游离的RB 会导致背景荧光增大; 如果RB 不足量, 则会引起检测半胱氨酸的灵敏度降低. 我们通过实验发现(图2), 当罗丹明B 与金纳米粒子的浓度分别为1.0 µmol/L 和3.0 nmol/L 时, RB 的荧光刚好被猝灭完全. 当二者以最优比例制成RB-AuNPs 复合物时, 其用量多少对体系的信号响应也产生重要影响.如图3所示, 过少或过多的RB-AuNPs 复合物均会减弱信号响应. 在没有半胱氨酸存在时, RB- AuNPs 复合物的荧光值很弱, 而且基本不随该复合物的浓度改变. 加入半胱氨酸后, 溶液的荧光强度增强数倍, 并随着复合物浓度的增大不断增强. 在0.3×和0.4×之间达到平台, 然后随着复合物浓度继续增大, 荧光信号响应下降.我们也考察了体系荧光信号对酸碱度的响应. 实验发现, 在pH 5.0~9.0的范围间, 酸碱度对体系没有很明显的影响(图4). 这可能是罗丹明B 的荧光发射比较稳定, 在此酸碱度范围内荧光信号基本保持恒定. 此外, 半胱氨酸与金纳米粒子间的共价作用, 受酸碱度影响也比较小.实验还发现, 半胱氨酸与RB-AuNPs 复合物反应迅速, 体系的荧光强度在加入半胱氨酸5 min 之内增加数倍, 到反应20 min 后基本达到平台(图5). 本实验选择反应时间为30 min 分钟再进行测定, 此反应时间可以使反应进行完全并保持信号稳定.图 3 RB-AuNPs 浓度对体系荧光强度的影响. 实验条件: 100 µL pH 7.24 Britton-Robinson 溶液; 4.0 µmol/L cysteine 溶液; 反应时间, 30 min; λ, 575 nm图 4 pH 值的影响. 实验条件: 100 µL pH 7.24 Britton- Robinson 溶液; 4.0 µmol/L cysteine 溶液; 0.4×RB-AuNPs 溶液; 反应时间, 30 min; λ, 575 nm图5 反应时间的影响. 实验条件: 100 µL pH 7.24 Britton- Robinson 溶液; 4.0 µmol/L cysteine 溶液; 0.4× RB-AuNPs 溶液; λ, 575 nm3.4 其他氨基酸的响应为检验本实验的选择性, 我们考察了组成蛋白质的二十种L-型氨基酸对体系的响应(图6). 从实验结果看, 半胱氨酸对体系的响应远远大于其余的十九种氨基酸. 这也进一步说明半胱氨酸分子中的巯基, 是引起体系荧光增强的关键原因. 其中碱性氨基酸组氨酸和精氨酸, 由于在实验pH 条件下, 此二者氨基酸带正电荷, 与金纳米粒子静电作用而产生轻微荧光信号. 蛋氨酸对体系荧光信号的影响主要是因为它分子内含有的S −CH 3基团与金纳米粒子发生作用.我们进一步考察了L-高半胱氨酸和还原型谷胱甘肽对体系的响应. 实验发现, 由于这两种物质也含有巯基基团, 它们与金纳米粒子有类似的反应, 故对中国科学: 化学 2010年 第40卷 第5期535图 6 二十种氨基酸对体系的响应. 实验条件: 100 µL pH 7.24 Britton-Robinson 溶液; 0.4×RB-AuNPs 溶液; 4.0 µmol/L 各种氨基酸溶液; 反应时间, 30 min; λ, 575 nm本实验也有很强的响应(如图7), 其中L-高半胱氨酸与半胱氨酸的响应几乎一样, 还原型谷胱甘肽能达到半胱氨酸的50%.3.5 线性范围、精密度及样品测定在最优实验条件下, 我们研究了RB-AuNPs 在半胱氨酸存在下的荧光恢复, 所有的荧光信号强度均取自575 nm 处(图8). 实验发现, 半胱氨酸浓度在0.025~4.5 µmol/L 范围时, 荧光强度差值与其浓度呈线性关系, 线性回归方程及相关系数分别是∆Ι = 20.7 + 217.0c (其中, ∆I 为体系的荧光强度增加值, c 为半胱氨酸浓度, µmol/L) 和R = 0.9978, 检测图7 L-高半胱氨酸和还原型谷胱甘肽对体系的响应. 实验条件: 100 µL pH 7.24 Britton-Robinson 溶液; 0.4× RB-AuNPs 溶液; 4.0 µmol/L Cys, HCys 和GSH 溶液; 反应时间, 30 min; λ, 575 nm图8 Cys 的线性响应曲线及荧光光谱图. 实验条件: 100 µL pH 7.24 Britton-Robinson 溶液; 0.4× RB-AuNPs 溶液; 反应时间, 30 min. 嵌入图, 575 nm 处的荧光增加值与半胱氨酸浓度的线性响应曲线表1 合成样品中半胱氨酸的测定样品加入浓度(µmol/L)合成样回收浓度(µmol/L) 回收率 (%) 相对偏差(%, n =3)10.75 a 0.69, 0.71, 0.74 92.0~98.7 3.5 2 1.50 b 1.46, 1.47, 1.56 97.3~104.0 3.7 32.50 c 2.48, 2.47, 2.49 98.8~99.70.4c RB-AuNPs , 0.4×; B-R 缓冲溶液 pH 7.24, 各氨基酸浓度与所加入的半胱氨酸浓度一样. 合成样a: His, Trp, Arg, Phe, Ser, Val, Lys; 合成样b: Glu, Gln, Gly, Pro, Asn, Asp; 合成样c: Ala, Thr, Leu, Ile, Tyr, Met.限(3σ)为8.0 nmol/L. 为验证本方法的可行性,我们对合成样品进行半胱氨酸标准加入回收实验(表1), 得到回收率在92.0%~104.0%之间, 相对标准偏差小于3.7% (n =3). 从实验结果来看, 该方法具有良好的准确度和精密度.4 结论本文描述了一个基于金纳米微粒的表面能量转移测定半胱氨酸的简单方法. 由于NSET 的作用, RB-AuNPs 复合物在575 nm 处的荧光非常微弱, 半胱氨酸加入后, 减弱NSET 的转移效率, 使得罗丹明B 的荧光得以恢复, 以此建立起检测限(3σ)达8.0 nmol/L 的半胱氨酸分析方法. 我们相信, NSET 在生物分析中有更加广阔的用途, 在细胞成像分析及毛细管电泳分析中展示了很好的应用前景.刘春等: 金纳米微粒表面能量转移及半胱氨酸的高灵敏高选择性分析法致谢本工作得到国家自然科学基金 (90813019)资助, 特此致谢.参考文献1 Murphy CJ, Gole AM, Stone JW, Sisco PN, Alkilany AM, Goldsmith EC, Baxter SC. Gold nanoparticles in biology: beyond toxicity tocellular imaging. Acc Chem Res, 2008, 41(12): 1721—17302 Daniel MC, Astruc D. Gold nanoparticles: assembly, supramolecular chemistry, quantum-size-Related properties, and applications towardbiology, catalysis, and nanotechnology. Chem Rev, 2004, 104(1): 293—3463 何佑秋, 刘绍璞, 刘芹, 刘忠芳, 胡小莉. 金纳米微粒与藏红T相互作用的吸收、荧光和共振Rayleigh散射光谱特征. 中国科学 B辑:化学, 2005, 35(2): 159—1684 Zhao W, Brook MA, Li Y. Design of gold nanoparticle-based colorimetric biosensing assays. ChemBioChem, 2008, 9(15): 2363—23715 Jiang ZL, Feng ZW, Li TS, Li F, Zhong FX, Xie JY, Yi XH. Resonance scattering spectroscopy of gold nanoparticle. Sci China Ser B-Chem,2001, 44(2): 175—1816 Wang Z, Ma L. Gold nanoparticle probes. Coord Chem Rev, 2009, 253(11-12): 1607—16187 Liu J, Lu Y. Colorimetric biosensors based on dnazyme-assembled gold nanoparticles. J Fluoresc, 2004, 14(4): 343—3548 Zhang JJ, Zhu JJ. A novel amperometric biosensor based on gold nanoparticles-mesoporous silica composite for biosensing glucose. SciChina Ser B-Chem, 2009, 52(6): 815—8209 Yun CS, Javier A, Jennings T, Fisher M, Hira S, Peterson S, Hopkins B, Reich NO, Strouse GF. Nanometal surface energy transfer inoptical rulers, breaking the FRET barrier. J Am Chem Soc, 2005, 127(9): 3115—311910 Jennings TL, Singh MP, Strouse GF. Fluorescent lifetime quenching near d=1.5 nm gold nanoparticles: probing NSET validity. J Am ChemSoc, 2006, 128(16): 5462—546711 Darbha GK, Ray A, Ray PC. Gold nanoparticle-based miniaturized nanomaterial surface energy transfer probe for rapid and ultrasensitivedetection of mercury in soil, water, and fish. ACS Nano, 2007, 1(3): 208—21412 Griffin J, Singh AK, Senapati D, Rhodes P, Mitchell K, Robinson B, Yu E, Ray PC. Size- and distance-dependent nanoparticlesurface-energy transfer (NSET) method for selective sensing of hepatitis C virus RNA. Chem Eur J, 2009, 15(2): 342—35113 Ray PC, Fortner A, Darbha GK. Gold nanoparticle based FRET asssay for the detection of DNA cleavage. J Phys Chem B, 2006, 110(42):20745—2074814 Li L, Li B. Sensitive and selective detection of cysteine using gold nanoparticles as colorimetric probes. Analyst, 2009, 134(7): 1361—136515 Chen Z, Zu Y. Electrochemical recognition of single-methylene difference between cysteine and homocysteine. J Electroanal Chem, 2008,624(1-2): 9—1316 Zhang M, Yu M, Li F, Zhu M, Li M, Gao Y, Li L, Liu Z, Zhang J, Zhang D, Yi T, Huang C. A highly selective fluorescence turn-on sensorfor cysteine/homocysteine and its application in bioimaging. J Am Chem Soc, 2007, 129(34): 10322—1032317 Lee KS, Kim TK, Lee JH, Kim HJ, Hong JI. Fluorescence turn-on probe for homocysteine and cysteine in water. Chem Commun, 2008(46):6173—617518 Lin W, Long L, Yuan L, Cao Z, Chen B, Tan W. A ratiometric fluorescent probe for cysteine and homocysteine displaying a large emissionshift. Org Lett, 2008, 10(24): 5577—558019 Zhang SH, Shi BA, Xi J. Investigation on simultaneous determination of tryptophan and cysteine by chemiluminescence method. Chin JAnal Lab, 2007(7): 10—1320 Hua L, Han H, Zhang X. Size-dependent electrochemiluminescence behavior of water-soluble CdTe quantum dots and selective sensing ofL-cysteine. Talanta, 2009, 77(5): 1654—165921 Wang J, Li YF, Huang CZ, Wu T. Rapid and selective detection of cysteine based on its induced aggregates of cetyltrimethylammoniumbromide capped gold nanoparticles. Anal Chim Acta, 2008, 626(1): 37—4322 Wu T, Li YF, Huang CZ. Selectively colorimetric detection of cysteine with triangular silver nanoprisms. Chin Chem Lett, 2009, 20(5):611—61423 He X, Liu H, Li Y, Wang S, Li Y, Wang N, Xiao J, Xu X, Zhu D. Gold nanoparticle-based fluorometric and colorimetric sensing ofcopper(II) ions. Adv Mater, 2005, 17(23): 2811—281524 Huang C-C, Chang H-T. Selective gold-nanoparticle-based“turn-on”fluorescent sensors for detection of mercury(II) in aqueous solution.Anal Chem, 2006, 78(24): 8332—8338536中国科学: 化学 2010年第40卷第5期25 Chen J, Zheng A, Chen A, Gao Y, He C, Kai X, Wu G, Chen Y. A functionalized gold nanoparticles and rhodamine 6G based fluorescentsensor for high sensitive and selective detection of mercury(II) in environmental water samples. Anal Chim Acta, 2007, 599: 134—14226 Shang L, Qin C, Wang T, Wang M, Wang L, Dong S. Fluorescent conjugated polymer-stabilized gold nanoparticles for sensitive andselective detection of cysteine. J Phys Chem C, 2007, 111(36): 13414—1341727 Frens G. Controlled nucleation for the regulation of the particle size in monodisperse gold suspensions. Nat Phys Sci, 1973, 241: 20—2228 Georganopoulou DG, Chang L, Nam JM, Thaxton CS, Mufson EJ, Klein WL, Mirkin CA. Nanoparticle-based detection in cerebral spinalfluid of a soluble pathogenic biomarker for alzheimer’s disease. Proc Natl Acad Sci USA, 2005, 102(7): 2273—227629 Wang W, Chen C, Qian M, Zhao XS. Aptamer biosensor for protein detection using gold nanoparticles. Anal Biochem, 2008, 373(2): 213—21930 Li ZP, Duan XR, Liu CH, Du BA. Selective determination of cysteine by resonance light scattering technique based on self-assembly ofgold nanoparticles. Anal Biochem, 2006, 351(1): 18—25Gold nanoparticles surface energy transfer and its application to highly selective and sensitive detection of cysteineLIU Chun1, WU Tong1 & HUANG ChengZhi1,21 Key Laboratory on Luminescence and Real-Time Analysis, Ministry of Education; College of Chemistry and Chemical Engineering, Southwest University, Chongqing 400715, China2 College of Pharmaceutical Sciences, Southwest University, Chongqing 400715, ChinaAbstract: In this contribution, we report a highly selective and sensitive method for detecting cysteine based on surface energy transfer from fluorophore to gold nanoparticles. Cation dyes, such as Rhodamine B, can be adsorbed onto the surface of citrated-gold nanoparticles through the electrostatic interaction, and the fluorescence of the Rhodamine B absorbed on the surface of the as-prepared gold nanoparticles gets quenched because of the occurrence of surface energy transfer from the fluorophore of Rhodamine B to the gold nanoparticles. With the addition of cysteine, the strong covalent combination between the mercapto group of cysteine and gold nanoparticles drives Rhodamine B molecules apart from the gold nanoparticles’ surface, which reduces the energy transfer efficiency and results in a significant increase of fluorescence of the solution. It was found that the fluorescence gets increased linearly with the concentration of cysteine ranging from 0.025 µmol/L to 4.5 µmol/L. This phenomenon allows sensitive detection of cysteine with a detection limit of 8.0 nmol/L (3σ). Other 19 kinds of natural amino acids have a weak influence on the surface energy transfer.Keywords: fluorescent dye, Rhodamine B, gold nanoparticles, surface energy transfer (SET), cysteine537。