原子核外电子的排布
- 格式:doc
- 大小:161.50 KB
- 文档页数:8


核外电子的分层排布规律:1、第一层不超过2个,第二层不超过8个;2、最外层不超过8个。
每层最多容纳电子数为2n2个(n代表电子层数),即第一层不超过2个,第二层不超过8个,第三层不超过18个;3、最外层电子数不超过8个(只有1个电子层时,最多可容纳2个电子)。
4、最低能量原理:电子尽可能地先占有能量低的轨道,然后进入能量高的轨道,使整个原子的能量处于最低状态。
5、泡利原理:每个原子轨道里最多只能容纳2个电子,且自旋状态相反。
6、洪特规则:当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据一个轨道,且自旋状态相同。
扩展资料一、核外电子排布与元素性质的关系1、金属元素原子的最外层电子数一般小于4,较易失去电子,形成阳离子,表现出还原性,在化合物中显正化合价。
2、非金属元素原子的最外层电子数一般大于或等于4,较易获得电子,活泼非金属原子易形成阴离子。
在化合物中主要显负化合价。
3、稀有气体元素的原子最外层为8电子(氦为2电子)稳定结构,不易失去或得到电子,通常表现为0价。
4、核外电子排布的几条规律之间既相互独立又相互统一,不能孤立地应用其中一条,如当M层不是最外层时,最多排布的电子数为2×32=18个,而当M 层是最外层时,则最多只能排布8个电子。
5、书写原子结构示意图时要注意审题和书写规范:看清是原子还是离子结构示意图,勿忘记原子核内的“+”号。
二、1~18号元素原子结构的特征1、原子核中无中子的原子:H。
2、最外层有1个电子的元素:H、Li、Na。
3、最外层有2个电子的元素:Be、Mg、He。
4、最外层电子数等于次外层电子数的元素:Be、Ar。
5、最外层电子数是次外层电子数2倍的元素:C;是次外层3倍的元素:O;是次外层4倍的元素:Ne。
6、电子层数与最外层电子数相等的元素:H、Be、Al。
7、电子总数为最外层电子数2倍的元素:Be。
8、次外层电子数是最外层电子数2倍的元素:Li、Si。




核外电子的排布规律原子核外电子排布应遵循能量最低原理、Hund(洪特)规则和Pauli(泡利)不相容原理。
1.能量最低原理能量最低原理是指通过对基态原子的核外电子进行排布,使整个原子的能量处于最低状态,而非是使电子尽可能地排布在能量最低的原子轨道。
注意:电子尽可能地排布在能量最低的原子轨道≠整个原子的能量处于最低状态,因为整个原子的能量不能机械地认为是各电子所占轨道的能量之和。
基态原子:能量处于最低状态的原子。
能级顺序为从上至下箭头依次穿过的先后顺序,如:1s→2s→2p→3s→3p→4s→3d→4p→5s→……。
电子按原子轨道的能级顺序进行排布,以保证整个原子的能量处于最低状态。
例:Br(35)的核外电子排布为1s22s22p63s23p64s23d104p5,书写时按主量子数的大小顺序进行排列1s22s22p63s23p63d104s24p5。
2. Pauli(泡利)不相容原理Pauli不相容原理是指每个轨道(原子轨道中的轨道)最多只能容纳2个电子,且自旋方向相反(↑↓)。
s电子亚层只有一个s轨道,只能容纳2个电子;p电子亚层含有三个简并轨道,能容纳6个电子;d电子亚层含有五个简并轨道,能容纳10个电子;f电子亚层含有七个简并轨道,能容纳14个电子。
3. Hund(洪特)规则Hund规则是指在能量相等的简并轨道上,电子优先以自旋方向相同的方式分别占据不同的简并轨道,使原子的总能量最低。
简并轨道:能量相等的轨道,如:px,py,pz就是三个能量相等的简并轨道。
例:N原子核外有7个电子,根据能量最低原理和Pauli不相容原理,1s轨道排2个电子,2s轨道排2个电子,根据Hund规则,剩余的3个电子将以自旋方向相同的方式排在三个简并的2px,2py,2pz轨道。
简并轨道处于全满、半满和全空状态时比较稳定全满:p6,d10,f14半满:p3,d5,f7全空:p0,d0,f0例:Cu(29)的核外电子排布:1s2 2s2 2p6 3s2 3p6 3d10 4s1。



核外电子排布规律总结1.电子能级规则:电子能级是指原子中不同能量的轨道或壳层。
根据电子能级规则,电子会首先填充能量低的轨道,然后才能填充能量较高的轨道。
这个规则被称为"Aufbau"原则。
具体来说,首先填充1s轨道,然后填充2s轨道,接着填充2p轨道,依次类推。
这个规则可以用来解释元素周期表的结构。
2.布尔排斥原理:根据布尔排斥原理,每个轨道最多只能容纳两个电子,且这两个电子的自旋方向必须相反。
这个规则既适用于同一能量级的轨道,也适用于不同能量级的轨道。
3.海森堡不确定原理:根据海森堡不确定原理,无法同时确定电子的位置和动量。
这个原理说明电子不能完全按照轨道的形式存在,而是以概率密度云的形式存在。
这意味着我们只能通过电子在不同能级之间跃迁的概率来描述电子的行为。
4.电子云模型:根据电子云模型,电子在原子周围形成类似于云的形态。
这个模型的核心概念是轨道,表示了电子可能存在的区域。
不同轨道形状不同,包括球形的s轨道和沿着不同方向延伸的p、d和f轨道。
电子云模型可以用来解释和预测电子在原子内的行为。
5.黄金法则:根据黄金法则,电子倾向于填充能量最低的轨道。
这意味着电子倾向于首先填充s轨道,然后是p、d和f轨道。
这个规则解释了为什么元素周期表上的元素倾向于按照一定的模式填充电子。
6.朗道规则:根据朗道规则,电子在填充轨道时倾向于遵循一定的顺序。
具体来说,朗道规则说明电子首先填充满相同自旋方向的轨道,然后再填充相反自旋方向的轨道。
这个规则解释了为什么大多数原子中的电子向上自旋和向下自旋的数量差异相对较小。
综上所述,核外电子排布规律可以归纳为电子能级规则、布尔排斥原理、海森堡不确定原理、电子云模型、黄金法则和朗道规则等。
这些规律帮助我们理解原子的电子结构,解释元素周期表的结构,以及预测和解释原子的化学性质和反应活性。
这些规律的发现和总结对化学和其他科学领域的发展有着重要的意义。
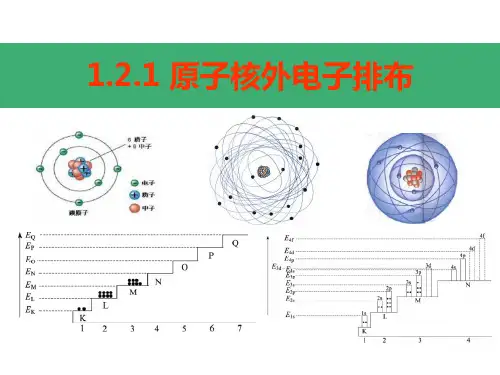
原子核外电子排布规律①能量最低原理:电子层划分为K<L<M<O<P<Q,对应电子层能量增大;原子核外电子排布按照能量较低者低优先排布原则.②每个电子层最多只能容纳2n2个电子;③最外层最多只能容纳8个电子K层为最外层时不能超过2个次外层最多只能容纳18个电子K层为次外层时不能超过2个倒数第三层最多只能容纳32个电子注意:多条规律必须同时兼顾;简单例子的结构特点:1离子的电子排布:主族元素阳离子跟上一周期稀有气体的电子层排布相同,如钠离子、镁离子、铝离子和氖的核外电子排布是相同的; 阴离子更同一周期稀有气体的电子排布相同:负氧离子,氟离子和氖的核外电子排布是相同的;2等电子粒子注意主要元素在周期表中的相对位置①10电子粒子:CH4、N3、NH2、NH3、NH4、O2、OH、H2O、H3O、F、HF、Ne、Na、Mg2、Al3等;②18电子粒子:SiH4、P3、PH3、S2、HS、H2S、Cl、HCl、Ar、K、Ca2、PH4等;特殊情况:F2、H2O2、C2H6、CH3OH③核外电子总数及质子总数均相同的阳离子有:Na、NH4、H3O等;阴离子有:F、OH、NH2;HS、Cl等;前18号元素原子结构的特殊性:1原子核中无中子的原子:11H2最外层有1个电子的元素:H、Li、Na;最外层有2个电子的元素:Be、Mg、He3最外层电子总数等于次外层电子数的元素:Be、Ar4最外层电子数等于次外层电子数2倍的元素:C;是次外层电子数3倍的元素:O;是次外层电子数4倍的元素:Ne5最外层电子数是内层电子数一半的元素:Li、P6电子层数与最外层电子数相等的元素:H、Be、Al7电子总数为最外层电子数2倍的元素:Be8次外层电子数是最外层电子数2倍的元素:Li、Si元素周期表的规律:1最外层电子数大于或等于3而又小于8的元素一定是主族元素,最外层电子数为1或2的元素可能是主族、副族或0族元素,最外层电子数为8的元素是稀有气体He例外2在元素周期表中,同周期的ⅡA、ⅢA族元素的原子序数差别有:①第2、3周期短周期元素原子序数都相差1;②第4、5周期相差11;③第6、7周期相差253同主族、邻周期元素的原子序数差①位于过渡元素左侧的主族元素,即ⅠA、ⅡA族,同主族、邻周期元素原子序数之差为下一周期元素所在周期所含元素总数;相差的数分别为2,8,8,18,18,32②位于过渡元素左侧的主族元素,即ⅢA~ⅦA族,同主族、邻周期元素原子序数之差为下一周期元素所在周期所含元素种数;例如,氯和溴的原子序数之差为35-17=18溴所在第四周期所含元素的种数;相差的数分别为8,18,18,32,32.③同主族非县令的原子序数差为上述连续数的加和,如H和Cs的原子序数为2+8+8+18+18=544元素周期表中除Ⅷ族元素之外,原子序数为奇数偶数的元素,所属所在族的序数及主要化合价也为奇数偶数;如:氯元素的原子序数为17,而其化合价有-1、+1、+3、+5、+7,最外层有7个电子,氯元素位于ⅦA族;硫元素的原子序数为16,而其化合价有-2、+4、+6价,最外层有6个电子,硫元素位于ⅥA族;5元素周期表中金属盒非金属元素之间有一分界线,分界线右上方的元素为非金属元素,分界线左下方的元素为非金属元素H除外,分界线两边的元素一般既有金属性也有非金属性;每周期的最右边金属的族序数与周期序数相等,如:Al为第三周期ⅢA族;元素周期律:1原子半径的变化规律:同周期主族元素自左向右,原子半径逐渐增大;同主族元素自上而下,原子半径逐渐增大;2元素化合价的变化规律:同周期自左向右,最高正价:+1~+7,最高正价=主族序数O、F除外,负价由-4~-1,非金属负价=-8-族序数3元素的金属性:同周期自左向右逐渐减弱;同主族自上而下逐渐增强;4元素的非金属性:同周期制作仙游逐渐增强;同主族自上而下逐渐减弱;5最高价化合物对应水化物的酸、碱性:同周期自左向右酸性逐渐增强,碱性逐渐减弱;同主族自上而下酸性逐渐减弱,碱性逐渐增强; 6非金属气态氢化物的形成难以、稳定性:同周期自左向右形成由难到易,稳定性逐渐增强;同主族自上而下形成由易到难,稳定性逐渐减弱;原子核外电子按照轨道式排布时遵守下列次序:1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<4f<5d<6p<7s<5f<6d<7p规律总结:s有1个轨道,最多容纳2个电子p有3个轨道,最多容纳6个电子d有5个轨道,最多容纳10个电子f有7个轨道,最多容纳14个电子每一个轨道可以容纳两个自选方向相反的电子s<p<dN+1s<NdN+1p<N+2s<Nf<N+1d原子核外电子排布规律1、泡利不相容原理:每个轨道最多只能容纳两个电子,且自旋相反配对2、能量最低原理:电子尽可能占据能量最低的轨道3、洪特规则:简并轨道能级相同的轨道只有被电子逐一自旋平行地占据后,才能容纳第二个电子另外:等价轨道在全充满、半充满或全空的状态是比较稳定的,亦即下列电子结构是比较稳定的:全充满---p6或d10或f14半充满----p3或d5或f7全空-----p0或d0或f0还有少数元素如某些原子序数较大的过渡元素和镧系、锕系中的某些元素的电子排布更为复杂,既不符合鲍林能级图的排布顺序,也不符合全充满、半充满及全空的规律;而这些元素的核外电子排布是由光谱实验结构得出的,我们应该尊重光谱实验事实;对于核外电子排布规律,只要掌握一般规律,注意少数例外即可;处于稳定状态的原子,核外电子将尽可能地按能量最低原理排布,另外,由于电子不可能都挤在一起,它们还要遵守保里不相容原理和洪特规则,一般而言,在这三条规则的指导下,可以推导出元素原子的核外电子排布情况,在中学阶段要求的前36号元素里,没有例外的情况发生;1.最低能量原理电子在原子核外排布时,要尽可能使电子的能量最低;怎样才能使电子的能量最低呢比方说,我们站在地面上,不会觉得有什么危险;如果我们站在20层楼的顶上,再往下看时我们心理感到害怕;这是因为物体在越高处具有的势能越高,物体总有从高处往低处的一种趋势,就像自由落体一样,我们从来没有见过物体会自动从地面上升到空中,物体要从地面到空中,必须要有外加力的作用;电子本身就是一种物质,也具有同样的性质,即它在一般情况下总想处于一种较为安全或稳定的一种状态基态,也就是能量最低时的状态;当有外加作用时,电子也是可以吸收能量到能量较高的状态激发态,但是它总有时时刻刻想回到基态的趋势;一般来说,离核较近的电子具有较低的能量,随着电子层数的增加,电子的能量越来越大;同一层中,各亚层的能量是按s、p、d、f的次序增高的;这两种作用的总结果可以得出电子在原子核外排布时遵守下列次序:1s、2s、2p、3s、3p、4s、3d、4p 2.保里不相容原理我们已经知道,一个电子的运动状态要从4个方面来进行描述,即它所处的电子层、电子亚层、电子云的伸展方向以及电子的自旋方向;在同一个原子中没有也不可能有运动状态完全相同的两个电子存在,这就是保里不相容原理所告诉大家的;根据这个规则,如果两个电子处于同一轨道,那么,这两个电子的自旋方向必定相反;也就是说,每一个轨道中只能容纳两个自旋方向相反的电子;这一点好像我们坐电梯,每个人相当于一个电子,每一个电梯相当于一个轨道,假设电梯足够小,每一个电梯最多只能同时供两个人乘坐,而且乘坐时必须一个人头朝上,另一个人倒立着为了充分利用空间;根据保里不相容原理,我们得知:s亚层只有1个轨道,可以容纳两个自旋相反的电子;p亚层有3个轨道,总共可以容纳6个电子;f亚层有5个轨道,总共可以容纳10个电子;我们还得知:第一电子层K层中只有1s亚层,最多容纳两个电子;第二电子层L层中包括2s和2p两个亚层,总共可以容纳8个电子;第3电子层M层中包括3s、3p、3d三个亚层,总共可以容纳18个电子第n层总共可以容纳2n2个电子3.洪特规则从光谱实验结果总结出来的洪特规则有两方面的含义:一是电子在原子核外排布时,将尽可能分占不同的轨道,且自旋平行;洪特规则的第二个含义是对于同一个电子亚层,当电子排布处于全满s2、p6、d10、f14半满s1、p3、d5、f7全空s0、p0、d0、f0时比较稳定;这类似于我们坐电梯的情况中,要么电梯是空的,要么电梯里都有一个人,要么电梯里都挤满了两个人,大家都觉得比较均等,谁也不抱怨谁;如果有的电梯里挤满了两个人,而有的电梯里只有一个人,或有的电梯里有一个人,而有的电梯里没有人,则必然有人产生抱怨情绪,我们称之为不稳定状态;二、核外电子排布的方法对于某元素原子的核外电子排布情况,先确定该原子的核外电子数即原子序数、质子数、核电荷数,如24号元素铬,其原子核外总共有24个电子,然后将这24个电子从能量最低的1s亚层依次往能量较高的亚层上排布,只有前面的亚层填满后,才去填充后面的亚层,每一个亚层上最多能够排布的电子数为:s亚层2个,p亚层6个,d亚层10个,f 亚层14个;最外层电子到底怎样排布,还要参考洪特规则,如24号元素铬的24个核外电子依次排列为1s22s22p63s23p64s23d4根据洪特规则,d亚层处于半充满时较为稳定,故其排布式应为:1s22s22p63s23p64s13d5最后,按照人们的习惯“每一个电子层不分隔开来”,改写成1s22s22p63s23p63d54s1即可原子核外电子排布应遵循的三大规律一泡利不相容原理:1.在同一个原子里,没有运动状态四个方面完全相同的电子存在,这个结论叫泡利不相容原理;2.根据这个原理,如果有两个电子处于一个轨道即电子层电子亚层电子云的伸展方向都相同的轨道,那么这两个电子的自旋方向就一定相反;3.各个电子层可能有的最多轨道数为,每个轨道只能容纳自旋相反的两个电子,各电子层可容纳的电子总数为 2 个;二能量最低原理:1.在核外电子的排布中,通常状况下,电子总是尽先占有能量最低的原子轨道,只有当这些原子轨道占满后,电子才依次进入能量较高的原子轨道,这个规律叫能量最低原理;2.能级:就是把原子中不同电子层和亚层按能量高低排布成顺序,象台阶一样叫做能级;1同一电子层中各亚层的能级不相同,它们是按s,p,d,f的次序增高; 不同亚层:ns<np<nd<nf2在同一个原子中,不同电子层的能级不同;离核越近,n越小的电子层能级越低; 同中亚层:1s<2s<3s;1p<2p<3p;3能级交错现象:多电子原子的各个电子,除去原子核对它们有吸引力外,同时各个电子之间还存在着排斥力,因而使多电子原子的电子所处的能级产生了交错现象;例如:E3d>E4S,E4d>E5S,n≥3时有能级交错现象;3.电子填入原子轨道顺序:1s2s2p3s3p4s3d4p5s4d5p6s4f5d6p7s5f6d7p,能级由低渐高;三洪特规则:1.在同一亚层中的各个轨道上,电子的排布尽可能单独分占不同的轨道,而且自旋方向相同,这样排布整个原子能量最低;2.轨道表示式和电子排布式:轨道表示式:一个方框表示一个轨道电子排布式:亚层符号右上角的数字表示该亚层轨道中电子的数目3.洪特规则的特例:同一电子亚层中当电子排布全充满、半充满、全空比较稳定;。
原子核外电子排布规则
1.电子填充顺序规则:
按照能量从低到高的顺序填充,即首先填充能量最低的电子能级。
根据电子能级的能量分布,按照从低到高的顺序填充,直到填满所有电子。
2.能量最低原理:
能量最低原理指的是,电子首先填充具有最低能量的能级。
每个电子能级可以容纳一定数量的电子,从最低能级开始填充,直到能级被填满或无法容纳更多电子为止。
3.雪球原理:
雪球原理是指每个电子能级填满前,高能级的电子数量应尽量有限。
这意味着每个能级容纳的电子数量是固定的,直到达到最大容纳量前,后续能级不会填充电子。
4. Hunds规则:
Hunds规则指出,在填充同一能级的不同轨道时,应尽量使电子的自旋相同,以达到能量最低的状态。
因此,当填充电子能级时,首先填充自旋相同的轨道,在轨道填满后再填充自旋相反的轨道。
5.化学惰性规则:
在填充外层电子时,有些元素倾向于满足化学惰性规则。
化学惰性是指一些元素的外层电子已经填满,并且外层电子数量达到稳定状态,不容易与其他原子形成化学键。
这种稳定状态可以通过填满s和p轨道的电子达到。
以上是一种常用的原子核外电子排布规则,不同元素的电子排布可能会有所不同。
电子排布规则对于理解元素的化学性质和反应有重要意义。
原子核外电子的排布教学目标知识技能:了解原子核外电子运动的特征和电子云的概念,明确微观粒子和宏观物体的运动有不同的规律;初步掌握原子核外电子排布规律,会画1~20号元素原子和离子结构示意图;会根据原子、阳离子和阴离子的质子数和核外电子数之间的关系进行有关的计算。
能力培养:培养学生的观察能力、分析能力和抽象思维的能力。
科学思想:通过微观粒子与宏观物体运动的分析,培养学生辩证思维的思想。
科学品质:对学生进行严格的科学态度教育。
科学方法:通过观察、学会分析,归纳,总结问题。
重点、难点电子云概念;原子核外电子排布的规律;1~20号元素原子和离子结构示意图;根据原子、阳离子和阴离子的质子数和核外电子数之间的关系进行有关的计算。
教学过程设计教师活动学生活动设计意图【引入】日常生活中,我们经常接触到一些运动着的物体,如:【软件演示】奔驰在公路上的汽车;飞行的炮弹;围绕地球作高速运转的人造卫星;遨游在浩瀚太空的宇宙飞船……它们的运动和原子核外电子这样的微观粒子的运动有什么区别呢?原子核外的电子到底是如何运动的?有什么特点?原子核外电子的排布有何规律?这是我们这节课要研究的主要内容。
观察软件演示的各个运动物体的动画画面,思考宏观物体的运动规律。
通过栩栩如生的动画画面,激发学生的求知欲,为新课的学习奠定情感的基础。
【板书】第二节原子核外电子的排布【设问】核外电子的运动和宏观物体的运动有什么不同?续表教师活动学生活动设计意图【板书】一、原子核外电子运动的特征【软件演示】宏观物体运动和核外电子运动的区别:1.宏观物体运动速度和核外电子运动速度相比可忽略不计。
在思考问题的过程中,通过观察软件演示的有关核外电子和宏观物体相对比的数据,比较宏观物体和核外电子运动的不同。
观察、分析表中数领悟培养学生的观察能力、分析问题和归纳总结的能力,明确微观粒子和宏观物体的不同之处,培养辩证思维的思想。
运动物体运动速度(km/s)汽车炮弹人造卫星宇宙飞船氢原子核外电子(约为光速的1%)2.核外电子运动范围和宏观物体的运动范围相比可忽略不计。
乒乓球的直径原子核外电子的运动范围4×10-2m n×10-10m3.原子核外电子的质量和宏观物体的质量相比可忽略不计。
原子核外电子的质量很小,约为×10-31kg,只有质子质量的1/1836!【提问】从这些数据中,你能得出什么结论?由于原子核外电子的质量很小,运动速度很大,运动范围又很小所以它和宏观物体的运动规律不同。
我们们法描述电子的运动轨迹,也无法指出在某一时刻或某一瞬间它在空间所处的位置。
【过渡】原子核外电子是如何运动的呢?【软件演示】氢原子核外电子的运动情况。
结合软件,思考如何描述原子核外电子的运动。
培养学生的观察能力。
续表教师活动学生活动设计意图【组织讨论】怎样描述原子核外电子的运动?讨论后回答:电子在原子核外的这个极小的空间内作高速运动,时而出现在离核远处,时而出现在离核近处,没有固定的轨道。
培养学生分析问题和解决问题的能力。
【设问】电子的绕核运动没有固定的轨道,是不是说电子绕核运动没有规律?【举例】日常生活中,蜜蜂在某一朵花附近采蜜时,没有确定的飞翔路径,一会儿向西,一会儿向东,蜜蜂在这朵花的近处、远处都可能出现,似乎没有什么规律。
但经过仔细观察不难发现:蜜蜂在花朵附近出现的次数比在远离花朵的地方大得多。
【解释】电子在原子核外的这个极小的空间内作高速运动,时而出现在离核远处,倾听,领悟。
思考如何正确描述核外电子的运动。
创设情境,引发学生思考的兴趣,使学生逐步由感性认识上升到理性认识,在生活实例中初步认识化学本质。
将抽象的原子核外电子的运动用生动形象的动画表时而出现在离核近处,我们不能精确测定或计算出电子在某一时刻的位置,但是能从理论上统计出它在原子核外某一范围内出现的机会的多少。
【投影】氢原子核外电子云示意图。
现出来后,变抽象为具体,培养学生的抽象思维能力和概括能力。
【总结】电子在原子核外的空间各处出现的结果,好似一团“带负电的云雾”笼罩在原子核的周围,电子出现机会多的地方,这团“云雾”就显得浓密些,在电子出现机会少的地方,这团“云雾”就显得“疏淡”些。
这团“带负电的云雾”被形象地称为“电子云”。
结合投影,理解电子云的概念,并复述电子云的概念。
在老师的帮助下,真正认识核外电子运动本质,形成电子云的概念。
【板书】原子核外电子的运动规律与宏观物体的运动规律不同。
续表教师活动学生活动设计意图【提问】在多电子的原子中,电子的能量是不同的。
能量不同的电子在核外运动时离核的距离相同吗?思考并猜想:能量不同的电子在原子核外运动时,离核的距离是不同的。
能量低的电子由于核对它的引力较强,只能在离核较近的区域运动;能量高的电子则在离核远的区域运动。
【讲述】科学上形象地把能量不同的电子运动的区域称为电子层。
离核最近的称为第1电子层,也叫K层;能量稍高,离核较远的电子层称为第2电子层,也叫L层;由里往外依次为第倾听,领悟。
由提问引入原3,4,5,6…层,也叫M,N,O,P…层等等。
这样不同能量的核外电子就排布在不同的电子层中。
子核外电子排布规律。
【板书】二、原子核外电子排布规律【设问】原子核外电子的排布有哪些规律?【软件演示】原子核外电子排布规律:1.电子总是从能量最低的电子层排起,然后再由里往外,依次排在能量逐渐升高的电子层里。
如:H和He的原子核外分别有1和2个电子,这1和2个电子就排在第一个电子层里。
请画出它们的原子结构示意图。
2.每个电子层只能容纳一定数目的电子,所容纳的电子数最多只能容纳2n2个(n为电子层数)。
即K 层最多只能容纳2个电子:L层最多只能容纳8个电子;而第3层最多只能容纳18个电子。
请判断元素3Li的原子结构示意图为:利用计算机辅助教学软件,展示原子核外电子排布规律,使之更好地掌握新知识、新规律,并学会应用规律解决问题。
续表教师活动学生活动设计意图11Na的原子结构示意图为:判断后回答:应该是(A)。
判断后回答:应该是(A)。
判断后回答:应该是(B)。
通过分析、判断理解原子核外电子排布的规律。
3.最外层最多只能容纳8个电子(K层为最外层时,最多只能容纳2个电子)。
次外层电子数目不超过18个,倒数第三层电子数目不超过32个。
请判断19K的原子结构示意图是:【投影】课堂练习1.请画出质子数1~20各元素的原子结构示意图。
2.质子数为13,核外有10个电子的微粒的符号和结构示意图是()。
(A)符号:Al结构示意图:利用原子核外电子的排布规律,画出1H~20Ca的原子结构示意图,并对2、3、4题作出判断。
同桌学生互评。
帮助学生在感知、再现、思考、概括、记忆的过程中复习旧知识,掌握新知识,培养严谨的思维习惯。
(B)符号:Al3+结构示意图:(C)符号:Al结构示意图:(D)符号:Al3+结构示意图:3.K电子层和M电子层电子数目相同的原子的结构示意图为()。
续表教师活动学生活动设计意图4.电子层结构和氖原子相同的-1价阴离子的符号和结构示意图为()。
思考、辨认、判断。
思考、辨认、判断。
通过学生的辨别,使他们掌握原子、简单离子核外电子排布的不同。
【总结】实际原子核外电子的排布规律远比以上三点要复杂得多。
我们只要求掌握以上三点规律。
但要注意:以上三点规律是相互联系的,必须同时遵守。
培养严格的科学态度。
【作业】课本第128页第1,2题。
【随堂检测】1.原子核外最外层电子数比次外层电子数多3个的原子的符号是()。
(A)N(B)B(C)P(D)Al2.L层电子数与M层电子数相同的+1价阳离子的符号是()。
续表教师活动学生活动设计意图3.已知X元素的原子核外电子数为n,X2-离子和Y3+离子的电子层结构相同,则Y原子的质子数为()。
(A)n+1(B)n+2(C)n+4(D)n+546 有a X n+和b Y m-两种元素的简单离子,若它们的电子层结构相同,则下列关系正确的是()。
(A)b-a=n+m(B)a-b=n+m(C)b-a=n-m(D)a+b=n+m检测学生对应知应会知识的掌握情况,落实原子核外电子排布规律。
附1:课堂练习答案1.(略)2.(D)3.(C)4.(B)随堂检测答案1.(A)2.(C)3.(D)4.(B)。