水的合成
- 格式:ppt
- 大小:1.00 MB
- 文档页数:17

水的分解与合成教案第一章:引言1.1 教学目标:让学生了解水的分解与合成的重要性和实际应用。
激发学生对水的分解与合成实验的兴趣。
1.2 教学内容:引入水的分解与合成的概念。
介绍水的分解与合成的实验方法和步骤。
1.3 教学方法:采用问题引导法,引导学生思考水的分解与合成的意义。
通过实验演示,激发学生的兴趣和好奇心。
1.4 教学资源:实验室用具:烧杯、试管、电解器等。
实验试剂:水、氢氧化钠、硫酸等。
1.5 教学步骤:引入水的分解与合成的概念,引导学生思考水的分解与合成的意义。
演示水的分解实验,解释电解水的原理。
演示水的合成实验,解释水的合成的过程。
第二章:水的分解实验2.1 教学目标:让学生了解电解水的原理和实验方法。
培养学生进行实验操作的能力。
2.2 教学内容:介绍电解水的原理。
讲解水的分解实验的步骤和注意事项。
2.3 教学方法:采用实验演示法,让学生直观地观察水的分解过程。
采用问题引导法,引导学生思考电解水的原理。
2.4 教学资源:实验室用具:烧杯、试管、电解器等。
实验试剂:水、氢氧化钠、硫酸等。
2.5 教学步骤:讲解电解水的原理,引导学生理解电解水的过程。
演示水的分解实验,让学生观察电解水的现象。
引导学生进行实验操作,培养学生的实验能力。
第三章:水的合成实验3.1 教学目标:让学生了解水的合成的过程和实验方法。
培养学生进行实验操作的能力。
3.2 教学内容:介绍水的合成的过程。
讲解水的合成实验的步骤和注意事项。
3.3 教学方法:采用实验演示法,让学生直观地观察水的合成过程。
采用问题引导法,引导学生思考水的合成的意义。
3.4 教学资源:实验室用具:烧杯、试管、氢氧化钠、硫酸等。
3.5 教学步骤:讲解水的合成的过程,引导学生理解水的合成的原理。
演示水的合成实验,让学生观察水的合成现象。
引导学生进行实验操作,培养学生的实验能力。
第四章:水的分解与合成的应用4.1 教学目标:让学生了解水的分解与合成的应用领域。


光合作用形成水的原理光合作用是指植物和某些微生物利用光能将二氧化碳和水合成有机物质和氧气的过程。
在光合作用中,光能被植物转化为化学能,以满足其生长和代谢的需要。
光合作用的核心反应是水的光解反应,即将水分子分解为氧气和氢离子。
光合作用发生在植物的叶片细胞中的叶绿体中。
叶绿体是一种细胞器,其中含有叶绿素分子,其具有吸收光能的能力。
当叶绿体吸收到光子能量后,能量被传递到叶绿素分子的反应中心,这是光能转化为化学能的第一步。
叶绿体中的反应中心分子将光能转化为化学能,开始对水进行光解反应。
在光解反应中,水分子被氧化,产生氧气和氢离子。
这个过程需要能量,而光能提供了这种能量,使水分子能够被分解。
光解反应的基本过程可以分为两个阶段:光系统II和光系统I。
光系统II是光合电子传递链中的第一阶段,这个过程发生在叶绿体的膜上。
在这个阶段,光能被吸收,激发反应中心中的电子。
这些激发的电子被传递到光合电子传递链中的光系统I。
在光系统I中,光合电子传递链的第二阶段发生。
在这个阶段,光能再次被吸收,导致反应中心中的电子再次被激发。
然后,这些电子被传递到叶绿体膜上的一系列小分子中,最终被传递到NADPH分子中,形成化学能。
与此同时,光系统II中的激发电子被引导到叶绿体膜上的质子泵,质子泵将质子从一个侧面移动到另一侧,形成了质子梯度。
质子梯度反过来驱动了ATP合成酶产生ATP,这也是光合作用中的另一种化学能形式。
最后,通过光合作用的反应生成的NADPH和ATP将进一步参与到光独立反应中,即暗反应。
在暗反应中,NADPH和ATP提供能量和电子,将二氧化碳还原为有机化合物,如葡萄糖。
这些有机化合物可以进一步合成其他生物分子,满足植物生长和代谢的需要。
总之,光合作用形成水的原理是利用植物叶绿体中的叶绿素分子吸收光能,在光系统II、光系统I和暗反应中将水分子光解,生成氧气、氢离子以及化学能的NADPH和ATP。
光合作用是一种非常复杂和重要的生物化学过程,它不仅为植物提供了能量和有机物质,也维持了地球上氧气的丰富和环境平衡。

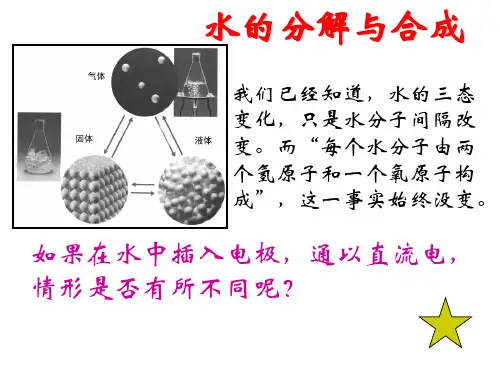
第二单元探秘水世界第二节水分子的变化一、水的分解1.实验原理:水在通直流电的情况下,生成氧气和氢气。
化学方程式:2H2O2H2↑+O2↑2.实验装置、3.实验现象:电源的正负极产生气泡;正极产生的气体能使带火星的木条复燃;负极产生的气体能燃烧,燃烧时产生蓝色火焰,两种气体的体积之比为1:2。
4.实验结论:水是由氢氧两种元素组成的;在化学变化中,分子可以再分,原子不可以再分。
注意:电解水的实验接通的是直流电,而非交流电。
水的导电性很弱,为了增强水的导电性,可以在水中加入少量的NaON或稀硫酸。
水在通直流电的情况下分解成氢气和氧气,不能错误的认为水是由氢气和氧气组成的。
二、水的合成1.实验原理:氢气在空气中点燃,生成水。
化学方程式:2.实验装置:3.实验现象:纯净的氢气在空气中燃烧,产生淡蓝色的火焰,放出大量的热,烧杯壁上凝结有水雾。
4.氢气的用途:氢气由于其制取原料丰富,热值高,无污染,所以氢气是一种理想的高能燃料。
5.氢气如果不纯,混有空气或氧气,遇到明火可能发生爆炸,因此在点燃氢气之前,一定要检验氢气的纯度。
检验氢气纯度的方法:收集一试管氢气,用拇指堵住试管口,试管口向下移近酒精灯火焰,如果听到声音很小,说明氢气比较纯,如果听到尖锐的报警声,氢气不纯。
三、分解反应和化合反应1.分解反应:由一种物质生产两种或两种以上其他物质的反应。
“一变多”2.化合反应:由两种或两种以上物质生成一种物质的反应。
“多变一”四、物理性质和化学性质1.物理性质:物质不需要发生化学变化就能表现出出来的性质称为该物质的物理性质,如物质的熔点、沸点、颜色、状态、位置等。
2.化学变化:物质在化学变化中表现出来的性质称为该物质的化学性质,如可燃性、毒性、酸碱性等。
区别物质的物理性质和化学性质关键是看物质的性质是否通过化学变化表现出来。
3.物质的性质和物质的变化联系和区别联系:物质的性质决定物质的变化;物质的变化反应了物质的性质。

水的分解与合成、原子构成、离子以及相对原子质量知识梳理一、 知识回顾(一) 知识点:水的分解与合成1.电解水试验通电后正极产生 气,负极产生 气,体积比为 ,文字表达式为: 。
2.实验表明:化学反应的实质是 可以分,而 不可分,整个化学变化本质上就是 的重新组合。
3.分解反应与化合反应:一分多、多合一(二) 知识点:原子 1. 卢瑟福的ά粒子轰击金箔实验:(1) 大部分带正电的ά粒子穿过金箔并且不改变方向,是因为原子核本身体积小,核外有广大的空间。
(2) 少数带正电ά粒子改变方向发生偏转,是因为途径金原子核周边时遇到正电的斥力,从而发生偏转。
(3) 极少数带正电ά粒子反弹回来是因为撞击到带正电的原子核正中,同极相斥发生反弹。
2. 原子的结构:(1) 原子核是由带 的质子和 的中子构成的。
原子的质量集中在 上。
(2)其中,在原子中: = =(3)可以直接构成物质的微粒有三种: 、 、 。
并不是所有的原子中都有中子,其中某种氢原子原子核内就不存在中子。
3.原子结构示意图:(1)各部分意义:在中,圆圈表示: ,+9表示 ,弧线表示 ,弧线上的数字2、8表示 ,最外层电子数是 。
(2)在任何结构示意图中,只要是 相同,则表示属于同种元素,元素的性质,特别是元素原子的化学性质与 关系密切。
(三)知识点:离子1.离子就是 的原子(或者是原子团)。
2.离子根据带电性质分为带 电的 离子和带 电的 离子,判断原子与离子可以根据结构示意图中质子数与核外电子是否相同,相同是 ,不相同则为 。
判断阴阳离子可以根据得失电子来判断,得到形成 离子,失去形成 离子。
3.元素分为金属元素、非金属元素和稀有气体元素三类,其中稀有气体元素的最外层结构属于 结构,金属元素原子在化学反应中因为最外层电子数通常 4个而容易失去电子成为阳离子,相反,非金属元素原子在化学反应中因为最外层电子数通常 4个而容易失去电子成为阴离子。
4.离子符号:氢离子 氧离子 镁离子 钾离子 钠离子 氯离子原子核(带 ) 原子( 电性) (1个 带 ) (1个 带 )中子( )在离子符号前的数字表示离子个数,右上角的数字、符号表示带电情况。

《水的分解与合成》复习(1课时) 《水的分解与合成》复习(1课时)编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(《水的分解与合成》复习(1课时))的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为《水的分解与合成》复习(1课时)的全部内容。
初三化学第二章第二节《水的分解与合成》复习(1课时)一、学习目标:1、通过水电解、氢气燃烧的实验,认识水的组成。
2、通过水的分解和氢气的燃烧反应,进一步了解分解反应、化合反应,并能对学过的典型反应进行分类。
3、能正确的分析出常见物质的构成粒子,是分子还是原子.4、进一步认识化学反应的实质:分子分解成原子,而原子重新组合成新分子。
分子和原子的本质区别:在化学变化中,分子可以再分,而原子不可以再分。
5、进一步体会水是一种重要的自然资源、氢气是一种理想能源的涵义,具有保护水资源的意识.二、重点:水的分解和氢气的燃烧反应的现象、结论及反应类型的区别。
难点:区别物理性质、物理变化、化学性质和化学变化。
三、学法指导:比较与对比法。
当我们要寻找两件事物相同和不同之处时,就需要比较和对比。
比较是为了找出事物的相似点,对比是为了找出事物的不同点。
本节课中“水的分解与合成"、“分子与原子”、“化学反应与分解反应”、“化学性质与物理性质”等知识就采用了比较和对比的方法.四、学习过程:(一)知识梳理:1、电解水时,在水中加入少量硫酸或氢氧化钠是为了。
2、电解水的过程中发生变化的微粒是 ,保持不变的微粒是和,生成的新微粒是和。
该实验证明,在化学反应中可以再分,则不可以再分。
3、能保持水的化学性质的粒子是 .4、构成物质的基本粒子有和等,如氧气、水、二氧化碳等是由构成;铜、金刚石、氦气等是由构成.5、由生成其他物质的反应,叫做分解反应。


合成水的化学方程式-概述说明以及解释1.引言1.1 概述概述:合成水是指通过化学方法合成出来的水,而不是来自自然界的水源。
这种方式的出现,使得水资源得到了极大的丰富。
合成水的研究和应用已经成为当今科学领域的热点之一,对环境保护、水资源利用以及未来可持续发展具有重要意义。
本文将介绍合成水的化学方程式、重要性以及应用领域,希望能为读者深入了解合成水的意义和发展提供一些参考。
1.2 文章结构文章结构部分的内容可以包括对整篇文章的结构和内容进行简要介绍。
如下:文章结构部分:本文首先介绍了合成水的重要性,随后详细探讨了合成水的化学方程式以及其在应用领域的具体应用。
最后,对合成水的意义进行总结,并展望了未来可能的发展方向。
通过对合成水的化学方程式及其应用进行系统性的分析和总结,本文旨在全面了解合成水的重要性和潜在的发展前景。
1.3 目的:本文的主要目的是探讨合成水的化学方程式,介绍合成水在现代社会中的重要性和应用领域。
通过对合成水的化学方程式进行深入分析和解释,我们可以更好地理解合成水的制备过程,并且了解其在工业生产、环境保护和生活用水等方面的应用。
同时,文章也旨在强调合成水的意义,并展望未来合成水技术的发展方向,为读者提供对合成水更深入的了解和思考。
2.正文2.1 合成水的重要性合成水是一种通过化学反应而产生的水,它在现代社会中扮演着非常重要的角色。
首先,合成水具有对环境友好的特性,它可以减少对地下水和自然水资源的使用,有效地节约了水资源。
其次,合成水的生产过程可以减少化石能源的使用,有利于减少温室气体的排放,从而有助于保护地球环境和气候变化的控制。
此外,合成水还可以为一些特殊领域提供纯净的水源,比如在实验室和工业生产中需要高纯度水的场合,合成水具有独特的优势。
总的来说,合成水的重要性不仅体现在节约水资源和保护环境方面,还体现在推动科技创新和高纯水应用等领域。
随着技术的不断进步和应用领域的不断拓展,合成水的重要性将会进一步凸显。

第1篇一、实验目的1. 理解水的合成原理,掌握水的化学合成方法。
2. 通过实验,观察水的合成过程,验证水的化学性质。
3. 了解实验室操作规范,提高实验技能。
二、实验原理水是由氢气和氧气在特定条件下反应生成的,反应方程式为:2H₂ + O₂ → 2H₂O。
在实验室中,通常采用电解水的方法来合成水。
电解水是将直流电通过水溶液,使水分解成氢气和氧气。
三、实验器材1. 电源:直流电源,电压1.5~3V,电流0.1~0.5A。
2. 电解槽:采用两片电极(铂电极或石墨电极)固定在电解槽内,电极间距离约2~3cm。
3. 电解液:纯水或稀硫酸溶液(1mol/L)。
4. 气体收集装置:集气瓶、橡胶管、夹子等。
5. 实验仪器:烧杯、滴管、量筒、试管、酒精灯、镊子等。
四、实验步骤1. 将电解槽中的电极固定好,电极间距离约2~3cm。
2. 在电解槽中加入适量的电解液,如纯水或稀硫酸溶液。
3. 将电极插入电解液中,确保电极接触良好。
4. 将电解槽连接到直流电源,调节电压和电流,使电流稳定在0.1~0.5A。
5. 观察电解过程,记录气泡产生的数量、大小和颜色变化。
6. 当电解一段时间后,关闭电源,取出电极。
7. 将收集到的气体分别收集在两个集气瓶中,一个用于收集氢气,另一个用于收集氧气。
8. 使用点燃的火柴测试收集到的气体,观察燃烧情况。
五、实验现象1. 在电解过程中,电极上产生气泡,气泡逐渐增多,颜色由无色变为淡蓝色。
2. 氢气和氧气分别收集在两个集气瓶中,氢气燃烧时产生淡蓝色火焰,氧气燃烧时火焰较亮。
3. 电解过程中,电解液逐渐减少,产生少量沉淀物。
六、实验结果与分析1. 通过实验观察,电解水过程中,氢气和氧气分别在两个电极上产生,验证了水的化学合成原理。
2. 实验结果表明,氢气和氧气的体积比为2:1,符合化学方程式2H₂ + O₂ → 2H₂O 的比例。
3. 实验过程中,电解液逐渐减少,产生少量沉淀物,说明电解过程中有副反应发生。

水的化学合成公式
直接合成方法主要有以下两种:
1.氢气与氧气直接反应:2H2+O2→2H2O
这是一种常见的实验室制备水的方法。
在合适的条件下,将氢气和氧气通入反应器中,通过点燃来引发高温反应,生成水。
这个反应是一个燃烧反应,释放大量的能量。
2.氢氧化钠和盐酸反应:2NaOH+HCl→2H2O+NaCl
这是一种常见的工业方法,也是一种滴定反应。
在碱性溶液中加入盐酸,盐酸中的氢离子与氢氧化钠溶液中的氢氧根离子结合,生成水和盐。
间接合成方法主要有以下两种:
1.氢气的还原:2H++2e-→H2;2e-+0.5O2→O2-
这是一种在生物体内发生的合成方法。
在细胞呼吸作用中,氢原子通过电子传递链与氧气反应,生成水。
这个过程是生物体通过产生能量来维持生命所必需的。
2.氨合成反应:N2+3H2→2NH3;2NH3+O2→2H2O+2N2
这是一种工业方法,用于制备氨。
首先将氢气和氮气在高温高压下反应,生成氨。
然后,通过氨氧化反应将氨转化为水和氮气。
这个过程中,水是一个中间产物。
化学合成水的公式中的H2O表示水分子中所含的两个氢原子和一个氧原子。
这个公式揭示了水分子的基本结构和组成,可见水分子的稳定性和共价键的强度。
第二节 水的分解与合成知识梳理1.水的分解(1)实验现象:通电后电极上产生________,与电源正极相连的玻璃管内气体体积较小,与电源负极相连的玻璃管内气体体积较大,二者的体积比是________。
(2)气体的检验:体积较小的气体能使带火星的木条复燃,这种气体是________。
体积较大的气体接近火焰时能燃烧,火焰呈淡蓝色,这种气体是________。
(3)反应的文字表达式为:________________________。
(4)通常状况下,水是________、________的液体,密度是________,在101 kPa 下,水的凝固点是________,沸点是________。
答案:(1)气泡 2∶1 (2)氧气 氢气 (3)水−−→−通电氢气+氧气 (4)无色 无味 1.0 g ·cm -3 0 ℃ 100 ℃2.分解反应是指________________________________。
答案:一种物质生成两种或两种以上的物质的反应3.分子、原子的本质区别在化学变化中分子可分,而原子________,有的物质是由分子构成的,如 ________;有的物质是由原子构成的,如________。
答案:不可再分 氧气 铜4.水的合成在空气中点燃氢气,并在火焰上方罩一个冷而干燥的烧杯。
(1)现象:氢气在空气中燃烧,产生________火焰,烧杯内壁有________,用手触摸烧杯壁感觉非常烫,说明反应放出了大量的热,该实验说明氢气具有的化学性质是氢气具有________。
(2)氢气作为一种新型燃料,是未来最理想的能源,这是因为________、________、________。
答案:淡蓝色 水珠 可燃性 来源广泛 燃烧热值高 无污染5.化合反应是指________________。
答案:两种或两种以上的物质生成一种物质的反应6.物理性质和化学性质物质在化学变化中表现出来的性质叫做________。