高中化学第一单元走进化学工业课题2人工固氮技术——合成氨教案新人教版选修2
- 格式:doc
- 大小:105.50 KB
- 文档页数:2

人工固氮技術——合成氨一、教材分析和建議本課題圍繞著合成氨的反應原理以及實現工業化生產的有關問題展開討論,幫助學生瞭解合成氨工業生產的主要原理和過程,認識並體會由實驗室研究到工業化生產所需要經歷的過程。
教科書的設計是,為了說明如何將大氣中的氮固定下來這一中心問題,首先,呈現問題提出的背景,也就是人們為什麼要想方設法地將大氣中的氮固定下來,直接的原因是滿足人類對氮肥、硝酸等含氮化合物的需要,間接的原因是地殼中氮元素的含量少、分佈不均;緊接著的問題是如何將大氣中的氮固定下來,指出合成氨在科學上和技術上的突破。
最後,討論和評價並引發思考合成氨工業發展所面臨的新問題。
這種設計整體上體現了技術實踐中問題解決不斷迴圈發展的一般過程,如下頁圖所示。
教學建議如下:1. 注意引導學生思考人工固氮技術——合成氨對於人類社會發展的重要意義,體現化學與技術發展的社會需求導向,並對技術生產評價標準的多元化有一個初步的認識。
說明在化學研究中,有些課題是屬於學術研究的熱點和重點,但不一定是技術研究開發的熱點和重點,技術研究往往要解決實際生產和生活中的具體問題,是受社會需求驅動的,這一點貫穿於整個教科書體系的設計中。
另外,化學技術創新往往要落實在一種產品的生產上,合成氨就是這方面的典型代表。
在課題1瞭解化工生產過程中的基本問題的基礎上,引導學生思考將實驗室研究轉化成實際生產時面臨的一些問題,展示由一種原理上可行的設想轉變成實際生產過程中人們所要付出的艱苦努力。
對於有志於理工科的學生來說,在培養科學技術素養的同時不斷提高人文素養;對於有志於人文學科的學生來說,要幫助他們形成對於科學技術在社會發展中重要作用的正確認識。
例如,可以結合對哈伯其人其事(見教學資源)的分析評價,請同學們討論和交流各自的看法。
2. 通過實驗學習合成氨的反應原理,利用化學反應速率、化學平衡移動原理分析和討論合成氨的適宜反應條件。
由於氮氣具有特殊的穩定性,合成氨是人工固定氮的一種方法,但反應條件比較苛刻。
人工固氮技術---合成氨教學目的:1.利用所學的化學反應速率和化學平衡理論解釋合成氨中的相關問題;2.瞭解合成氨的主要原理、原料、重要設備、流程和意義。
教學重點、難點:利用所學的化學反應速率和化學平衡理論解釋合成氨中的相關問題。
探究建議:參觀化工廠或觀看有關的影像資料片,考察企業的選址情況,收集產品的生產原理、原料利用率、能耗、投資和成本核算等資料,撰寫考察報告。
課時劃分:一課時教學過程:[課堂作業]1.合成氨工業對化學工業和國防工業有重要的意義,對我國實現農業現代化起著重要的作用。
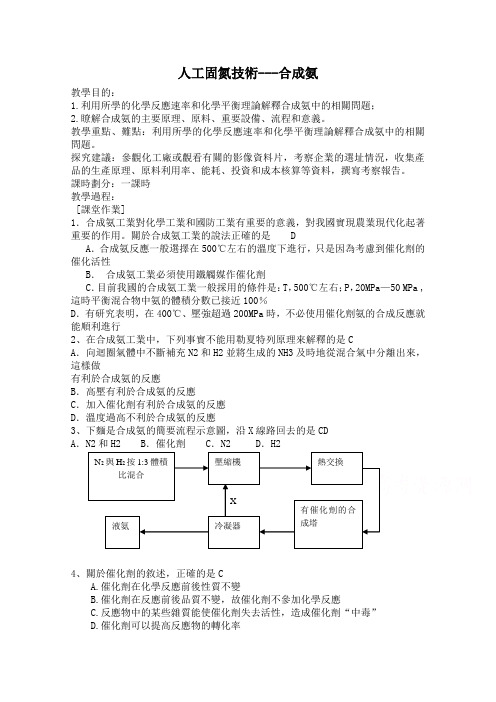
關於合成氨工業的說法正確的是 DA .合成氨反應一般選擇在500℃左右的溫度下進行,只是因為考慮到催化劑的催化活性B . 合成氨工業必須使用鐵觸媒作催化劑C .目前我國的合成氨工業一般採用的條件是:T ,500℃左右;P ,20MPa —50 MPa ,這時平衡混合物中氨的體積分數已接近100%D .有研究表明,在400℃、壓強超過200MPa 時,不必使用催化劑氨的合成反應就能順利進行2、在合成氨工業中,下列事實不能用勒夏特列原理來解釋的是CA .向迴圈氣體中不斷補充N2和H2並將生成的NH3及時地從混合氣中分離出來,這樣做有利於合成氨的反應B .高壓有利於合成氨的反應C .加入催化劑有利於合成氨的反應D .溫度過高不利於合成氨的反應3、下麵是合成氨的簡要流程示意圖,沿X 線路回去的是CDA .N2和H2B .催化劑C .N2D .H24、關於催化劑的敘述,正確的是CA.催化劑在化學反應前後性質不變B.催化劑在反應前後品質不變,故催化劑不參加化學反應C.反應物中的某些雜質能使催化劑失去活性,造成催化劑“中毒”D.催化劑可以提高反應物的轉化率 N 2與H 2按1:3體積比混合 壓縮機 熱交換 有催化劑的合成塔 冷凝器 液氨 X5、下列反應起了氮的固定作用的是DA.NH3經催化氧化獲得NOB.NO2跟水作用制取硝酸C.NH3+CO2+H2O=NH4HCO3D.N2+O2=2NO(放電條件)6、工業上用氨和二氧化碳反應合成尿素.已知下列物質在一定條件下均能與水反應產生H2和CO2,H2是合成氨的原料,CO2供合成尿素用.若從充分利用原料的角度考慮,選用 (填序號)物質作原料較好BA.COB.石腦油(C5H12、C6H14)C.CH4D.焦炭7.哈伯因發明了由氮氣和氫氣合成氨氣的方法而獲得1918年諾貝爾化學獎.現向一密閉容器中充人1molN2和3molH2,在一定條件下使該反應發生,有關說法正確的是CA.達到化學平衡時,N2將完全轉化為NH3B.達到化學平衡時,N2、H2和NH3的物質的量濃度一定相等C.達到化學平衡時,N2、H2和NH3的物質的量濃度不再變化D.達到化學平衡時,正反應和逆反應的速率都為零8.合成氨所需的氫氣由煤與水發生反應制得,其中一步反應為:CO+H2OCO2+H2(正反應為放熱),要使CO轉化率提高,可採用下列措施中的ACA. 增大水蒸氣的濃度B. 增大CO的濃度C. 降低溫度D. 增大壓強9、實驗室用N2、H2合成氨氣,並用酚酞試液檢驗生成的氨氣,用鋅與鹽酸反應制取氫氣;用NaNO2飽和溶液和NH4Cl飽和溶液共熱制取氮氣:NaNO2+NH4Cl=NaCl + NH4NO2NH4NO2 N2↑+2H2O。

第一单元 走进化学工业课题二 人工固氮技术——合成氨第1课时教学目标1.利用所学的化学反应速率和化学平衡理论解释合成氨中的相关问题;2.了解合成氨的主要原理、原料、重要设备、流程和意义。
教学重点利用所学的化学反应速率和化学平衡理论解释合成氨中的相关问题。
课时安排2课时 教学过程新课教学:固氮反应: 叫“固氮反应”. 主要的固氮反应有:生物固氮、自然固氮、化学固氮和人工模拟生物固氮。
1、生物固氮:是一种主要的自然固氮反应,如植物在根瘤菌作用下直接吸收空气中的N 2转化为氨等,进一步合成氮白质。
2、自然固氮:如闪电产生的巨大电压,其电火花足可以击破氮分子的叁键,促使其与氧气反应生成NO.进而生成NO 2和HNO 3等。
3、化学固氮:合成氨反应;在放电条件下使氮气与氧气反应生成NO 等;氮气与镁反应生成氮化镁。
4、人工模拟生物固氮:通过化学方法,制备出类似生物“固氮菌”的物质,使空气中的氮气在常温常压下与水及二氧化碳等反应,转化为氨态氮或铵态氮,进而实现人工合成大量的蛋白质等,最终实现工厂化生产蛋白质食品。
对比思考:“固硫”反应的概念是:将废气中对空气造成污染的SO 2转化为固态含硫化合物。
如实验室用NaOH 溶液吸收多余的SO 2生成Na 2SO 3,硫酸工业中用氨水吸收SO 2生成亚硫酸铵,燃烧煤等产生的SO 2用Na 2SO 3溶液吸收生成NaHSO 3,在煤中加入一定比例的CaCO 3或CaO 使SO 2转化为CaSO 3。
一、应用化学反应速率和化学平衡移动原理,解释合成氨工业的适宜条件的选择理由工业生产中既要考虑尽量增大反应物的转化率,充分利用原料,又要选择较快的反应速率,提高单位时间产率。
以上两点是选择反应条件的出发点。
当二者发生矛盾时,要结合具体情况辩证分析,找出最佳反应条件。
合成氨反应条件的选择原理: 选择根据 :N 2(g) + 3H 2(g)2NH 3(g) △H=-92.4KJ·mol -11、 反应特点:①N 2极不活泼,通常条件下反应难以进行 ②是一个气体体积缩小的反应 ③是一个放热反应 2、可供选择的条件:反应条件 加快反应速率的措施 增大反应程度的措施 ①压强 高压 高压 ②温度 高温 降温 ③催化剂 铁触媒 ____ ④浓度 ______ 及时分离出氨 3、选择条件时综合考虑的因素: (1)合成氨反应的特点:体积缩小、放热、可逆。

課題2 人工固氮技術---合成氨相關素材一、哈伯和哈伯法合成氨19世紀以前,一些有遠見的化學家指出:考慮到將來的糧食問題,為了使子孫後代免於饑餓,我們必須寄希望於科學家能實現大氣固氮。
因此將空氣中豐富的氮固定下來並轉化為可被利用的形式,在20世紀初成為一項受到眾多科學家注目和關切的重大課題。
哈伯就是從事合成氨的工藝條件試驗和理論研究的化學家之一。
利用氮、氫為原料合成氨的工業化生產曾是一個較難的課題,從第一次實驗室研製到工業化投產,約經歷了150年的時間。
1795年有人試圖在常壓下進行氨合成,後來又有人在50個大氣壓下試驗,結果都失敗了。
19世紀下半葉,物理化學的巨大進展,使人們認識到由氮、氫合成氨的反應是可逆的,增加壓力將使反應推向生成氨的方向:提高溫度會將反應移向相反的方向,然而溫度過低又使反應速度過小;催化劑對反應將產生重要影響。
這實際上就為合成氨的試驗提供了理論指導。
當時物理化學的權威、德國的能斯特就明確指出:氮和氫在高壓條件下是能夠合成氨的,並提供了一些實驗數據。
法國化學家勒夏特列第一個試圖進行高壓合成氨的實驗,但是由於氮氫混和氣中混進了氧氣,引起了爆炸,使他放棄了這一危險的實驗。
在物理化學研究領域有很好基礎的哈伯決心攻克這一令人生畏的難題。
哈伯首先進行一系列實驗,探索合成氨的最佳物理化學條件。
在實驗中他所取得的某些數據與能斯特的有所不同,他並不盲從權威,而是依靠實驗來檢驗,終於證實了能斯特的計算是錯誤的。
在一位來自英國的學生洛森諾的協助下,哈伯成功地設計出一套適合於高壓實驗的裝置和合成氨的工藝流程,這流程是:在熾熱的焦炭上方吹入水蒸汽,可以獲得幾乎等體積的一氧化碳和氫氣的混和氣體。
其中的一氧化碳在催化劑的作用下,進一步與水蒸汽反應,得到二氧化碳和氫氣。
然後將混和氣體在一定壓力下溶於水,二氧化碳被吸收,就制得了較純淨的氫氣。
同樣將水蒸汽與適量的空氣混和通過紅熱的炭,空氣中的氧和碳便生成一氧化碳和二氧化碳而被吸收除掉,從而得到了所需要的氮氣。


氮肥的生产和使用教学设计△组织学生实验测0.1mo l ·L -1NH 4Cl 溶液和0.1mo l ·L -1盐酸溶液的pH学生实验 解释:0.1mo l ·L -1NH 4Cl 溶液显弱酸性,NH 4Cl 中的NH 4+和水发生水解反响生成了H +,写出水解方程式。
师生共同小结铵态氮肥不能和草木灰混合使用的原因:讲述:当然,作物的生长除了需要氮、磷、钾三种元素外,还需要多种微量元素,在实际施肥时应该考虑多种肥料的合理使用。
氮肥的生产和使用大大提高了粮食的产量和质量,促进了社会的进步和开展。
课堂总结讲述:通过今天的学习,请你对本堂课的知识进行一个总结学生在学案上整理 让学生对所学知识进行自我消化,形成自己的感悟 交流知识小结,形成知识网络:学生展示小结鼓励学生参与课堂学习 渗透学法指导 请学生谈谈学习本节课的体会和感受学生交流鼓励学生发表观点,提高语言表达能力从情感态度价值观引导学生,综合表达教育的价值板书设计:一、氨的生产和使用N 2 + 3H 22NH 3 NH 3+ H 2O NH 3·H 2O 〔大局部〕NH 3·H 2O NH 4++OH - 〔小局部〕二、铵态氮肥的生产和使用1.形成------氨与酸反响NH 3+HCl=NH 4Cl 2NH 3+H 2SO 4 = (NH 4)2SO 4 2.保存------枯燥的阴凉处NH 4HCO 3= NH 3↑ + CO 2↑+ H 2O3.使用------不能与碱性肥料混合使用2NH 4Cl + Ca(OH) 2= CaCl 2 + 2NH 3↑+ 2H 2O H 2O H ++ OH - NH 4+ + H 2O NH 3·H 2O+ H + CO 32-+ H 2O HCO 3-+H -。
课题2 人工固氮技术-------合成氨教学目标1. 使学生理解如何应用化学反应速率和化学平衡原理,选择合成氨的适宜条件。
2.了解合成氨生产的一般流程和反应原理、反应条件等。
3.介绍合成氨,体现化工生产的过程,体现实验室研究与实际生产之间转化过程。
教学过程:一、氮的固定1、定义:氮的固定是指将游离态的氮转化为化合态氮的方法。
2、方法:氨的固定主要方法有:(1)人工合成氨:化学固氨法。
其条件要求高、成本高、转化率低、效率低。
(2)根瘤菌,生物固氨。
常温常压下进行。
成本低、转化率高、效率高。
3、工业应用: 模拟生物的功能,把生物的功能原理用于化学工业生产,借以改善现有的并创造崭新的化学工艺过程。
二、合成氨的反应原理【实验】分析P11的实验,结合有关物质的物理、化学性质总结试管口处湿润的PH 试纸的变化,推测有关反应。
【师生】1、加热试管中的铁丝绒至红热后注入氢气和氨气的混合气体,可以看到湿润的PH试纸变蓝色2.用氢气和氨气合成氨的反应式是N 2+3H 2 催化剂 高温高压 2NH 3 ,属放热反应。
3、工业上,采用以铁为主的催化剂,在400~500℃和10Mpa ~30 Mpa 的条件下合成氨。
【阅读】P12科学史话,结合已学化学平衡知识分析下面的问题(1)合成氨中,催化剂的主要作用是什么?答案:成千上万倍地加快化学反应速率,缩短达平衡的时间,提高日产量。
(2)合成氨的适宜条件是什么?答案:以铁为主的催化剂,在400~500℃和10Mpa ~30 Mpa 的条件(3)选择适宜生产条件的原则是什么?提示:有较高的反应速率和平衡转化率,能最大限度地提高利润。
(4)合成氨生产时,为什么不采用尽可能高的压强?通常采用10MPa~300MPa 的压强?提示:会增大设备的动力要求,增大成本。
(5)合成氨的反应为放热反应,降低温度会使平衡向右移动,但为什么温度要保持在400~500℃左右?答案:合成氨的反应为放热反应,降低温度促使平衡向有移动,有利于2N 、2H 转化为3NH ;但降温必然减缓了反应速率,影响单位时间产率。
高考化学课题2 人工固氮技术---合成氨相关素材一、哈伯和哈伯法合成氨19世纪以前,一些有远见的化学家指出:考虑到将来的粮食问题,为了使子孙后代免于饥饿,我们必须寄希望于科学家能实现大气固氮。
因此将空气中丰富的氮固定下来并转化为可被利用的形式,在20世纪初成为一项受到众多科学家注目和关切的重大课题。
哈伯就是从事合成氨的工艺条件试验和理论研究的化学家之一。
利用氮、氢为原料合成氨的工业化生产曾是一个较难的课题,从第一次实验室研制到工业化投产,约经历了150年的时间。
1795年有人试图在常压下进行氨合成,后来又有人在50个大气压下试验,结果都失败了。
19世纪下半叶,物理化学的巨大进展,使人们认识到由氮、氢合成氨的反应是可逆的,增加压力将使反应推向生成氨的方向:提高温度会将反应移向相反的方向,然而温度过低又使反应速度过小;催化剂对反应将产生重要影响。
这实际上就为合成氨的试验提供了理论指导。
当时物理化学的权威、德国的能斯特就明确指出:氮和氢在高压条件下是能够合成氨的,并提供了一些实验数据。
法国化学家勒夏特列第一个试图进行高压合成氨的实验,但是由于氮氢混和气中混进了氧气,引起了爆炸,使他放弃了这一危险的实验。
在物理化学研究领域有很好基础的哈伯决心攻克这一令人生畏的难题。
哈伯首先进行一系列实验,探索合成氨的最佳物理化学条件。
在实验中他所取得的某些数据与能斯特的有所不同,他并不盲从权威,而是依靠实验来检验,终于证实了能斯特的计算是错误的。
在一位来自英国的学生洛森诺的协助下,哈伯成功地设计出一套适合于高压实验的装置和合成氨的工艺流程,这流程是:在炽热的焦炭上方吹入水蒸汽,可以获得几乎等体积的一氧化碳和氢气的混和气体。
其中的一氧化碳在催化剂的作用下,进一步与水蒸汽反应,得到二氧化碳和氢气。
然后将混和气体在一定压力下溶于水,二氧化碳被吸收,就制得了较纯净的氢气。
同样将水蒸汽与适量的空气混和通过红热的炭,空气中的氧和碳便生成一氧化碳和二氧化碳而被吸收除掉,从而得到了所需要的氮气。
课题2 人工固氮技术——合成氨1.理解如何应用化学反应速率和化学平衡原理,选择合成氨的适宜条件。
2.了解合成氨生产的一般流程和反应原理、反应条件等。
3.通过合成氨的学习,体现化工生产的过程,体现实验室研究与实际生产之间转化过程。
氮的固定指的是将游离态氮转变为化合态氮的方法。
一、合成氨的反应原理1.如下图为合成氨的实验装置加热试管中的铁丝绒至红热后注入氢气和氮气的混合气体,可以看到湿润的pH试纸变蓝色。
2.用氢气和氮气合成氨的化学反应方程式是N2+3H2高温、高压催化剂2NH3,属放热反应。
3.工业上,采用以铁为主的催化剂,在400~500 ℃和10~30 MPa的条件下合成氨。
工业合成氨的反应特点是什么?提示:(1)体积减小的反应;(2)放热反应;(3)反应条件为高温、高压、催化剂。
二、合成氨的基本生产过程1.制备合成氨的原料气(1)制取N2:物理方法为将空气液化,蒸发分离出氧气。
化学方法为碳在空气中燃烧,O2充分反应后除去CO2制取氮气。
(2)制取H2:①用水蒸气通过赤热的煤层,使水蒸气与碳反应制得。
主要反应为 C+H2O===CO+H2。
②也可用石油、天然气、焦炉气、炼厂气中的碳氢化合物与水蒸气在催化剂作用下制备。
主要反应为CH4+H2O===3H2+CO,CH4+2H2O===4H2+CO2。
2.原料气净化处理(1)原料气净化的原因是有些杂质可使催化剂“中毒”。
(2)用稀氨水吸收H2S杂质:NH3·H2O+H2S===NH4HS+H2O。
(3)使CO变成CO2:CO+H2O===CO2+H2。
(4)除去CO2(用K2CO3溶液吸收):K2CO3+CO2+H2O===2KHCO3。
3.将原料气合成氨与分离从合成塔出来的混合气体,氨气占总体积的15%,要把混合气体通过冷凝器、分离器,再导入液氨贮罐。
三、合成氨工业的发展1.原料及原料气的净化原料气之一的氮气来自空气,目前氢气主要通过不同的固态(煤和焦炭)、液态(石油中提炼的石脑油、重油)、气态(天然气、焦炉气)可燃物为原料制取。
课题 2人工固氮技术---合成氨有关素材一、哈伯和哈伯法合成氨19世纪从前,一些有远见的化学家指出:考虑到未来的粮食问题,为了使后代后辈免于饥饿,我们一定寄希望于科学家能实现大气固氮。
所以将空气中丰富的氮固定下来并转变为可被利用的形式,在20 世纪初成为一项遇到众多科学家注视和关切的重要课题。
哈伯就是从事合成氨的工艺条件试验和理论研究的化学家之一。
利用氮、氢为原料合成氨的工业化生产曾是一个较难的课题,从第一次实验室研制到工业化投产,约经历了150 年的时间。
1795 年有人试图在常压下进行氨合成,以后又有人在50 个大气压下试验,结果都失败了。
19 世纪下半叶,物理化学的巨大进展,令人们认识到由氮、氢合成氨的反响是可逆的,增添压力将使反响推向生成氨的方向:提升温度会将反响移向相反的方向,但是温度过低又使反响速度过小;催化剂对反响将产生重要影响。
这实质上就为合成氨的试验供给了理论指导。
当时物理化学的威望、德国的能斯特就明确指出:氮和氢在高压条件下是能够合成氨的,并供给了一些实验数据。
法国化学家勒夏特列第一个试图进行高压合成氨的实验,可是因为氮氢混随和中混进了氧气,惹起了爆炸,使他放弃了这一危险的实验。
在物理化学研究领域有很好基础的哈伯信心攻陷这一令人生畏的难题。
哈伯第一进行一系列实验,探究合成氨的最正确物理化学条件。
在实验中他所获得的某些数据与能斯特的有所不一样,他其实不盲从威望,而是依赖实验来查验,终于证明了能斯特的计算是错误的。
在一位来自英国的学生洛森诺的辅助下,哈伯成功地设计出一套合适于高压实验的装置和合成氨的工艺流程,这流程是:在火热的焦炭上方吹入水蒸汽,能够获取几乎等体积的一氧化碳和氢气的混随和体。
此中的一氧化碳在催化剂的作用下,进一步与水蒸汽反响,获取二氧化碳和氢气。
而后将混随和体在必定压力下溶于水,二氧化碳被汲取,就制得了较纯净的氢气。
相同将水蒸汽与适当的空气混和经过红热的炭,空气中的氧和碳便生成一氧化碳和二氧化碳而被汲取除去,进而获取了所需要的氮气。
第一单元 走进化学工业课题二 人工固氮技术——合成氨
第1课时
教学目标
1.利用所学的化学反应速率和化学平衡理论解释合成氨中的相关问题;
2.了解合成氨的主要原理、原料、重要设备、流程和意义。
教学重点
利用所学的化学反应速率和化学平衡理论解释合成氨中的相关问题。
课时安排
2课时 教学过程
新课教学:
固氮反应: 叫“固氮反应”. 主要的固氮反应有:生物固氮、自然固氮、化学固氮和人工模拟生物固氮。
1、生物固氮:是一种主要的自然固氮反应,如植物在根瘤菌作用下直接吸收空气中的N 2转化为氨等,进一步合成氮白质。
2、自然固氮:如闪电产生的巨大电压,其电火花足可以击破氮分子的叁键,促使其与氧气反应生成NO.进而生成NO 2和HNO 3等。
3、化学固氮:合成氨反应;在放电条件下使氮气与氧气反应生成NO 等;氮气与镁反应生成氮化镁。
4、人工模拟生物固氮:通过化学方法,制备出类似生物“固氮菌”的物质,使空气中的氮气在常温常压下与水及二氧化碳等反应,转化为氨态氮或铵态氮,进而实现人工合成大量的蛋白质等,最终实现工厂化生产蛋白质食品。
对比思考:“固硫”反应的概念是:将废气中对空气造成污染的SO 2转化为固态含硫化合物。
如实验室用NaOH 溶液吸收多余的SO 2生成Na 2SO 3,硫酸工业中用氨水吸收SO 2生成亚硫酸铵,燃烧煤等产生的SO 2用Na 2SO 3溶液吸收生成NaHSO 3,在煤中加入一定比例的CaCO 3或CaO 使SO 2转化为CaSO 3。
一、应用化学反应速率和化学平衡移动原理,解释合成氨工业的适宜条件的选择理由
工业生产中既要考虑尽量增大反应物的转化率,充分利用原料,又要选择较快的反应速率,提高单位时间产率。
以上两点是选择反应条件的出发点。
当二者发生矛盾时,要结合具体情况辩证分析,找出最佳反应条件。
合成氨反应条件的选择原理: 选择根据 :N 2(g) + 3H 2(g)
2NH 3(g) △H=-92.4KJ·mol -1
1、 反应特点:
①N 2极不活泼,通常条件下反应难以进行 ②是一个气体体积缩小的反应 ③是一个放热反应 2、可供选择的条件:
反应条件 加快反应速率的措施 增大反应程度的措施 ①压强 高压 高压 ②温度 高温 降温 ③催化剂 铁触媒 ____ ④浓度 ______ 及时分离出氨 3、选择条件时综合考虑的因素: (1)合成氨反应的特点:
体积缩小、放热、可逆。
依据化学反应速率和化学平衡理论讨论合成氨的条件:
500℃左右 20~ 50Mpa
铁触媒
从化学平衡理论讨论学反应速率,越大越好
N 2(g) + 3H 2(g)
2NH 3(g) ; △H = -92.4KJ·mol -1
课外思考
为什么2SO 2+O 2
2SO 3,△H<0 反应中,工业上使用过量的空气?而合成氨工业生产中又不采
用一种反应物过量?
500℃左右 20~ 50Mpa
铁触媒。