2013年广东各地一模试题化学反应原理汇编
- 格式:doc
- 大小:1.54 MB
- 文档页数:17
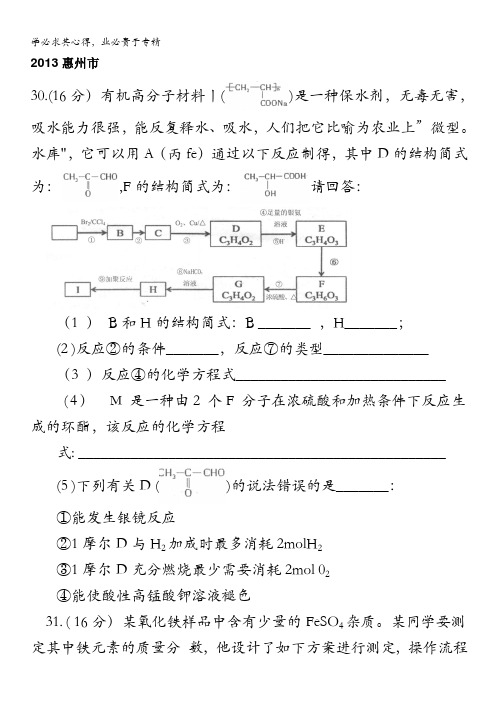
2013惠州市30.(16分)有机高分子材料丨()是一种保水剂,无毒无害,吸水能力很强,能反复释水、吸水,人们把它比喻为农业上”微型。
水库",它可以用A(丙fe)通过以下反应制得,其中D的结构简式为:,F的结构简式为:请回答:(1 )B和H的结构简式:B _______ ,H_______;(2 )反应②的条件_______,反应⑦的类型______________(3 )反应④的化学方程式____________________________(4)M是一种由2个F分子在浓硫酸和加热条件下反应生成的环酯,该反应的化学方程式: _________________________________________________(5 )下列有关D ()的说法错误的是_______:①能发生银镜反应②1摩尔D与H2加成时最多消耗2molH2③1摩尔D充分燃烧最少需要消耗2mol 02④能使酸性高锰酸钾溶液褪色31. ( 16分)某氧化铁样品中含有少量的FeSO4杂质。
某同学要测定其中铁元素的质量分数,他设计了如下方案进行测定,操作流程为:请根据流程回答:(1) 操作I中配制溶液时,所用到的玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管以外,坯必须有_______(填仪器名称)。
(2) 操作II中必须用到的仪器是_______:A。
50ml 量筒 B. 1OOml 量筒C. 50ml酸式滴定管D。
50ml碱式滴定管(3) 反应①中,加入足量H2O2溶液反应的离子方程式______________。
(4) 检验沉淀中SO42-是否冼涤干净的操作__________________________________________________________ __________________________________________________________ ________________________(5)将沉淀物加热,冷却至室温,用天平称量坩埚与加热后固体的总质量为h lg,再次加热并冷却至室温称量其质量为hg,若b1—b2=0.3,还应进行的操作是_________________________________________________(6)若坩埚的质量为42。

本试卷共10页,36小题,满分300分。
考试用时150分钟。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Al 27 S 32 Cl 35.5 Cu 63.5第I卷(选择题共36分)一、单项选择题:本大题共6小题,每小题4分,共24分。
在每小题给出的四个选项中,只有一个选项符合题目要求,选对的得4分,选错或不答的得0分。
7.下列说法正确的是()A.糖类化合物都具有相同的官能团B.酯类物质是形成水果香味的主要成分C.油脂的皂化反应生成脂肪酸和丙醇D.蛋白质的水解产物都含有羧基和羟基【答案】B【考点定位】本题考查考生对常见有机物的组成、结构、性质和变化及相互联系的了解,考查考生对官能团、有机物命名的了解。
涉及糖类化合物(如葡萄糖和果糖)官能团的异同、水果香味与酯类物质的关系、油脂皂化反应的产物、丙三醇和丙醇的差异、蛋白质的水解产物、氨基酸的官能团、羟基和氨基的差异等。
【名师点睛】本题考查的知识点是给出有机物名称判断有机物的化学性质,解题的关键是根据常见官能团的结构来判断有机物的性质,然后结合题意灵活运用,该题是高考中的常见题型,在注重对学生基础知识巩固与训练的同时,侧重对学生能力的培养与解题方法的指导和训练。
8.水溶液中能大量共存的一组离子是()A.Na+、Al3+、Cl-、CO32-B.H+、Na+、Fe2+、MnO4-C.K+、Ca2+、Cl-、NO3-D.K+、NH4+、OH-、SO42-【答案】C【考点定位】考查考生对离子反应的概念、氧化还原反应概念、离子反应发生条件的了解,以及对常见离子性质的掌握程度。
主要涉及Al3+的水解性、CO32-的水解性、MnO4-的强氧化性、Fe2+具有还原性、NH4+的水解性、NH3•H2O的弱碱性和不稳定性等。
【名师点睛】离子共存的正误判断是高考中的高频题,属于中等难度的试题,侧重对学生基础知识的训练和检验,提高学生灵活运用基础知识解决实际问题的能力,该题需要明确离子不能大量共存的一般情况,解决离子共存问题时还应该注意题目所隐含的条件,例如“可能”共存,还是“一定”共存等。

2013中山市一、单项选择题本题包括10小题,每小题2分,共20分,每小题只有一个选项符合题意 1.下列做法不能达到“低碳减排”目的的是 A.拉动内需,刺激消费 B.开发新能源,如太阳能、风能等,减少对化石能源的依赖 C.自备购物布袋,不用塑料方便袋 D.家庭废水再使用,城市污水处理循环利用 2.有关化学用语表达正确的是 A.聚丙烯的结构简式:CH2-CH2-CH2B.C1的结构示意图: C.和互为同位素D.过氧化氢电子式: 3.下列离子组能大量共存的是 A.Ba2+ Cl SO42- K+B.Mg2+ SO4- Na+ Cl- C.H+ CO3- Al3+ Cl-D.K+ Fe2+ NO H+ 4.下列离子方程式表达的反应事实正确的是: A.Fe3O4与稀硝酸反应:Fe3O4+8H+=2Fe3++Fe2++4H2O B.向硫酸铵溶液中加入氢氧化钡溶液:Ba2++SO4-=BaSO4↓ C.向碳酸钙中加入稀盐酸:CO3-+2H+=CO2↑+H2O D.向Ca(ClO)2溶液中通入过量二氧化碳:ClO-?+ H2O + CO2?=HClO + HCO3- 5.设NA为阿伏加德罗常数的值,下列判断正确的是 A.1 mol·L-1 FeCl3溶液,含有Fe3+的数目为NA个 B.标准状况下,224L辛烷中分子数目为NA C.01mol Fe与01mol Cl2充分反应,转移的电子数为03 NA个 D.氧气和臭氧组成的48g混合气体中含有03 NA个氧原子 6.下列说法正确的是 A.乙炔和苯均为不饱和烃,都只能发生加成反应 B.加新制的Cu(OH)2悬浊液并加热可检验尿液中的葡萄糖 C.油脂在酸的催化作用下可发生水解,工业上利用该反应生产肥皂 D.向蛋白质溶液中加入浓的Na2SO4或CuSO4溶液均可使蛋白质盐析而分离提纯 7.X、Y、Z、W均为短周期元素,在周期表中位置如图,Y原子的最外层电子数是其次 外层电子数的3倍。
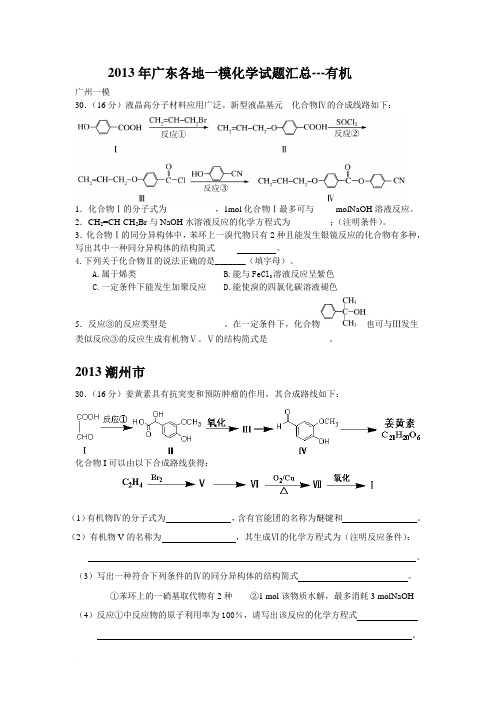
2013年广东各地一模化学试题汇总---有机广州一模30.(16分)液晶高分子材料应用广泛。
新型液晶基元---化合物Ⅳ的合成线路如下:1.化合物Ⅰ的分子式为__________ ,1mol化合物Ⅰ最多可与_____molNaOH溶液反应。
2.CH2=CH-CH2Br与NaOH水溶液反应的化学方程式为_________;(注明条件)。
3.化合物Ⅰ的同分异构体中,苯环上一溴代物只有2种且能发生银镜反应的化合物有多种,写出其中一种同分异构体的结构简式_____ 。
4.下列关于化合物Ⅱ的说法正确的是_______(填字母)。
A.属于烯类B.能与FeCl3溶液反应呈紫色C.一定条件下能发生加聚反应D.能使溴的四氯化碳溶液褪色5.反应③的反应类型是_____________。
在一定条件下,化合物也可与Ⅲ发生类似反应③的反应生成有机物Ⅴ。
Ⅴ的结构简式是______________。
2013潮州市30.(16分)姜黄素具有抗突变和预防肿瘤的作用,其合成路线如下:化合物I可以由以下合成路线获得:(1)有机物Ⅳ的分子式为,含有官能团的名称为醚键和。
(2)有机物V的名称为,其生成Ⅵ的化学方程式为(注明反应条件):。
(3)写出一种符合下列条件的Ⅳ的同分异构体的结构简式。
①苯环上的一硝基取代物有2种②1 mol该物质水解,最多消耗3 molNaOH (4)反应①中反应物的原子利用率为100%,请写出该反应的化学方程式。
2013年东莞30.(16分) 已知:止咳酮(V)具有止咳祛痰作用。
它能由化合物III合成:(1)化合物I的分子式为,化合物Ⅲ的含氧官能团的名称(写一种)。
(2)反应①的反应类型是,反应③的反应类型是。
(3)化合物II与足量H 2在一定条件下加成后的产物能与NaOH溶液反应,写出该反应方程式:。
(4)化合物II也能发生类似②反应得到一种常见的有机溶剂,该物质结构简式为。
(5)写出满足下列条件的IV的同分异构体的结构简式。

2013届广东各地一模试题有机化学汇编(广州)【广州答案】(深圳)30.(16分)有机合成中增长碳链是一个重要环节。
如下列反应:+Zn 苯(Ⅰ)CH 3Br-CH-COOC2H5(Ⅱ)CH-CH-COOC2H5CH 3OHCH 3-O用 通过以下路线可合成(Ⅱ):(1)(Ⅰ)的分子式为 ;(Ⅲ)的结构简式为 。
(2)(Ⅱ)与足量的热NaOH 溶液反应的化学方程式为 。
(3) 在生成(Ⅲ)时,还能得到另一种副产物C 6H 8O 4,该反应的化学方程式为 ,反应类型是 。
(4)(Ⅰ)的一种同分异构体能发生银镜反应,还能水解生成不含甲基的芳香化合物(Ⅳ)。
(Ⅳ)的结构简式为 。
【深圳答案】30、(16分)说明;所有的化学方程式或结构简式写成一般结构简式或键线式同样得分;化学方程式没有注明反应条件或条件错误扣1分,化学式错误和不配平0分,下同。
(1)C 8H 8O 2 (2分);CH 2=CH-COOH (3分)(2)或 (3分)(3) (3分) 取代反应(或酯化反应) (2分)(4) (3分)(番禺仲元中学等六校联合体)OHCH 3-CH -COOH OHCH 3-CH -COOH 浓H 2SO 4 △ OH CH 3-CH -COOH (Ⅲ)C 3H 4O 2 C 5H 8O 2C 2H 5OH /H + (Ⅱ) HBr一定条件下 CH 32H 5 + 2NaOHH 2O△OHCH 3-CH-COONa + C 2H 5OH + NaBr CH 3 2H 5+ 2H 2O NaOH△ OHCH 3-CH-COOH + C 2H 5OH + HBrOHCH 32 浓H 2SO 4 △ CH 3-CHCH-CH 3 O —CO C —O + 2H 2O CH 2OH30.(16分)黄酮醋酸(F )具有独特抗癌活性,它的合成路线如下:已知:RCN 在酸性条件下发生水解反应:(1)已知A 转化为B 的同时还生成了乙酸,则A 的结构简式为 ,该反应类型是 。

2013潮州市 7.下列说法不正确的是 A.氯乙烯、聚乙烯、苯乙烯都是不饱和烃 B.蛋白质溶液中加入浓的硫酸铵溶液会有沉淀析出 C.苯能与溴在一定条件下发生取代反应 D.淀粉和纤维素水解的最终产物都是葡萄糖 8.下列无色溶液中的离子能大量共存的是 A.K+、Na+、MnO4-、SO42- B.H+、K+、NO3-、SO32- C.Na+、Ba2+、Cl-、Br- D.Fe3+、NH4+、SCN-、HCO3- 9.X、Y、Z、W为四种短周期主族元素,它们在周期表中的位置如下图所示。
Z元素原子核外K层与M层电子数相等。
下列说法中正确的 ZWA.Y元素最高价氧化物对应的水化物化学式为H3YO4 B.原子半径由小到大的顺序为:X<Z<Y<W C.与同浓度的盐酸反应,Z比W更剧烈 D.X的氧化物不能与Z单质反应 .NA阿伏加德罗常数下列叙述正确的是 A.22.4L NH3中含氮原子数为 NA B.1 mol Na2O2与水完全反应时转移电子数为NA C.1 L 0.1mol·L-1碳酸钠溶液阴离子总数0.1 NA D.1 mol O2和2 mol SO2在密闭容器中充分反应分子数等于2NA 下列有关化学反应过程的叙述中,的是 A.B.CO2中的少量SO2:通过盛有饱和NaHCO3溶液的洗气瓶 C.漂白粉和明矾都常用于自来水的处理,二者的作用原理是相同的 D.下列有关实验现象和解释或结论都正确的是选项实验操作现象解释或结论A把SO2通入紫色石蕊试液中紫色褪去SO2具有漂白性B把浓硫酸滴到pH试纸上试纸变红浓硫酸具有酸性C将NO2的密闭玻璃球浸泡在热水中红棕色变浅反应2NO2N2O4的△Hc(CH3COO-)>c(H+)>c(OH-) D.常温下,将pH=2的盐酸和pH=12的氨水等体积混合后: c(NH4+)>c(Cl-)> c(OH-)>c(H+) C.制NH3 碱石灰 NH4Cl固体 D.分离沸点不同且互溶的液体混合物 冷凝水 温度计 B.比较的热稳定性 澄 清 石灰水 NaHCO3 Na2CO3 NaOH溶液 煤油 FeSO4溶液 A.制。
2013年广东各地一模化学试题汇总---有机答案广州一模30.(16分)(1)C7H6O3(2分); 2 (2分)(2)CH2=CH-CH2Br + NaOH CH2=CH-CH2OH +NaBr (2分)(3)以下其中一种即可:(3分)OOH C-HO、OHCHOOH、OHOHCHO(4)CD (2分)(5)取代(2分);CH2CH CH2O OOCCH3CH3C(3分)2013潮州市30.(16分)(1)C8H8O3(2分),(酚)羟基、醛基(2分,下面每空3分)(2)1,2—二溴乙烷,(3(4)2013年东莞30.(16分)(1)C8H9Br(2分)羰基或酯基(任写一种)(2分)(2)取代反应(2分)加成反应(2分)(3)(3分)(4)(3分)(5)CH3COCH3(2分,写“CH3CH2OH”也给分)Δ2013佛山一模2013年惠州2013茂名市30.(16分)(1)41010O H C ………(2分) (2)……(每空3分,共6分)(3)缩聚反应 …(2分)(4) ……(3分)(5) ……(3分)CC O OONa+ CH CH 2013汕头市期末30.(16分,每空各2分)(1)对苯二甲酸;; (2)HX ;(3); (4)取代(或取代反应);可溶于水;(5)在对苄基氧化时保护苯环侧链烃基(1分);同时,使苄基在反应中既不会被彻底氧化,汕(1)C (2)201330(1)(2) (3)①写错反应物或生成物的其中一个,扣3分,即0分; ②配平错误的,扣1分; ③“→”写成“=”不扣分;④书写苯环的正六边形时,键若有明显的突出,扣1分。
(4)或其他合理答案(2分)(5)2CH 3CHCH 2OH+O 2→2CH 3CHCHO +2H 2O (2分) 氧化(2分)肇庆期末30.(15分)(1)(3分) CH 3CHO (2分) (2)(4分)取代反应(2分) (2分) (3)(2分,化学式1分,反应条件和配平1分)OHOCHO ∣ CH 3 ∣CH 3△Cu(4)(4分)a b (选1个且正确,给2分,错1个0分) (5)(2分)三 肇庆一模(2013-3) 30.(15分)(1)(共2分) C 12H 10O 4 (2)(共3分)或(3)(共3分)(4)(共2分)B (说明:间位和对位2种;羟基与醛基合并,形成苯甲酸和甲酸苯酚酯2种)(5)(共5分)N(2分)(3分)或:2013中山期末15.(14分)(每空2分)1、CH 3CHO ;CH 3CH=CHCHO2、羟基、醛基 3、氧化反应,消去反应(漏“反应”扣1分) 4、CH 3-CH-COOH5、2CH 3CH 2CH 2CH 2OH+COOHCOOH--+2H 2ON+HNO 3NNO 2+H 2ONHO NO 2+NNO 2+H 2OCHO OH+ 2Ag(NH 3)2443 +H 2OCHO OH+ 2Ag(NH 3)243 +H 2OCH CCOONaCOONaONaCH 32013珠海一模2013韶关一模 30.(16分)(1)醛基; CH 2OHCH 2OH (各2分); (2)3; C (各2分); (3)+2NaOH+2NaBr+2H 2O (3分)(4)加成反应; 酯化(取代)反应 (各1分); (5)(各1分,共3分)深圳一模30、(16分)说明;所有的化学方程式或结构简式写成一般结构简式或键线式同样得分;化学方程式没有注明反应条件或条件错误扣1分,化学式错误和不配平0分,下同。
2013年广东各地一模化学试题汇总——有机大题2013潮州市30.(16分)姜黄素具有抗突变和预防肿瘤的作用,其合成路线如下:化合物I可以由以下合成路线获得:(1)有机物Ⅳ的分子式为,含有官能团的名称为醚键和。
(2)有机物V的名称为,其生成Ⅵ的化学方程式为(注明反应条件):。
(3)写出一种符合下列条件的Ⅳ的同分异构体的结构简式。
①苯环上的一硝基取代物有2种②1 mol该物质水解,最多消耗3 molNaOH(4)反应①中反应物的原子利用率为100%,请写出该反应的化学方程式。
2013东莞市30.(16分) 已知:止咳酮(V)具有止咳祛痰作用。
它能由化合物III合成:(1)化合物I的分子式为,化合物Ⅲ的含氧官能团的名称(写一种)。
(2)反应①的反应类型是,反应③的反应类型是。
(3)化合物II与足量H 2在一定条件下加成后的产物能与NaOH溶液反应,写出该反应方程式:。
(4)化合物II也能发生类似②反应得到一种常见的有机溶剂,该物质结构简式为(5)写出满足下列条件的IV的同分异构体的结构简式。
①苯环上只有两个处于对位的代基;②能发生银镜反应;③核磁共振氢谱有四组吸收峰2013佛山市30.(16分)Knoevenagel反应是有机合成中的一种常见反应:化合物Ⅱ可以由以下合成线路获得:(1)化合物 I的分子式为。
(2)已知 1 mo1化合物Ⅲ可以与 2 mo1Na发生反应,且化合物Ⅲ在 Cu催化下与 O2反应的产物可以与新制的Cu(OH)2反应,则Ⅲ的结构简式为。
(3)化合物Ⅳ与NaOH醇溶液反应的化学方程式为。
Ⅳ与 CH30H生成Ⅱ的反应类型为。
应,则其生成物的结构简式为。
(5)化合物 V的一种同分异构体VI含有苯环,能发生银镜反应,同时也能发生水解,请写出一种Ⅵ的结构简式。
2013惠州市30.(16分)有机高分子材料丨()是一种保水剂,无毒无害,吸水能力很强,能反复释水、吸水,人们把它比喻为农业上"微型.水库",它可以用A(丙fe)通过以下反应制得,其中D的结构简式为:,F的结构简式为:请回答:(1 ) B和H的结构简式:B _______,H_______;(2 )反应②的条件_______,反应⑦的类型______________(3 )反应④的化学方程式____________________________(4)M是一种由2个F分子在浓硫酸和加热条件下反应生成的环酯,该反应的化学方程式: _________________________________________________(5 )下列有关D ()的说法错误的是_______:①能发生银镜反应②1摩尔D与H2加成时最多消耗2molH2③1摩尔D充分燃烧最少需要消耗2mol 02④能使酸性高锰酸钾溶液褪色2013茂名市30.(16分)共聚酯(PETG)有着优异的光泽度、透光率和可回收再利用等特点,广泛应用于医疗用品、日常消费品和化妆品包装等行业。
2013年广东各地一模化学试题汇总2(实验题)2013潮州市33.(16分)NaCl 和NaClO 在酸性条件下可发生反应:ClO - + Cl - + 2H += Cl 2↑+ H 2O , 某学习小组拟研究消毒液(主要成分为NaCl 和NaClO)的变质情况。
(1)此消毒液中NaClO 可吸收空气中的CO 2生成NaHCO 3和HClO 而变质。
写出化学反应方程 。
(2)取适量消毒液放在试管中,加入足量一定浓度的硫酸,有气体放出。
通过以下装置检限选试剂:98%浓硫酸、1%品红溶液、1.0 mol ·L -1KI-淀粉溶液、1.0 mol ·L -1NaOH 、澄清石灰水、饱和NaCl 溶液 请完成下列实验方案。
(3)用滴定法测定消毒液中NaClO 的浓度。
实验步骤如下:①量取 25.00mL 消毒液放入锥形瓶中,加入过量的a mol ·L -1Na 2SO 3溶液b mL ;②滴定分析。
将c mol ·L -1的酸性KMnO 4溶液装入 (填酸式或碱式)滴定管中;KMnO 4和剩余的Na 2SO 3发生反应。
当溶液由无色变成浅红色,且保持半分钟内红色不退时,停止滴定,记录数据。
重复滴定实验2次,平均消耗酸性KMnO 4溶液v mL ; 滴定过程中涉及的反应有:NaClO + Na 2SO 3 = NaCl+ Na 2SO 4 ; 2KMnO 4 + 5Na 2SO 3+ 3H 2SO 4 = K 2SO 4 + 2MnSO 4 + 5Na 2SO 4 + 3H 2O③计算。
消毒液中NaClO 的浓度为 mol ·L -1(用含a 、b 、c 、v 的代数式表示)。
答案:(1)NaClO + CO 2 + H 2O = NaHCO 3 + HClO (3分) (2)(共8分)气体→2013东莞市33. (16分)发酵粉是一种化学膨松剂,可由小苏打、臭粉(碳酸氢铵)、明矾中的两种物质组成。
2013年广东各地一模试题化学反应原理汇编(广州)(深圳)31.(16分)CH4(g)+2NO2(g )N2(g)+CO2(g)+2H2O(g);ΔH=-867 kJ·mol-1。
该反应可用于消除氮氧化物的污染。
在130℃和180℃时,分别将0.50 molCH4和a molNO2充入1L的密闭容器中发生反应,测得有关数据如下表:(1)开展实验1和实验2的目的是。
(2)180℃时,反应到40min,体系(填“是”或“否”)达到平衡状态,理由是;CH4的平衡转化率为。
(3)已知130℃时该反应的化学平衡常数为6.4,试计算a的值。
(写出计算过程)μ(NO2)(4)一定条件下,反应时间t 与转化率μ(NO 2)的关系如图所示,请在图像中画出180℃时,压强为P 2(设压强P 2>P 1)的变化曲线,并做必要的标注。
(5)根据已知求算:ΔH 2= 。
CH 4(g )+ 4NO 2(g )4NO (g )+ CO 2(g )+ 2H 2O(g ); ΔH 1= -574 kJ·mol -1CH 4(g )+ 4NO (g )2N 2(g )+ CO 2(g )+ 2H 2O (g );ΔH 2(番禺仲元中学等六校联考) 31.(16分)请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)工业上一般以CO 和H 2为原料合成甲醇,在恒容容器中,该反应的热化学方程式为:CO(g)+2H2(g)CH 3OH(g) △H 1=-116 kJ·mol -1①下列措施中能说明反应达到平衡状态的是____________。
(填编号) A .体系压强保持不变 B .混合气体的密度保持不变C .CO 与H 2的浓度之比为1:2D .单位时间内,消耗2mol H 2的同时消耗1 molCH 3OH ②在恒容容器中合成甲醇,当温度分别为230℃、 250℃和270℃时,CO 的转化率与n (H 2)/n (CO)的 起始组成比的关系如右图所示。
已知容器体积1L , 起始时CO 的物质的量均为1mol 。
据此判断在上述 三种温度中,曲线Z 对应的温度是 ; 利用图中a 点对应的数据,计算该反应在对应温度 下的平衡常数K (写出计算过程)③在答题卡相应位置上画出:上述反应达到平衡后,减小体系压强至达到新的平衡过程中, 正逆反应速率与时间的变化关系图并标注。
(2)已知:(g)CO )g (O 21CO(g)22=+△H 2=-283 kJ·mol -1O(g)H (g)O 21(g)H 222=+△H 3=-242 kJ·mol -1则表示1mol 气态甲醇完全燃烧生成CO 2和水蒸气的热化学方程式为 。
(珠海)31.(6分)(1)将不同量的CO(g)和H2O(g)分别通入体积2L的恒容密闭容器中,进行反应,得到如下两组数据:①实验1中以v(CO2)表示的反应速率为(第二位小数)②该反应为(填“吸热”或“放热”)反应。
③求实验2的平常常数K,要求写出计算过程,结果取二位小数(2)已知在常温常压下:写出甲醇不完全燃烧生成CO和液态水的热化学方程式(3)甲醇和氧气完全燃烧的反应可以设计为燃料电池,装置如图,该电池通过K2CO3溶液吸收反应生的CO2。
则负极的电极反应为。
(4)CaCO3的K SP=2.8×10-9。
将等体积CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mol/L,则生成沉淀所需该CaCl2溶液的最小浓度为。
(佛山)31.(17分 )(1)常温下,将 2种一元酸分别和NaOH溶液等体积混合,实验数据如下:①甲组实验中混合溶液中离子浓度由大到小顺序为,由水电离出的 c(OH-)= mol/L。
②乙组实验中HY为强酸,则 HY溶液的c1 (填“<”,“=”或“>”)0.1mol/L。
(2)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。
某研究小组在实验室以Ag-ZSM-5为催化剂,测得NO转化为N2的转化率随温度变化情况和n (NO)/n(CO)比例变化情况如下图。
②用 CxHy(烃)催化还原NOx也可消除氮氧化物生成无污染的物质。
CH4与 NO发生反应的化学方程式为。
(3)工业上一般在恒容密闭容器中采用下列反应合成甲醇:下表所列数据是该反应在不同温度下的化学平衡常数 (Κ)。
①由表中数据判断ΔH 0 (填“>”、“=”或“<”)。
②某温度下,将 2mol CO和 6mol H2 充入2L的密闭容器中,充分反应 10min后 ,达到平衡时测得c(CO)=0.2mol/L,则此时的温度为℃。
③请在下列坐标中的画出②中求得温度下CO、 H2和 CH30H的浓度随时间变化的曲线,并进行适当的标注。
(汕头)31.(16分)为减小CO2对环境的影响,在限制其排放量的同时,应加强对CO2创新利用的研究。
(1)①把含有较高浓度CO2的空气通入饱和K2CO3溶液。
②在①的吸收液中通高温水蒸气得到高浓度的CO2气体。
写出②中反应的化学方程式。
(2)如将CO2与H2以1:3的体积比混合。
①适当条件下合成某烃和水,该烃是(填序号)。
A.烷烃B.烯烃C.炔烃D.苯的同系物②适当条件下合成燃料甲醇和水。
在体积为2L的密闭容器中,充入 2 mol CO2和6 mol H2,一定条件下发生反应:CO2(g)+3H2OH(g)+H2O(g) △H=-49.0 kJ/mol。
测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
=;能使平衡体系中n(CH3OH)增大的措施有。
(3)如将CO2与H2以1:4的体积比混合,在适当的条件下可制得CH4。
已知:CH4(g) + 2O2(g) CO2(g)+ 2H2O(l) ΔH1=―890.3kJ/molH2(g) + 1/2O2(g) H2O(l) ΔH2=-285.8 kJ/mol则CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式是。
(4)某同学用沉淀法测定含有较高浓度CO2的空气中CO2的含量,经查得一些物质在20℃的数据如下表。
(说明:K sp越小,表示该物质在水溶液中越易沉淀)吸收CO2最合适的试剂是(填“Ca(OH)2”或“Ba(OH)2”)溶液,实验时除需要测定工业废气的体积(折算成标准状况)外,还需要测定。
(东莞)31. (16分)I.高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3(s) + 3CO(g) 2Fe(s)+3CO2△H( 1 )已知:①Fe2O3(s) + 3C(石墨)=2Fe(s) + 3CO(g) △H1②C(石墨)+ CO2(g) = 2CO(g)则△H___________________(用含△H1 、△H2代数式表示)( 2 )高炉炼铁反应的平衡常数表达式K=____________________________。
( 3 )在℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
①甲容器中CO的平衡转化率为_______________________。
②下列说法正确的是____________________(填编号)。
A .若容器压强恒定,反应达到平衡状态 B .若容器内气体密度恒定,反应达到平衡状态 C .甲容器中CO 的平衡转化率大于乙的 D .增加Fe 2O 3就能提高CO 的转化率II .纳米MgO 可用尿素与氯化镁合成。
某小组研究该反应在温度为378~398K 时的反应时间、反应物配比等因素对其产率的影响。
请完成以下实验设计表:(揭阳) 31.(16分)Ⅰ.工业上可用CO 生产燃料甲醇。
一定条件下发生反应:CO(g)+2H2(g)CH3OH(g)(1)“图1”表示反应中能量的变化,曲线 (填:a 或b ) 表示使用了催化剂;该反应的热化学方程式为 。
(2)若容器容积不变,下列措施可增大CO 转化率的是_____。
A .升高温度B .将CH3OH(g)从体系中分离C .充入He ,使体系总压强增大D .再充入1 mol CO 和2 mol H2(3)其他条件不变,请在“图2”中画出温度为T2(且T2<T1)时,CO 的平衡转化率与H2和CO 的起始组成比[n(H2)/n(CO) ]的关系曲线。
Ⅱ.向BaSO4沉淀中加入饱和碳酸钠溶液,充分搅拌,弃去上层清液,如此处理多次,可使BaSO4全部转化为BaCO3,发生的反应可表示为: BaSO4(s) + CO32-(aq) BaCO3(s) + SO42-(aq)。
(4)现有0.20 mol BaSO4,加入1.0L 2.0mol/L 的饱和Na2CO3溶液处理,假设起始的c(SO42-)≈0,平衡时,K=4.0×10-2,求达到平衡时发生转化的BaSO4的物质的量。
(写出计算过程,计算结果保留2位有效数字)右图为温度对纳米Mgo 产率(曲线a )和粒径(曲线 b)的影响,请归纳出温度对纳米MgO 制备的影响 (写出一条): ___________________________________________(肇庆)31、(16分)消除汽车尾气是减少城市空气污染的热点研究课题。
(1)汽车内燃机工作时发生的反应N 2(g) + O 2(g)2NO(g),生成的NO 是汽车尾气的主要污染物。
T ℃时,向5L 密闭容器中充入6.5 mol N 2和7.5 mol O 2,在5 min 时反应达到平衡状态,此时容器中NO 的物质的量是5 mol (不考虑后续反应)。
则:①5 min 内该反应的平均速率ν(NO) = ;在T ℃时,该反应的平衡常数: K = 。
② 反应开始至达到平衡的过程中,容器中下列各项发生变化的是 (填序号)。
a. 混合气体的密度b. 混合气体的压强c. 正反应速率d. 单位时间内,N 2和NO 的消耗量之比(2)用H 2或CO 催化还原NO 可以达到消除污染的目的。
已知:2NO(g) =N 2(g) + O 2(g) ∆H = —180.5 kJ·mol -12H 2O(l) =2H 2(g) + O 2(g) ∆H = +571.6 kJ·mol -1则H 2(g)与NO(g)反应生成N 2(g)和H 2O(l)的热化学方程式是 。
(3)当质量一定时,增大固体催化剂的表面积可提高化学反应速率。
右下图表示在其他条件不变时,反应2NO(g) + 2CO(g) 2CO 2(g) + N 2(g)中,NO 的浓度[c (NO)]随温度(T )、催化剂表面积(S )和时间(t )的变化曲线。