锂离子扣式电池制作及其电化学容量充放电曲线的测定
- 格式:doc
- 大小:42.50 KB
- 文档页数:2


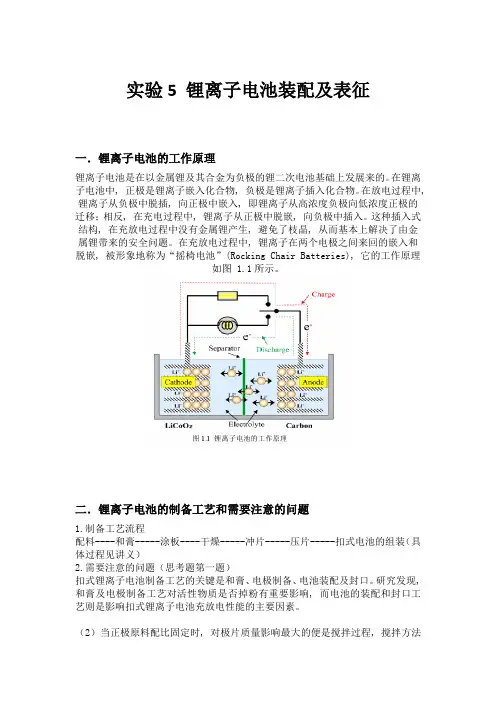
实验5 锂离子电池装配及表征一.锂离子电池的工作原理锂离子电池是在以金属锂及其合金为负极的锂二次电池基础上发展来的。
在锂离子电池中, 正极是锂离子嵌入化合物, 负极是锂离子插入化合物。
在放电过程中, 锂离子从负极中脱插, 向正极中嵌入, 即锂离子从高浓度负极向低浓度正极的迁移;相反, 在充电过程中, 锂离子从正极中脱嵌, 向负极中插入。
这种插入式结构, 在充放电过程中没有金属锂产生, 避免了枝晶, 从而基本上解决了由金属锂带来的安全问题。
在充放电过程中, 锂离子在两个电极之间来回的嵌入和脱嵌, 被形象地称为“摇椅电池”(Rocking Chair Batteries), 它的工作原理如图 1.1所示。
二.锂离子电池的制备工艺和需要注意的问题1.制备工艺流程配料----和膏-----涂板----干燥-----冲片-----压片-----扣式电池的组装(具体过程见讲义)2.需要注意的问题(思考题第一题)扣式锂离子电池制备工艺的关键是和膏、电极制备、电池装配及封口。
研究发现, 和膏及电极制备工艺对活性物质是否掉粉有重要影响, 而电池的装配和封口工艺则是影响扣式锂离子电池充放电性能的主要因素。
(2)当正极原料配比固定时, 对极片质量影响最大的便是搅拌过程, 搅拌方法选择不好将会导致极片的导电性降低和极片掉粉, 极片掉粉将会直接影响电池容量等。
搅拌方式有超声波搅拌、磁力搅拌、强力搅拌以及手工研磨。
经研究发现采用强力搅拌和超声波搅拌得到的极片质量最好, 而在本实验中我们使用的搅拌效果最差的手工研磨, 这很难得到好的结果。
所以在和膏时要注意搅拌方式的选择。
(3)干燥温度和时间选择不适也会导致极片掉粉, 干燥的目的是为了除去膏体中大量的溶剂NMP 以及在配膏过程中吸收到的水分, 温度和时间都应选择合适。
压片时压力要选择适中, 压片的目的主要有两个: 一是为了消除毛刺, 使极片表面光滑、平整, 防止装配电池时毛刺穿透隔膜引起短路; 二是增强膏和集流体的强度, 减小欧姆电阻。

实验一:锂离子电池制备及性能测试实验学时:6实验类型:综合实验要求:必修一、实验目的(1)了解锂离子二次电池的工作原理;(2)了解电解质溶液的导电机理和锂离子电池电极材料的合成方法;(3)掌握扣式锂离子电池电极的制备工艺及电池的装配过程;(4)掌握锂离子电池电性能测试方法。
二、实验内容扣式锂离子电池电极的制备工艺及电池的装配过程和扣式锂离子电池电化学性能测试。
三、实验原理、方法和手段液态锂离子二次电池通常采用层状复合氧化物为正极,人造石墨或者天然石墨为负极,充放电过程中通过锂离子的移动实现。
以商品化的液态电解质锂离子电池为例,如下图1- 1,正极材料和负极材料分别为LiFePO4和石墨,以LiPF6- EC-DEC为电解液,其电池工作原理如下:锂离子电池实质上是一种锂离子浓差电池,正负电极由两种不同的锂离子嵌入化合物组成。
正极材料是一种嵌锂式化合物,在外界电场作用下化合物中的Li 从晶体中脱出和嵌入。
当电池充电时,Li+离子从正极嵌锂化合物中脱出,经过电解质溶液嵌入负极化合物晶格中,正极活性物处于贫锂状态;电池放电时,Li+则从负极化合物中脱出,经过电解质溶液再嵌入正极化合物中,正极活性物为富锂状态。
为保持电荷平衡,充放电过程中应有相同数量的电子经外电路传递,与Li+一起在正、负极之间来回迁移,使正、负极发生相应的氧化还原反应,保持一定的电位。
工作电位与构成正、负极的可嵌锂化合物的化学性质、Li+离子浓度等有关。
在正常充放电过程中,负极材料的化学结构不变。
因此,从充放电反应的可逆性看,锂离子电池反应是一种理想的可逆反应。
锂离子电池在工作电位与构成电极的插入化合物的化学性质、Li+的浓度有关。
充电:LiFePO4 - xLi+ - xe- →xFePO4 + (1-x)LiFePO4放电:FePO4 + xLi+ + xe- →xLiFePO4 + (1-x)FePO4图1- 1. 锂离子电池工作原理,LiFePO4为正极,石墨为负极.研究表明,Li+的脱嵌过程是一个两相反应,存在着LiFePO4和FePO4两相的转化,充电时,铁离子从FeO6层面间迁移出来,经过电解液进入负极,发生Fe2+→Fe3+的氧化反应,为保持电荷平衡,电子从外电路到达负极。

实验三锂离子电池的装配及其电化学性能测试一、实验目的1.了解扣式锂离子电池的装备过程;2.了解锂离子电池的工作原理。
二、实验原理1.锂离子电池的工作原理锂离子电池和所有的化学电源一样,主要是由正极、负极和电解质三部分组成,还包括电池壳、隔膜、正负极引线等。
锂离子电池对这些基础材料有一定的要求:正极材料要有高的开路电压,循环寿命长,比能量大;隔膜要求有一定的离子穿透性,允许锂离子通过,且有很好的耐氧化性和隔极阻止性等;负极材料也是要求比能量大,安全性好,能够进行快速的充放电;电解液要满足锂离子电导率高,电化学性能稳定,制备容易等。
锂离子电池实际上是锂的浓差电池,其原理为:在充放电过程中,Li+在正、负极的嵌入化合物中嵌入和脱嵌。
其正极材料为LiMO2(M为过渡金属),LiMn2O4或者钒的氧化物,负极材料一般用接近金属锂电池的C等可逆脱嵌锂材料,而电解液主要为无水有机溶剂。
充电时,Li+从正极脱嵌经过电解质嵌入负极,此时负极处于富锂态,正极处于贫锂态;放电时则相反,Li+从负极脱嵌,经过电解质嵌入正极,正极处于富锂态,负极处于贫锂态。
锂离子电池的工作电压与构成电极的锂离子嵌入化合物本身及锂离子的浓度有关。
因此,在充放电循环时,Li+分别在正负极上发生“嵌入-脱嵌”反应,Li+便在正负极之间来回移动,所以,人们又形象地把锂离子电池称为“摇椅电池”或“摇摆电池”。
锂离子电池表达式: (-)C n︱electrolyte︱LiM2O4(+)具体反应如下:正极反应:LiM2O4Li(1-x) M2O4 + xLi+ + xe-负极反应:nC+ xLi+ + xe- Li x C n电池反应:Li M2O4 + nC Li(1-x) M2O4 + Li x C n 2.电池的组装使用模拟纽扣电池能够方便的测试电极材料的比容量和循环性能。
其结构及装配顺序如图2.2所示。
首先将制成的正极片在120℃的真空干燥箱中干燥12h 后作为电池的正极,以锂片作为负极,聚丙烯微孔膜Celgard2032为隔膜,泡沫镍为集电器,1mol/L LiPF6的EC+DMC(体积比1:1)为电解液,在充满氩气(氧含量和水含量均小于1ppm)的真空手套操作箱中组装成LIR2025模拟纽扣电池。

锂离子电池最常用的性能测试-放电曲线分析攻略(8000字长文)锂离子电池放电时,它的工作电压总是随着时间的延续而不断发生变化,用电池的工作电压做纵坐标,放电时间,或容量,或荷电状态(SOC),或放电深度(DOD)做横坐标,绘制而成的曲线称为放电曲线。
要认识电池的放电特性曲线,首先需要从原理上理解电池的电压。
【电池的电压】电极反应要形成电池必须满足以下条件:化学反应中失去电子的过程(即氧化过程)和得到电子的过程(即还原反应过程)必须分隔在两个不同区域中进行,这区别于一般的氧化还原反应;两电极的活性物质进行氧化还原反应时所需的电子必须由外电路传递,这区别于金属腐蚀过程的微电池反应。
电池的电压是正极与负极之间的电势差,具体的关键参数包括开路电压、工作电压、充放电截止电压等。
【锂离子电池材料的电极电位】电极电位是指固体材料浸于电解质溶液中,显示出电的效应,即金属的表面与溶液间产生的电位差,这种电位差称为金属在此溶液中的电位或电极电位。
简单说电极电位是表示某种离子或原子获得电子而被还原的趋势。
因此,对某种正极或负极材料来说,当处于有锂盐的电解质中时,其电极电位表示成:其中,φc即是这种物质表现出来的电极电位。
标准氢电极电势被规定为0.0V。
【电池的开路电压】电池电动势是根据电池反应,应用热力学方法进行计算的理论值,即电池在断路时处于可逆平衡状态下,正负极之间的平衡电极电势之差,是电池可以给出电压的极大值。
而实际上,正负极在电解液中并不一定处于热力学平衡状态,即电池的正负极在电解质溶液中所建立的电极电势通常并非平衡电极电势,因此电池的开路电压一般均小于它的电动势。
对于电极反应:考虑反应物组分的非标准状态以及活性组分的活度(或浓度)随时间的变化,采用能斯特方程修正电池实际开路电压:其中,R是气体常数,T是反应温度,a是组分活度或浓度。
电池的开路电压取决于电池正负极材料的性质、电解质和温度条件等,而与电池的几何结构和尺寸大小无关。

锂离子电池的制备合成及性能测定实验报告范文实验二锂离子电池的制备合成及性能测定一.实验目的1.熟悉锂离子电极材料的制备方法,掌握锂离子电极材料工艺路线;2.掌握锂离子电池组装的基本方法;3.掌握锂离子电极材料相关性能的测定方法及原理;4.熟悉相关性能测试结果的分析。
二.实验原理锂离子电池的结构与工作原理:所谓锂离子电池是指分别用二个能可逆地嵌入与脱嵌锂离子的化合物作为正负极构成的二次电池。
人们将这种靠锂离子在正负极之间的转移来完成电池充放电工作的,独特机理的锂离子电池形象地称为“摇椅式电池”,俗称“锂电”。
以LiCoO2为例:⑴电池充电时,锂离子从正极中脱嵌,在负极中嵌入,放电时反之。
这就需要一个电极在组装前处于嵌锂状态,一般选择相对锂而言电位大于3V且在空气中稳定的嵌锂过渡金属氧化物做正极,如LiCoO2、LiNiO2、LiMn2O4、LiFePO4。
⑵为负极的材料则选择电位尽可能接近锂电位的可嵌入锂化合物,如各种碳材料包括天然石墨、合成石墨、碳纤维、中间相小球碳素等和金属氧化物,包括SnO、SnO2、锡复合氧化物SnB某PyOz(某=0.4~0.6,y=0.6~0.4,z=(2+3某+5y)/2)等。
三.实验装置及材料1.实验装置:恒温槽,冰箱,搅拌器,管式电阻炉,真空干燥箱,鼓风干燥箱,铁夹,分液漏斗,研钵,烧杯,pH试纸,循环水真空泵,漏斗,抽滤瓶,滤纸,玻璃皿,温度计;2.实验材料:乙醇,醋酸镍,醋酸钴,醋酸锰,碳酸钠,去离子水,氨水,乙炔黑,PVDF,NMP,LiOH;四.实验内容及步骤1.样品的制备及准备碳酸盐共沉淀法制备LiNi1/3Co1/3Mn1/3O2:分别称取摩尔比为1:1:1的醋酸镍(Ni(CH3COO)2·4H2O)、醋酸钴(Co(CH3COO)2·4H2O)、醋酸锰(Mn(CH3COO)2·4H2O),用去离子水溶解,溶液金属离子总浓度为1mol·L-1。

锂离子扣式电池制作及其电化学容量充放电曲线的测定一 实验目的1. 制作锂离子扣式电池,并测定其电化学容量。
2. 掌握电池容量测量的实验方法以及在实际中的应用。
二 实验原理由于锂离子电池具有比能量高、比功率大、循环寿命长、无记忆效应以及清洁无污染等特性,是继铅蓄电池、镍镉、镍氢电池之后的新一代电池产品,在近十年来得到了飞速的发展。
锂离子电池主要由正极、负极、隔膜和电解质四部分组成。
正极的活性物质一般采用钻酸锂(LiCoO 2)、镍酸锂(LiNiO 2)和锰酸锂(LiMn 2O 4)等;负极一般采用特殊的碳素材料,如石墨(G )、中间相碳微球(MCMB )或石油焦炭(PC )等;隔膜通常使用微孔聚丙烯(PP )和聚乙烯(PE )或两者的复合膜(PE-PP-PE )。
电解质主要包括液态电解液和聚合物电解质两种,电解质的主要作用就是为锂离子(Li +)的通过提供通道。
液态电解液中含有锂盐和有机溶剂,常用的锂盐有LiPF 6、LiBF 4、LiCl04等,有机溶剂有碳酸丙烯酯(PC )、碳酸乙烯酯(EC )、二甲基碳酸酯(DMC )、二乙基碳酸酯(DEC )等。
锂离子电池的工作原理如图5-34所示。
电池充电时,正极活性物质中的部分Li +脱离钻酸锂晶格经由电解质嵌入或插入到负极活性物质碳的晶格之中,生成Li x C 化合物。
放电时,Li x C 化合物中的Li +脱嵌,再充电时,又重复上述过程,利用Li +在正、负极材料中的嵌入与脱嵌从而完成充放电的过程。
充放电反应可表示如下:三 主要仪器和试剂仪器:氩气手套箱、电池性能测试仪;试剂:LiCoO 2粉末,石墨粉末,乙炔黑,电池用聚四氟乙烯(PTFE )粉末,电池用聚偏氟乙烯(PVDF )粉末,N-甲基吡咯烷酮(NMP ),1M LiPF 6/EC:DMC (1:1体积比),电池用聚丙稀多孔膜。
四 实验步骤1. LiCoO 2正极片的制备:将LiCoO 2粉末、乙炔黑、PVDF (为配好的0.02g/mL 的PVDF/NMP 溶液)按85:10:5(质量比)混合搅拌4h ,并辅以超声波分散制成均匀的浆料,将浆料涂于铝箔上,放入温度为60~800C 的烘箱中烘干后,用Ф12.5~16mm 的冲头冲成极片,在压力为2~4MPa 的压力下压片后,放入100~1200C 左右的真空烘箱中干燥3~5小时,转移到氩气手套箱中,待用。


锂离子电池制作、表征和性能测试综合实验一、实验目的1、掌握锂离子电池正负极电极片的制备技术。
2、了解纽扣式锂离子电池的装配技术。
3、了解并掌握纽扣式锂离子电池的测试表征技术(充放电测试、CV测试及交流阻抗测试等)并会处理分析测试数据。
4、了解锂离子电池正极和负极材料种类,掌握区别锂离子电池材料的方法(例如SEM、XRD、电池充放电特性等)。
5、掌握成品电池的测试方法,会分析成品电池的测试数据。
二、实验原理锂离子电池主要由正极、负极、电解液和隔膜等几个部分组成。
目前商用的锂离子电池正极材料主要是磷酸铁锂、钴酸锂、锰酸锂和三元材料;负极是碳材料组成,如MCMB,天然石墨等;隔膜采用具有微细孔的有机高分子隔膜,如美国Celgard隔膜;电解液由有机溶剂和导电盐组成,有机溶剂采用碳酸乙烯酯、碳酸二甲酯等,导电盐采用LiC104、LiPF6、LiAsF6、LiBF4等。
负极的集流体为铜箔,正极的集流体铝箔。
通常使用的粘结剂为聚偏氟乙烯(PVDF)等。
使用粘结剂把石墨、钛酸锂等负极材料粘附在铜箔上做成薄膜作为负极。
由于正极材料导电性不好,故必须加入导电炭黑材料。
按照一定的配比,把活性料、炭黑和PVDF混合均匀,加入适量溶剂制成具有一定流动性的胶状混合物,在铝箔上均匀涂布,经真空干燥后即可作为正极。
正负极都必须采用可以使Li+嵌入/脱出的活性物质,其结构示意图如图1所示:图1二次锂离子电池结构示意图由于扣式锂离子电池(CLIB)质量轻、体积小,更能满足现代社会用电设备的小型化和轻量化的要求,目前CLIB已商品化,主要用作小型电子产品电源,如:电脑主板、MP3手表、计算器、礼品、钟表、玩具、蓝牙耳机、PDA、电子匙、IC卡、手摇充电手电筒等产品中,寿命可达5~10年。
另外,CLIB较圆柱形和方形锂离子电池成本低,封口容易,设备要求简单,因此,近年来很多电池公司、大专院校和科研院所的研发部门对开发CLIB越来越重视。

实验⼋锂离⼦电池制备及性能测试实验指导书实验⼀:锂离⼦电池制备及性能测试实验学时:6实验类型:综合实验要求:必修⼀、实验⽬的(1)了解锂离⼦⼆次电池的⼯作原理;(2)了解电解质溶液的导电机理和锂离⼦电池电极材料的合成⽅法;(3)掌握扣式锂离⼦电池电极的制备⼯艺及电池的装配过程;(4)掌握锂离⼦电池电性能测试⽅法。
⼆、实验内容扣式锂离⼦电池电极的制备⼯艺及电池的装配过程和扣式锂离⼦电池电化学性能测试。
三、实验原理、⽅法和⼿段液态锂离⼦⼆次电池通常采⽤层状复合氧化物为正极,⼈造⽯墨或者天然⽯墨为负极,充放电过程中通过锂离⼦的移动实现。
以商品化的液态电解质锂离⼦电池为例,如下图1- 1,正极材料和负极材料分别为LiFePO4和⽯墨,以LiPF6- EC-DEC为电解液,其电池⼯作原理如下:锂离⼦电池实质上是⼀种锂离⼦浓差电池,正负电极由两种不同的锂离⼦嵌⼊化合物组成。
正极材料是⼀种嵌锂式化合物,在外界电场作⽤下化合物中的Li 从晶体中脱出和嵌⼊。
当电池充电时,Li+离⼦从正极嵌锂化合物中脱出,经过电解质溶液嵌⼊负极化合物晶格中,正极活性物处于贫锂状态;电池放电时,Li+则从负极化合物中脱出,经过电解质溶液再嵌⼊正极化合物中,正极活性物为富锂状态。
为保持电荷平衡,充放电过程中应有相同数量的电⼦经外电路传递,与Li+⼀起在正、负极之间来回迁移,使正、负极发⽣相应的氧化还原反应,保持⼀定的电位。
⼯作电位与构成正、负极的可嵌锂化合物的化学性质、Li+离⼦浓度等有关。
在正常充放电过程中,负极材料的化学结构不变。
因此,从充放电反应的可逆性看,锂离⼦电池反应是⼀种理想的可逆反应。
锂离⼦电池在⼯作电位与构成电极的插⼊化合物的化学性质、Li+的浓度有关。
充电:LiFePO4 - xLi+ - xe- →xFePO4 + (1-x)LiFePO4放电:FePO4 + xLi+ + xe- →xLiFePO4 + (1-x)FePO4图1- 1. 锂离⼦电池⼯作原理,LiFePO4为正极,⽯墨为负极.研究表明,Li+的脱嵌过程是⼀个两相反应,存在着LiFePO4和FePO4两相的转化,充电时,铁离⼦从FeO6层⾯间迁移出来,经过电解液进⼊负极,发⽣Fe2+→Fe3+的氧化反应,为保持电荷平衡,电⼦从外电路到达负极。
第一部分锂扣式电池组装与测试一、扣式电池制备与组装1.正极配料活性物:PVDF:导电剂(乙炔黑)=8:1:12.负极配料活性物:PVDF:导电剂(乙炔黑)=7:2:13.溶剂NMP依据物料情况来定,经验值4.涂布采用涂布制样器简单涂布5.干燥自然干60℃,真空干110℃(24h).如果水分子在材料晶格内,干燥温度为60-70℃5.把正负极制片放入真空手套箱进行组装注:①不管正极材材料还是负极材料都组装为正极,锂片为负极②2016和2025型锂扣电组装示意图如下二、扣式电池循环伏安(CV法)测试步骤1.采用三电极系统,工作电极(绿色)接正极,参比电极(白色)和对电极(红色)接负极.2.打开电化学工作站,点击控制Control---开路电位OCV,记下开路电位.3.接着选择循环伏安法CV.4.参数设置:初始电位Init为OCV电位,高电位High为5V,低电位Low为1.5V,终止电位Final为5V,灵敏度Sensitivity为1e-6,扫描速度Scan Rate为0.1mV/s.5.点击运行Run.三、扣式电池交流阻抗测试步骤1.采用三电极系统,工作电极(绿色)接正极,参比电极(白色)和对电极(红色)接负极.2.打开电化学工作站,点击控制---开路电位,记下开路电位.3.接着选择交流阻抗EIS.4.参数设置:初始电位为OCV电位,高频High Frequency1e为1e-5 Hz,低频Low Frequency1e 为1e-1 Hz,振幅Amplitude<10mV.5.点击运行Run.注:①锂扣电循环前后都要进行EIS测试②数据分析采用Zview专业软件进行拟合后分析Li+在不同相转移情况③不同EIS图拟合电路图如下四、扣式电池充放电测试步骤1.打开充放电仪设置工步:0.2C/0.2C2.测试出来的容量为正负极容量第二部分锂电池制程异常案例分享一、异常处理方式1.1 极粘度偏高怎么解决?策略(1)加搅1h后看粘度合格情况(2)加搅后粘度还是超高,加入一定量CMC和水搅1h测粘度(3)如果粘度还是不下,加入一定量水加搅1h1.2 负极沉淀太多,粘度和固含量合格,但无法过筛?策略(1)此锅浆料重新搅拌,搅拌1.5h抽真空,搅拌1h慢速搅拌(2)搅拌完成后品质测试浆料粘度及细度,生产试涂看效果1.3 正极配料测粘度偏高?策略(1)粘度不合格的再加NMP调试合格后正常发料涂布4、PVDF胶液呈黄色透明胶将,有许多黑色颗粒?策略(1)分析黑色物质(2)停止使用该NMP和母液,评估后使用5、正极配料加入NMP时阀门未关好造成加入过多,粘度过低?策略(1)出料重新配料,干粉物料减半,NMP少加80Kg搅拌后混一半异常料6、PVDF胶液有白色不溶物?策略(1)胶液加搅0.5-1h二、案例分享2.1 颗粒A清理刀口B清理筛网C浆料本身未达到出料标准D来料异常-反馈改善2.2 缩孔张力梯度造成maragoni效应(火山口),浆料张力不匹配、异物是诱因。
扣式电池的制作及性能测试主讲人:锂电老李z☐扣式电池介绍☐极片的制备☐扣式电池的组装☐扣式电池的测试☐数据分析目录扣式电池介绍PARTONE扣式电池介绍型号尺寸(直径*厚度)CR303230mm*3.2mm CR245024mm*5mm CR232023mm*2mm CR2032(常用)20mm*3.2mm CR202520mm*2.5mm CR102510mm*2.5mm纽扣电池(Coin cell )也称扣式电池,是指外形尺寸象一颗小纽扣的电池,因为体积小,故在各种微型电子产品中得到了广泛的应用,直径从4.8mm 至30mm ,厚度从1.0mm 至7.7mm 不等;一般用于各类电子产品的后备电源,如电脑主板,电子表,电子词典,电子秤,遥控器,电动玩具,心脏起搏器,电子助听器,计数器,照相机等。
极片的制备PARTTWO手工制备极片的流程示意图机械搅拌制备极片的流程示意图1、正极片的制备⚫组成:活性物质(NCM、LFP等):导电剂(CNT、SP、科琴黑等):粘结剂(PVDF)=85-90:5-8:5-8(质量比)⚫分散过程:将导电剂加入溶有PVDF的NMP中(NMP添加量需要实验);强力搅拌30min-2h;加入活性物质;强力搅拌2h以上;观察浆料状态是否可以使用;浆料的涂布(面膜密度一般在10mg/cm2以下,手动涂布或设备涂布)烘烤(温度100℃以上)2、负极片的制备⚫组成:活性物质(石墨、硅碳等):导电剂(SP):粘结剂(CMC、SBR)=85-90:5-8:2-4:2-4(质量比)⚫分散过程:将导电剂加入适量去离子水中(水的添加量需要实验);强力搅拌1h以上;加入活性物质以及粘结剂;强力搅拌2h以上;观察浆料状态是否可以使用;浆料的涂布(面膜密度一般在10mg/cm2以下,手动涂布或设备涂布)烘烤(温度100℃以上)注意:极片的配比、搅拌时间、烘干温度等均需要长时间摸索,根据设备、操作人的手法都有关系,一两次很难做稳定将烘干好的极片用碾压设备压实,然后用冲片设备冲出小圆片,为了保证实验的准确性,最好用冲片数量在10片以上,如果冲片完成后发现边缘有毛刺、起皱等现象,需要用干净毛刷刷干净粉尘。
DOI:10.16525/ki.14-1362/n.2019.07.09总第181期2019年第7期Total of 181No.7,2019创新发展收稿日期:2019-06-01作者简介:李志彬(1985—),男,本科,研究方向为锂电池电化学性能、锂电池失效分析。
纽扣电池的制作、组装与测试分析李志彬(广州中国科学院工业技术研究院,广东广州511458)摘要:阐述锂离子纽扣电池的实验制作方法,介绍锂离子纽扣式电池的组装流程,并测试其充放电情况,从而有效提升锂离子纽扣电池的制作、组装与测试水平。
关键词:纽扣电池;制作;组装;测试分析中图分类号:TM912文献标识码:A文章编号:2095-0748(2019)07-0019-02现代工业经济和信息化Modern Industrial Economy and Informationization 引言受全球能源危机的影响,开发新能源已成为世界各国的重要任务,而高性能高安全的电池研制更是研制重点之一。
作为表征高性能高安全电池性能的重要手段之一,纽扣电池的应用为全电池新材料开发、电池的设计、电池初期生产试制等提供快速精确的分析结果,越来越受到研发技术人员的重视。
所以,系统了解和掌握锂离子纽扣电池的制作、组装和测试情况十分关键,有利于后续对锂电池生产工艺的改进和优化。
众所周知,新型电池的研制一般在实验室当中进行,并需要经过测试分析之后,才能最终实施组装量产商用。
通过科学的实验,系统测试和分析电池的性能与安全性等,对衡量和评判电池的具体应用效果十分有益。
尤其是近些年以来,锂离子纽扣电池获得了非常广泛的应用,对其中锂离子纽扣电池的制作、组装技术和性能测试情况进行总结,有助于对纽扣电池制造与组装工艺不断改进和优化,使其发挥出更好的效果。
鉴于此,深入探讨和分析锂离子纽扣电池的制作、组装以及测试分析就显得尤为必要,具有重要的研究意义与实践价值。
1锂离子纽扣电池的实验制作说明第一,称量相应的电极样品,并依据具体的质量比70∶14∶8进行正极活性材料LiFePO4、黏结剂及导电碳黑的科学量取。
篇一:锂离子电池的制备合成及性能测定实验报告实验二锂离子电池的制备合成及性能测定一.实验目的1.熟悉锂离子电极材料的制备方法,掌握锂离子电极材料工艺路线;2.掌握锂离子电池组装的基本方法;3.掌握锂离子电极材料相关性能的测定方法及原理;4.熟悉相关性能测试结果的分析。
二.实验原理锂离子电池的结构与工作原理:所谓锂离子电池是指分别用二个能可逆地嵌入与脱嵌锂离子的化合物作为正负极构成的二次电池。
人们将这种靠锂离子在正负极之间的转移来完成电池充放电工作的,独特机理的锂离子电池形象地称为“摇椅式电池”,俗称“锂电”。
以licoo2为例:⑴电池充电时,锂离子从正极中脱嵌,在负极中嵌入,放电时反之。
这就需要一个电极在组装前处于嵌锂状态,一般选择相对锂而言电位大于3v且在空气中稳定的嵌锂过渡金属氧化物做正极,如licoo2、linio2、limn2o4、lifepo4。
⑵为负极的材料则选择电位尽可能接近锂电位的可嵌入锂化合物,如各种碳材料包括天然石墨、合成石墨、碳纤维、中间相小球碳素等和金属氧化物,包括sno、sno2、锡复合氧化物snbxpyoz(x=0.4~0.6,y=0.6~0.4,z=(2+3x+5y)/2)等。
三.实验装置及材料1.实验装置:恒温槽,冰箱,搅拌器,管式电阻炉,真空干燥箱,鼓风干燥箱,铁夹,分液漏斗,研钵,烧杯,ph试纸,循环水真空泵,漏斗,抽滤瓶,滤纸,玻璃皿,温度计;2.实验材料:乙醇,醋酸镍,醋酸钴,醋酸锰,碳酸钠,去离子水,氨水,乙炔黑,pvdf,nmp,lioh;四.实验内容及步骤1.样品的制备及准备碳酸盐共沉淀法制备lini1/3co1/3mn1/3o2:分别称取摩尔比为1:1:1的醋酸镍(ni(ch3coo)2·4h2o)、醋酸钴 (co(ch3coo)2·4h2o)、醋酸锰(mn(ch3coo)2·4h2o),用去离子水溶解,溶液金属离子总浓度为1mol·l-1。
锂离子电池材料的制备和电化学性能表征(24学时)、实验目的1•了解尖晶石化合物的组成和结构特点。
2• 了解无机材料制备方法■共沉淀制备前驱体、高温固相锻烧制备的反应原理和反应过程中影响产物性质的一般因素。
3•了解嵌入一脱嵌反应和锂离子电池的工作原理。
4•了解电池性能的主要参数和测试的主要方法。
二、实验原理由于具有电压高、容量高、无污染、安全性好、无记忆效应等优异性能,锂离子电池自1991年实现商品化以来,其种类、性能和应用领域都得到了巨大的发展,已经成为最重要的二次电池之一,在手机・笔记本电脑、摄像机、便携式DVD、电动汽车甚至核潜艇上都得到了广泛应用。
而锂离子电池的相尖研究也成为当前化学电源研究的重要领域。
锂离子电池性能的优劣主要取决于电池的正极。
镒酸锂LiMn2O4是重要的锂离子电池正极活性材料之一,其结构见图1。
该结构为锂离子的迁移提供了三维通道。
A •B oo图1尖晶石晶体结构图在充电过程中,锂离子从正极脱出,嵌入负极活性物质;而放电过程中,是锂离子的回嵌的过程,因此锂离子电池又称为摇椅式”电池。
电池充放电时,正极活f生材料中Li+的迁移过程可用下式表示。
充电时:+ —LiMn 2O4 f xLi + Li vxMn2O4 + xe放电时:+ —I i 仁vMnoCd -4- vl i -4- VA f I i 仁Y丄v l\/lns>Cd fD < Y O K v <LiM n2O4的制备方法很多,常用的有高温固相法、低温固相法和液相法等。
其中,低温固相法和液相法(溶胶■凝胶法)虽然反应温度低,但产物的电化学性能不能令人满意,且不适合工业化生产的需要。
所谓高温固相法,就是在高温下使镒源化合物与锂源化合物反应生成LiMn 2O4。
由于LiMn 2O4在高温下容量衰减较快,需通过钻离子掺杂进行改性制备LiMm.85Coo.i504.对固相反应而言,原料的分散状态(粒度)、孔隙度、装填密度、反应物的接触面积等对固■固反应速度有很大的影响。
锂离子扣式电池制作及其电化学容量充放电曲线的测定
一 实验目的
1. 制作锂离子扣式电池,并测定其电化学容量。
2. 掌握电池容量测量的实验方法以及在实际中的应用。
二 实验原理
由于锂离子电池具有比能量高、比功率大、循环
寿命长、无记忆效应以及清洁无污染等特性,是继铅
蓄电池、镍镉、镍氢电池之后的新一代电池产品,在
近十年来得到了飞速的发展。
锂离子电池主要由正极、
负极、隔膜和电解质四部分组成。
正极的活性物质一
般采用钻酸锂(LiCoO 2)、镍酸锂(LiNiO 2)和锰酸锂
(LiMn 2O 4)等;负极一般采用特殊的碳素材料,如石
墨(G )、中间相碳微球(MCMB )或石油焦炭(PC )
等;隔膜通常使用微孔聚丙烯(PP )和聚乙烯(PE )
或两者的复合膜(PE-PP-PE )。
电解质主要包括液态电解液和聚合物电解质两种,电解质的主要作用就是为
锂离子(Li +)的通过提供通道。
液态电解液中含有锂盐和有机溶剂,常用的锂盐有LiPF 6、LiBF 4、LiCl04等,有机溶剂有碳酸丙烯酯(PC )、碳酸乙烯酯(EC )、二甲基碳酸酯(DMC )、二乙基碳酸酯(DEC )等。
锂离子电池的工作原理如图5-34所示。
电池充电时,正极活性物质中的部分Li +脱离钻酸锂晶格经由电解质嵌入或插入到负极活性物质碳的晶格之中,生成Li x C 化合物。
放电时,Li x C 化合物中的Li +脱嵌,再充电时,又重复上述过程,利用Li +在正、负极材料中的嵌入与脱嵌从而完成充放电的过程。
充放电反应可表示如下:
三 主要仪器和试剂
仪器:氩气手套箱、电池性能测试仪;试剂:LiCoO 2粉末,石墨粉末,乙炔黑,电池用聚四氟乙烯(PTFE )粉末,电池用聚偏氟乙烯(PVDF )粉末,N-甲基吡咯烷酮(NMP ),1M LiPF 6/EC:DMC (1:1体积比),电池用聚丙稀多孔膜。
四 实验步骤
1. LiCoO 2正极片的制备:将LiCoO 2粉末、乙炔黑、PVDF (为配好的0.02g/mL 的PVDF/NMP 溶液)按85:10:5(质量比)混合搅拌4h ,并辅以超声波分散制成均匀的浆料,将浆料涂于铝箔上,放入温度为60~800C 的烘箱中烘干后,用Ф1
2.5~16mm 的冲头冲成极片,在压力为2~4MPa 的压力下压片后,放入100~1200C 左右的真空烘箱中干燥3~5小时,转移到氩气手套箱中,待用。
2. 石墨负极片的制备:将石墨粉末、乙炔黑、PTFE (聚四氟乙烯,为配好的乳液)按90:5:5(质量比)混合搅拌4h ,并辅以超声波分散制成均匀的浆料,将浆料涂于铜箔上,放入温度为60~800C 的烘箱中烘干后,用Ф12.5~16mm 的冲头冲成极片,在压力为2~4MPa 的压力下压片后,放入100~1200C 左右的真空烘箱中干燥3~5小时,转移到氩气手套箱中,待用。
图5-34 锂离子电池的工作原理
3. 在氩气手套箱中组装扣式电池,隔膜为聚丙稀多孔膜,电解液为1M LiPF6/EC:DMC。
为防止扣式电池内部接触不良,在负极端加入发泡镍片做填充物。
五数据记录与处理
将电池正极朝上负极朝下夹在电池夹上,与电池性能测试仪相连。
设置充放电制度,测试出V-f(t)曲线及电池的充放电容量。
六注意事项
1. 电池充放电容量及放电曲线的含义是什么?
2. 充放电过程中,充电电流过大或过小会产生什么现象。