高效毛细管电泳实验
- 格式:doc
- 大小:24.50 KB
- 文档页数:4




高效毛细管电泳实验一、实验目的1. 进一步理解毛细管电泳的基本原理;2. 熟悉毛细管电泳仪器的构成;3. 了解影响毛细管电泳分离的主要操作参数。
二、实验原理1.电泳淌度毛细管电泳(CE )是以电渗流 (EOF)为驱动力,以毛细管为分离通道,依据样品中组分之间淌度和分配行为上的差异而实现分离的一种液相微分离技术。
离子在自由溶液中的迁移速率可以表示为:ν = μE (1)r 6q πημ= (2)式中ν是离子迁移速率,μ为电泳淌度,E 为电场强度。
η为介质粘度,r 为离子的流体动力学半径,q 为荷电量。
因此,离子的电泳淌度与其荷电量呈正比,与其半径及介质粘度呈反比。
2.电渗流和电渗淌度电渗流(EOF )指毛细管内壁表面电荷所引起的管内液体的整体流动,来源于外加电场对管壁溶液双电层的作用。
在水溶液中多数固体表面根据材料性质的不同带有过剩的负电荷或正电荷。
就石英毛细管而言,表面的硅羟基在pH 大于3以后就发生明显的解离,使表面带有负电荷。
为了达到电荷平衡,溶液中的正离子就会聚集在表面附近,从而形成所谓双电层,如图1所示。
这样,双电层与管壁之间就会产生一个电位差,叫做Zeta 电势。
但毛细管两端施加一个电压时,组成扩散层的阳离子被吸引而向负极移动。
由于这些离子是溶剂化的,故将拖动毛细管中的体相溶液一起向负极运动,这便形成了电渗流。
电渗流的大小可用速率和淌度来表示:()E EOF ηεξν/=(3) 或者 ηεξμ/=EOF (4)式中νEOF 为电渗流速率,μEOF 为电渗淌度,ξ为Zeta 电势,ε为介电常数。
3.毛细管电泳的分离模式CE 有6种常用的分离模式,其中毛细管区带电泳(CZE )、胶束电动毛细管色谱(MEKC )和毛细管电色谱(CEC )最为常用。
本实验的内容为CZE 。
4.毛细管电泳的基本参数CE 中的分析参数可以用色谱中类似的参数来描述,比如与色谱保留时间相对应的有迁移时间,定义为一种物质从进样口迁移到检测点所用的时间,迁移速率(ν)则是迁移距离(l ,即被分析物质从进样口迁移到检测点所经过的距离,又称毛细管的有效长度)与迁移时间(t )之比:t l=ν (5)因为电场强度等于施加电压(V)与毛细管长度(L)之比:L VE = (6)就CE 的最简单的模式—毛细管区带电泳(CZE )而言,结合式(1),可得:tV lL tE l a ==μ (7)在毛细管区带电泳(CZE )条件下测得的淌度是电泳淌度与电渗流淌度的矢量和,我们称之为表观淌度μa ,即:EOF e a μμμ+= (8)实验中可以采用一种中性化合物,如二甲亚砜或丙酮等,来单独测定电渗流淌度,然后求得被分析物的有效淌度。

高效毛细管电泳法(简称CE)是一种应用电泳原理的分离技术,适用于分离和测定小分子有机化合物和生物大分子,如氨基酸,肽,核酸和蛋白质等,因其操作简便,分离速度快,分辨率高,样品耗费小等优点而广泛应用于分析技术领域.
其原理主要是利用电荷作用力和电流作用力共同作用于被分离物质,在快速流动的毛细管内进行分离,不同的物质根据其理化性质差异,在电场力的作用下,快速分离并达到最终的分析结果.
具体分离过程可分为三步:1.预处理:通过对样品进行一些必要的化学或物理处理,如蛋白的
脱盐,核酸的降解等,使之达到最佳测定条件.2.分离和检测:样品被注入高压,在毛细管内被电场引导向阳极(或阴极)并被快速分离,经过检测器检测,得出分析结果.3.定量分析:基于标准品,定量分析被分离物质的浓度.
在实际应用中,高效毛细管电泳法可通过改变分离毛细管的材料、加入胶体、调整电场强度等方式,进一步提高分离效率和分辨率,并能够与其他分析技术结合使用,如质谱法、光谱法等.
综上,高效毛细管电泳法是一种快速、高效、准确的分离技术,具有广泛的实际应用价值,在
企业管理和生物学等领域都有着广泛的应用前景.。

高效毛细管电泳法原理1. 引言高效毛细管电泳(Capillary Electrophoresis,CE)是一种分离和检测样品成分的高效分析技术。
它基于电荷移动的原理,利用电场作用将带电样品分子按照电荷大小和大小排列分离。
本文将介绍高效毛细管电泳法的原理以及相关的基本概念。
2. 原理高效毛细管电泳法的分离原理主要包括电迁移、电渗流和扩散。
2.1 电迁移电迁移是指在电场作用下,带电离子向电极迁移的现象。
根据离子迁移速率的不同,可以将不同种类的离子分离开来。
在高效毛细管电泳中,利用气泡塞(例如墨水)将离子解进行填充到毛细管中,然后施加电压,使带电离子向电极移动。
2.2 电渗流电渗流是指随着离子迁移而产生的流动。
由于电场作用下毛细管内壁带有固定电荷,会在离子迁移的同时引起流体流动。
这种电渗流可加速离子的迁移速度,提高分离效率。
2.3 扩散扩散是指分子由于热运动而发生的自由扩散。
在高效毛细管电泳中,离子在电场作用下会发生迁移,而扩散则会限制离子迁移的速率。
通过控制毛细管的尺寸和填充材料,可以优化扩散效应,进一步提高分离效率。
3. 工作步骤高效毛细管电泳法的工作步骤主要包括样品进样、分离和检测。
3.1 样品进样样品进样是将待分析的样品注入到毛细管中的过程。
常用的进样方式包括静态进样和动态进样。
在静态进样中,样品通过注射器或微量移液器直接注入到毛细管中。
在动态进样中,利用高压电泵将样品以一定的流速进样到毛细管中。
3.2 分离分离是利用电场作用将样品中的成分分离开来的过程。
通过在毛细管两端施加电压,带电的离子根据电荷和大小进行迁移,从而实现分离。
根据需要可以调节电场强度、温度和 pH 等因素来优化分离效果。
3.3 检测检测是对分离后的样品进行定性和定量分析的过程。
常用的检测方法包括紫外光检测、荧光检测、电化学检测等。
通过对分离后的样品在检测器中发生的特定物理或化学反应进行检测,并根据峰面积或峰高来定量分析样品中的成分。


毛细管电泳法分离水杨酸、苯甲酸及阿司匹林中的含量测定毛细管电泳法分离水杨酸、苯甲酸及阿司匹林中的含量测定毛细管电泳又称高效毛细管电泳( High Performance Capillary Electrophoresis, HPCE) 是一种仪器分析方法。
通过施加10-40kV 的高电压于充有缓冲液的极细毛细管,对液体中离子或荷电粒子进行高效、快速的分离。
现在,HPCE 已广泛应用于氨基酸、蛋白质、多肽、低聚核苷酸、DNA 等生物分子分离分析,药物分析,临床分析,无机离子分析,有机分子分析,糖和低聚糖分析及高聚物和粒子的分离分析。
人类基因组工程中DNA 的分离是用毛细管电泳仪进行的。
毛细管电泳较高效液相色谱有较多的优点。
其中之一是仪器结构 简单(见图1)。
它包括一个高电压源,一根毛细管,紫外检测器及计算机处理数据装置。
另有两个供毛细管两端插入而又可和电源相连的缓冲液池。
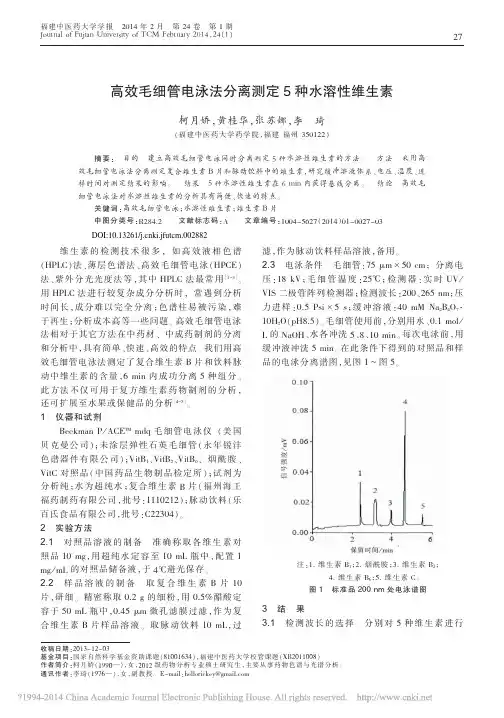
high-v oltagepower supply BufferV ialBuffer V ial Detector Recording dev icecapillaryElectrode Electrode图1 CE 仪器组成示意图毛细管中的带电粒子在电场的作用下,一方面发生定向移动的电泳迁移,另一方面,由于电泳过程伴随电渗现象,粒子的运动速度还明显受到溶液电渗流速度的影响。
粒子的实际流速 V 是电泳流速度 Vep 和渗流速度 Veo 的矢量和。
即:V = Vep + Veo (1)电渗流是一种液体相对于带电的管壁移动的现象。
溶液的这一运动是由硅/水表面的Zeta 势引起的。
CE 通常采用的石英毛细管柱表面一般情况下(pH>3)带负电。
当它和溶液接触时,双电层中产生了过剩的阳离子。
高电压下这些水合阳离子向阴极迁移形成一个扁平的塞子流,如图2。
毛细管管壁的带电状态可以进行修饰,管壁吸附阴离子表面活性剂增加电渗流, 管壁吸附阳离子表面活性剂减少电渗流甚至改变电渗流的方向。

高效毛细管电泳(high performance capillary electrophoresis,HPCE)是近年来发展起来的一种分离、分析技术,它是凝胶电泳技术的发展,是高效液相色谱分析的补充。
该技术可分析的成分小至有机离子、大至生物大分子如蛋白质、核酸等。
可用于分析多种体液样本如血清或血浆、尿、脑脊液及唾液等,HPLC分析高效、快速、微量。
电泳迁移不同分子所带电荷性质、多少不同,形状、大小各异。
一定电解质及PH的缓冲液或其它溶液内,受电场作用,样本中各组分按一定速度迁移,从而形成电泳。
电泳迁移速度(v)可用下式表示:v=uE其中E为电场强度(E=V/L,V为电压,L为毛细管总长度)。
u 为电泳淌度。
电渗迁移:电渗迁移指在电场作用下溶液相对于带电管壁移动的现象。
特殊结构的熔合硅毛细管管壁通常在水溶液中带负电荷,在电压作用下溶液整体向负极移动,形成电渗流。
带电微粒在毛细管内实际移动的速度为电泳流和电渗流的矢量和。
分离分析类型根据其分离样本的原理设计不同主要分为以下几种类型:①毛细管区带电泳(capillary zone electrophoresis,CZE);②毛细管等速电泳(capillary chromatography,CITP);③毛细管胶速电动色谱(miceller electrokinetic capillary chromatography,MECC);④毛细管凝胶电泳(capillary gelelectrophoresis,CGE);⑤毛细管等电聚焦(capillary isoelectric focusing ,CIEF)。
毛细管区带电泳(CZE)为HPCE的基本操作模式,一般采用磷酸盐或硼酸盐缓冲液,实验条件包括缓冲液浓度、pH值、电压、温度、改性剂(乙腈、甲醇等),用于对带电物质(药物、蛋白质、肽类等)分离分析,对于中性物质无法实现分离。
毛细管胶束电动色谱(MECC)为一种基于胶束增溶和电动迁移的新型液体色谱,在缓冲液中加入离子型表面活性剂作为胶束剂,利用溶质分子在水相和胶束相分配的差异进行分离,拓宽了CZE的应用范围,适合于中性物质的分离,亦可区别手性化合物,可用于氨基酸、肽类、小分子物质、手性物质、药物样品及体液样品的分析。

化学分析中的高效毛细管电泳技术高效毛细管电泳技术(Capillary Electrophoresis, 简称CE)是一种目前被广泛应用于化学分析领域的分离技术,具有高分离能力、灵敏度和速度。
它可以同时进行多样品并行分析,适用于多种类型的样品,包括生物样品、环境样品、化学样品等。
毛细管电泳技术是基于电场作用下静电互斥效应对分子进行分离的一种方法。
输入狭小的管道(通常为毛细管)中,将溶液中分离物带电后,利用电场作用,将其向前驱动,从而实现品种之间的分离。
传统毛细管电泳技术所使用的电泳液通常是缓冲液,以静电作用之间的力为主导分离手段,运行时间长、分离精度低。
高效毛细管电泳则是一种改进后的技术,分离原理通过毛细管管壁与电泳液之间的热运动提高微分扩散率,导致选择性和分离速度快且准确,使传统毛细管电泳技术所不能完成的任务变得容易。
高效毛细管电泳技术是一种全自动的技术方案,成本较低、易于实验操作、重复性和稳定性优良(特别是借助于机器化和自动化实验流程)。
由于最小的检测体积与毛细管越小,假定其他条件一直不变(比如电泳液浓度、毛细管长度等),则分辨率就越高,尤其是在极小的机器装置中不失为一种非常适宜的选择。
高效毛细管电泳技术具有分离速度快、高分辨率、极高的检测灵敏度和线性范围广等优点,使得化学分析领域的许多应用成为可能,例如药物分析、毒物分析、食品检测、环境监测、生物学及基因研究等。
其中,高效毛细管电泳技术在药物研究领域中得到了普遍的应用。
例如,针对药物制剂快速筛选、有效成分定量分析、药物代谢产物的分析等这些方面,应用高效毛细管电泳技术已成为一种得到很好承认的分析和检测手段。
尽管高效毛细管电泳技术得到广泛的认同,并且得到了工业界和学术界的支持和投资,但是该技术在仪器精密度以及分离柱的可靠性方面仍有一定局限性。
因此,未来需要通过技术创新、展望未来科学发展进步等思想定力等途径不断拓展和改进高效毛细管电泳技术,使之广泛在许多领域得到应用,满足高速度、高分辨率、高灵敏度的需求。
高效毛细管电泳——非接触式电导检测法测矿泉水中四种阳离子含量化学与化学工程学院分析科学研究所中山大学,广东510275摘要本实验利用高效毛细管电泳的仪器,通过标准加入法,结合非接触式电导检测的方法对中山大学水厂生产的“中大逸仙泉”矿泉水产品中的四种金属离子——K+、Na+、Mg2+、Ca2+进行定性定量分析。
条件:8mmol·L-1 Tris + 6mmol/L 酒石酸为电泳运行液;分离电压+14 kV。
结果测得矿泉水样品中K离子浓度为5.30mg/L,Na离子浓度为2.06mg/L,Mg离子浓度为0.44mg/L,Ca离子浓度为1.52mg/L。
关键词高效毛细管电泳法非接触式电导检测法标准加入法矿泉水阳离子分析0 引言矿泉水(Mineral Water)是指水中含有矿物质或其他溶解的物质。
而这些物质中的K+、Na+、Mg2+、Ca2+四种阳离子含量的测定方法,国家标准中[1]对于K+和Na+是用火焰发射光度法、火焰原子吸收分光光度法和离子色谱法等;而Mg2+和Ca2+则较多使用EDTA二钠滴定法以及火焰原子吸收分光光度法。
但以上方法均受限于单元素测定,效率较低且基底影响较大。
现今也有使用ICP作为光源[2]对金属元素进行测定的应用,但仪器价格较为昂贵,普及度较低。
高效毛细管电泳(High Performance Capillary Eletrophoresis,HPCE)利用了电泳和电渗的原理,通过在充满缓冲液的毛细管两边加上高电压后进行电泳,由于样品各组分在毛细管内的迁移速度不同,使得经过一段时间后,各组分会按照其速度大小顺序依次经过检测器而被检出,从而进行定性和定量分析。
该方法具有成本低、分离效能高、速度快、应用范围广和样品用量少等优点,已经成为现今重要的分离分析手段[3]。
对应的检测手段中,紫外/可见检测器[4]的应用较广泛,但由于检测光程受到毛细管内径的限制导致灵敏度低。
而电导法不仅灵敏度高,而且操作简单,其根据电极与待测溶液是否接触分为接触式和非接触式电导检测。
毛细管电泳第一部分原理一、迁移毛细管电泳是带电粒子在电场力的驱动下,在毛细管中按其淌度或和分配系数不同进行高效、快速分离的电泳新技术,也称为高效毛细管电泳(Capillary Electrophoresis, CE)。
偶电层:固定层和流动液层共同构成了偶电层;固定层和流动液层间的电势差称为Zeta 电势。
Zeta电势的值随距离增大呈指数衰减,使其衰减一个指数单位所需的距离称之为偶电层的厚度,用δ表示。
在溶液中的导电仍然服从欧姆定律,即E=IR,I是电流,R是电阻,E是电场强度。
电泳:是指在电场作用下,溶液中的带电粒子作定向移动的现象。
电渗:是指在电场作用下,毛细管内液体沿固体表面移动的现象。
电泳移动速度:u ep=μep·E;E为电场强度,μep表示溶质的淌度。
溶质的淌度μep:溶质在给定缓冲液中单位时间间隔和单位电场强度下移动的距离。
εζ1μep=ε是流体的介电常数;η是介质的粘度;ζ是粒子的Zeta电势;Zeta电势近似正比于Z/M2/3;M为分子量,Z为净电荷。
电渗当在通道两端施加电压时,距离通道壁较远的正离子(受壁的吸引力较弱,可自由移动)游向负极,正离子带着吸附于其上的水分子以及因为摩擦力牵引着其他水分子一齐游向负极,此即为电渗效应(带电外壳带着其中溶质运动)。
电渗速度:u op=μop·E;E为电场强度,μop表示电渗的淌度。
电渗的淌度μop:液体在单位时间间隔和单位电场强度下移动的距离。
μop=εζ2ζ为管壁的Zeta电势;ε是流体的介电常数;η是介质的粘度。
Zeta电势越大,偶电层越薄,粘度越小,电渗流值越大,在不少情况下电渗流的速度是泳流速度的5—7倍。
粒子在毛细管内的运动是两种速度的矢量和:u= u ep+ u op=(μep+μop)Eμapp=μep+μop;称μapp显示淌度,为粒子电泳淌度和电渗引起的淌度之和。
μapp=μep+μop=u/E=L d·L t t r·VL d是毛细管进样口到检测器的距离,t r是粒子通过这段距离所用的时间,L t是柱的全长,V是电压。
高效毛细管电泳实验
一、实验目的
1. 进一步理解毛细管电泳的基本原理;
2. 熟悉毛细管电泳仪器的构成;
3. 了解影响毛细管电泳分离的主要操作参数。
二、实验原理
1.电泳淌度
毛细管电泳(CE )是以电渗流 (EOF)为驱动力,以毛细管为分离通道,依据样品中组分之间淌度和分配行为上的差异而实现分离的一种液相微分离技术。
离子在自由溶液中的迁移速率可以表示为:
ν = μE (1)
r 6
q πημ= (2)
式中ν是离子迁移速率,μ为电泳淌度,E 为电场强度。
η为介质粘度,r 为离子的流体动力学半径,q 为荷电量。
因此,离子的电泳淌度与其荷电量呈正比,与其半径及介质粘度呈反比。
2.电渗流和电渗淌度
电渗流(EOF )指毛细管内壁表面电荷所引起的管内液体的整体流动,来源于外加电场对管壁溶液双电层的作用。
在水溶液中多数固体表面根据材料性质的不同带有过剩的负电荷或正电荷。
就石英毛细管而言,表面的硅羟基在pH 大于3以后就发生明显的解离,使表面带有负电荷。
为了达到电荷平衡,溶液中的正离子就会聚集在表面附近,从而形成所谓双电层,如图1所示。
这样,双电层与管壁之间就会产生一个电位差,叫做Zeta 电势。
但毛细管两端施加一个电压时,组成扩散层的阳离子被吸引而向负极移动。
由于这些离子是溶剂化的,故将拖动毛细管中的体相溶液一起向负极运动,这便形成了电渗流。
电渗流的大小可用速率和淌度来表示:
()E EO F ηεξν/=
(3) 或者 ηεξμ/=EO F (4)
式中νEOF 为电渗流速率,μEOF 为电渗淌度,ξ为Zeta 电势,ε为介电常数。
3.毛细管电泳的分离模式
CE 有6种常用的分离模式,其中毛细管区带电泳(CZE )、胶束电动毛细管色谱(MEKC )和毛细管电色谱(CEC )最为常用。
本实验的内容为CZE 。
4.毛细管电泳的基本参数
CE 中的分析参数可以用色谱中类似的参数来描述,比如与色谱保留时间相对应的有迁移时间,定义为一种物质从进样口迁移到检测点所用的时间,迁移速率(ν)则是迁移距离(l ,即被分析物质从进样口迁移到检测点所经过的距离,又称毛细管的有效长度)与迁移时间(t )之比:
t l
=ν (5)
因为电场强度等于施加电压(V)与毛细管长度(L)之比:
L V
E = (6)
就CE 的最简单的模式—毛细管区带电泳(CZE )而言,结合式(1),可得:
tV lL tE l a ==μ (7)
在毛细管区带电泳(CZE )条件下测得的淌度是电泳淌度与电渗流淌度的矢量和,我们称之为表观淌度μa ,即:
EO F e a μμμ+= (8)
实验中可以采用一种中性化合物,如二甲亚砜或丙酮等,来单独测定电渗流淌度,然后求得被分析物的有效淌度。
三、仪器及试剂
HP3D 电泳仪。
5 mL 移液管2只,1mL 移液管共2支,分别标上四种标样的标签。
10 mL 容量瓶2个,滴管2支,分别标上标准、未知的标签。
塑料样品管若干个,分别用于标准样品、未知样品、三种缓冲溶液、HCl 、NaOH 、二次水和废液,做好标号。
微量自动移液枪,酸度计。
标样:苯甲醇、苯甲酸、水杨酸、对氨基水杨酸,均溶于二次水中,浓度1.00 mg/mL ,作为标准品,混合稀释作为标样。
另有一个预先配制的未知浓度混合样品。
缓冲溶液(buffer):10 mmol/L NaH 2PO 4-Na 2HPO 4 1:1缓冲溶液(NaH 2PO 4和Na 2HPO 4各5mMol/L),20 mmol/L HAc-NaAc pH 为6 (HAc:NaAc 大约1:15)缓冲溶液,20 mmol/L Na 2B 4O 7缓冲溶液。
0.1mol/L NaOH 溶液,二次去离子水。
四、实验步骤
1. 仪器的预热和毛细管的冲洗:在实验教师的指导下,打开仪器和配套的工作站。
工作温度设置为30℃,不加电压,冲洗新毛细管,顺序依次是:1 mol/L HCl 溶液30 min 二次水5 min ,1 mol/L NaOH 溶液30 min ,二次水5 min ,10 mmol/L NaH 2PO 4-Na 2HPO 4 1:1缓冲溶液5 min ,两次运行之间依次用0.1 mol/L NaOH 2min, 二次水2 min, 缓冲液5min 。
2. 混合标样的配制:毛细管冲洗的同时,配制混合标样。
分别用5mL的移液管移取3mL 苯甲醇、3mL苯甲酸,用1mL的移液管移取1mL水杨酸、0.5mL对氨基水杨酸于10mL的容量瓶中,定容,得到苯甲醇、苯甲酸、水杨酸、对氨基水杨酸浓度分别为300μg/mL、300μg/mL、100μg/mL、50.0μg/mL的混合溶液作为混合标样。
(试思考为什么不采用浓度一样的混合溶液作为混合标样?)
3. 混合标样的测定:待毛细管冲洗完毕,取50μL混合标样,置于塑料样品管,放在电泳仪样品盘(Tray)中,进样压力50 mbar,进样时间5 s。
然后开始分析,电压25 kV。
4. 未知浓度混合样品的测定:方法与条件同上,测试未知浓度混合样品,。
5. 不同缓冲溶液下迁移时间的变化:未知浓度混合样品的测定完毕后,冲洗毛细管,顺序依次是:0.1 mol/L NaOH溶液 5 min,二次水 5 min,然后更换缓冲溶液为20 mmol/L Na2B4O7,冲洗5 min;并在此条件下测试未知浓度混合样品,电压25 kV。
按照前面的顺序再次冲洗毛细管,再次更换缓冲溶液为20 mmol/L HAc-NaAc pH为6,冲洗5 min;并在此条件下测试未知浓度混合样品,电压25 kV。
6. 完成实验以后,用0.1 mol/L NaOH冲洗毛细管10 min, 二次水冲洗5min。
7. 打印报告,清理实验台。
五、数据处理
1. 根据电泳的原理,判断两组混合标样中4个峰各自的归属(需要查找被分析物的p K a值),找到在未知浓度混合样品中与之迁移时间一致的峰。
2. 按照已知浓度峰的积分面积之比折算未知浓度混合样品中各个组分的浓度(外标定量法)。
3. 计算各个组分的表观淌度和有效淌度,并说明哪个组分可以作为电渗流标记物。
本次CE 实验使用的毛细管总长度L=56cm,有效长度l=50cm。
4. 根据电泳的原理,判断在另外两种缓冲溶液下,各个峰的归属,并对各个组分迁移时间的变化做出合理分析和讨论。
六、注意事项
1. 冲洗毛细管时禁止在毛细管上加电压;不允许更改讲义上给定的工作电压,也不建议改变进样时间。
2. NaOH、HCl、二次水、样品和缓冲溶液等之间的切换是自动的,在实验过程中要随时注意是否放在Tray正确位置。
3. 冲洗毛细管对于实验结果的可靠性和重现性至关重要,务必认真完成每一次冲洗,不允许缩短冲洗时间或者不冲洗。
4. 做完实验以后一定要用水冲洗毛细管,否则可能会导致毛细管堵塞,严重影响实验结果,希望引起足够的重视。
5. 塑料样品管的里面容易产生气泡,轻敲管壁排出气泡以后方可放入样品盘(Tray)。
6. 合理分配实验时间,注意一组的四个同学之间的分工合作,每个同学均要实际操作冲洗、进样、分析全过程一次。