ds区金属元素
- 格式:ppt
- 大小:3.49 MB
- 文档页数:55


ds区元素实验报告DS区元素实验报告导言:DS区(Discovered and Studied Zone)是指科学家们在研究中发现并深入研究的区域。
在这个实验报告中,我们将探索DS区中的元素,了解它们的性质和特点,以及它们在自然界和人类生活中的应用。
一、氢元素的探索和性质氢是宇宙中最常见的元素之一,它在地球上以气体的形式存在。
氢具有轻质、可燃、无色无味等特点,是一种非常重要的元素。
在实验中,我们通过电解水的方法制取氢气,并观察了氢气的燃烧现象。
氢气的燃烧产生的唯一产物是水,这使得氢成为一种清洁的能源选择。
二、氧元素的探索和性质氧是地球上最常见的元素之一,它占据了地球大气中的大部分。
氧是一种无色、无味、无臭的气体,对于维持生命至关重要。
在实验中,我们通过加热高锰酸钾制取氧气,并观察了氧气对燃烧的促进作用。
氧气是一种强烈的氧化剂,许多物质在氧气中能够燃烧。
此外,氧气还广泛应用于医疗、工业和冶金等领域。
三、碳元素的探索和性质碳是地球上最丰富的元素之一,它存在于各种有机物中。
碳具有多种形态,如石墨、金刚石等。
在实验中,我们通过加热蔗糖制取活性炭,并观察了活性炭对吸附的作用。
碳具有良好的导电性和热导性,因此被广泛应用于电池、电子产品和高温材料等领域。
四、铁元素的探索和性质铁是地球上最常见的金属元素之一,它广泛存在于地壳和岩石中。
铁具有良好的导电性和磁性,是一种重要的结构材料。
在实验中,我们通过还原铁矿石制取铁,并观察了铁的磁性。
铁在建筑、交通工具和机械制造等领域有着广泛的应用。
五、硫元素的探索和性质硫是地球上一种常见的非金属元素,它存在于地壳、水体和生物体中。
硫具有黄色,有刺激性的气味,以及较低的熔点和沸点。
在实验中,我们通过加热硫磺制取硫酸,观察了硫酸的酸性反应。
硫在化学工业、农业和医药领域有着广泛的应用。
结论:通过对DS区中的元素进行实验探索,我们深入了解了它们的性质和特点,以及它们在自然界和人类生活中的应用。


ds区金属元素实验报告【引言】金属元素是化学中重要的一类元素,其具有良好的导电性、导热性和延展性等特点,被广泛应用于工业、建筑、电子等领域。
本实验旨在通过对不同金属元素的实验研究,探究它们的性质和特点,为深入理解金属元素提供实验依据。
【实验一:金属元素的导电性】首先,我们选取了几种常见的金属元素,包括铜、铁、铝和锌。
通过将它们分别连接到电池的两极,我们可以观察到它们是否能够导电。
实验结果显示,铜和铁能够很好地导电,灯泡发出明亮的光;而铝和锌的导电性较差,灯泡只发出微弱的光。
这是因为铜和铁具有较好的导电性能,而铝和锌的导电性能较差。
【实验二:金属元素的导热性】接下来,我们进行了金属元素的导热性实验。
我们选取了相同大小和形状的铜、铁、铝和锌棒,并将它们的一端依次置于火焰中加热。
实验结果显示,铜棒迅速传导热量,火焰附近的部分迅速变热;铁棒次之,传热速度较慢;铝棒传热速度更慢,火焰附近的部分变热较慢;而锌棒传热速度最慢,火焰附近的部分几乎没有明显变化。
这说明铜具有较好的导热性能,而锌的导热性能较差。
【实验三:金属元素的延展性】我们进一步研究了金属元素的延展性。
选取了铜、铁、铝和锌的薄片,并使用锤子进行敲击。
实验结果显示,铜薄片在敲击后没有明显的变形,仍然保持原来的形状;铁薄片稍微有些变形,但仍能保持较好的形状;而铝薄片和锌薄片则发生了明显的变形,形状不再规则。
这说明铜具有较好的延展性能,而铝和锌的延展性能较差。
【实验四:金属元素的化学性质】最后,我们研究了金属元素的化学性质。
我们选取了铜、铁、铝和锌的片状样品,并将它们分别放入盛有酸性溶液的试管中。
实验结果显示,铜片和铁片没有明显的变化;而铝片在酸性溶液中发生了剧烈的反应,产生了气体并迅速腐蚀;锌片也发生了类似的反应,但稍微缓慢一些。
这说明铝和锌具有较强的化学活性,而铜和铁的化学活性较低。
【结论】通过以上实验,我们得出了一些关于金属元素的结论。
铜具有良好的导电性、导热性和延展性,化学活性较低;铁具有较好的导电性和导热性,延展性较好,化学活性较低;铝的导电性和导热性较差,延展性较差,但化学活性较高;锌的导电性、导热性和延展性均较差,但化学活性较高。

第十一章副族元素化学第十章ds区元素第节素概述第一节ds区元素概述ds 区元素是指元素周期表中的ⅠB 、ⅡB 两族元素包括族元素,包括铜、银、金、锌、镉、汞等6种自然形成的金属元素及两种人工合成元素。
ds 区的名称是因为它们的外层电子构型:ⅠB : (n-1)d 10s 1或ⅡB :(n-1)d 10s 2从广义的角度看,ds区实际上是d区的一部分。
因本区元素次外层(n-1)d轨道已填满电子,而最外电子层构型和区相同,所以满电子,而最外电子层构型和s区相同,所以将此区域元素称为ds区元素。
ds区元素都是过渡金属。
但由于其d层电子是全充满的,所以体现的性质与其他过渡金属有所不同。
如:最高氧化态只能达到+3如:最高氧化态只能达到+3。
3第二节铜族元素(一)铜族元素的单质1.物理性质(1) 特征颜色:Cu(紫红),Ag(白),Au(黄)(2) 溶、沸点较其它过渡金属低(3) 导电性、导热性好,且Ag>Cu>Au(3)导电性导热性好且(4)延展性好铜族元素2.化学性质(1)与O 2作用)2CuO(O 2Cu 2黑⎯→⎯+∆)(CO (OH)Cu CO O H O 2Cu 322222绿⎯→⎯+++∆碱式碳酸铜Au 、Ag O 发生反应,当有沉淀剂或g 不与2发生反应,有沉淀剂或配合剂存在时,可发生反应。
5=铜族元素−−−+⎯→⎯+++4OH]4[M(CN)8CN O 2H O 4M AuAg Cu M 222,,−++⎯→⎯+++OH)(])4[Cu(NH 8NH O 2H O 4Cu 23322无色)(])[Cu(NH 243蓝+不可用铜器盛氨水O 2→O2H S 2Ag O S 2H 2Ag 2222+⎯→⎯++6银器年久变黑(2) 与酸作用铜族元素c Cu、Ag、Au不能置换稀酸中的H +d 若生成难溶物或配合物,单质还原能力则增强()2A I 2A (g)H S(s)Ag S H 2Ag 222+⎯→⎯+(g)H 2AgI 4I 2H 2Ag 2-2+⎯→⎯++−+③Cu 、Ag 、Au 可溶于氧化性酸7(二)铜的重要化合物Cu 2O CuO颜色暗红色黑色溶解性难溶于水,易溶于酸热稳定性稳定,1235熔化也不分解高C 加入氨水[Cu(NH 3)2]+(无色)微溶Cu 2O + 2H +→Cu 2++ Cu + H 2OC O +2HCl 2C Cl +H Cu 2O + 2HCl →2CuCl + H 2O 10004CuO Cu O +O C (白色)CuO + 2H +→Cu 2++ H 2O4CuO Cu 2O + O 28(二)铜的重要化合物Cu 2O CuO颜色暗红色黑色溶解性难溶于水,易溶于酸热稳定性稳定,1235 熔化也不分解高C 加入氨水[Cu(NH 3)2]+(无色)微溶Cu 2O+4NH 3+H 2O →2[Cu(NH 3)2]++2OH -在空气中被氧化4[Cu(NH 3)2]++O 2+8NH 3+2H 2O →蓝94[Cu(NH 3)4]2+(深蓝)+4OH -CuOH 不稳定,至今尚未制得为浅蓝色难溶于水2-Cu(OH)2为浅蓝色,难溶于水1.受热易脱水2[Cu(OH)4]+C 6H 12O 6(葡萄糖)→Cu 2O +C 6H 12O 7+4OH -+2H 2O Cu(OH)2 CuO + H 2O 80~90C 两性以碱性为主(葡萄糖酸)2.两性:以碱性为主+2H + →2+ O (用此反应可检查尿糖Cu(OH)2+ 2H Cu +H 2O (浅兰色)Cu(OH)2+ 2OH -→[Cu(OH)4]2-(亮兰色)3. 溶于氨水2++2OH-10Cu(OH)2+4NH 3→[Cu(NH 3)4]2 + 2OH制取:1.,Cu 2+ + Cu + 4Cl -→2[CuCl 2]-1. 在热、浓HCl 溶液中, 用Cu 粉还原CuCl 2(无色)2. 用水稀释-→2CuCl ()+2Cl -总反应:Cu 2+ + Cu + 2Cl -→ 2CuCl2[CuCl 2]2CuCl (白色) + 2Cl 应用:CuCl + CO + HCl →[CuCl(CO)] ·H 2O 11(测CO )2无水CuCl 2为棕黄色固体,是共价化合物易溶于水和有机溶剂(如乙醇、丙酮)CuCl 2溶液随c (Cl -)不同而呈不同颜色[C Cl 24H O [C (H 2+4Cl [CuCl 4]2-+ 4H 2O [Cu(H 2O)4]2+ + 4Cl -)(12(黄色) (浅蓝色)无水CuSO4为白色粉末,易溶于水,吸水性强,吸水后呈蓝色,可检验有机液体中的微量水分。

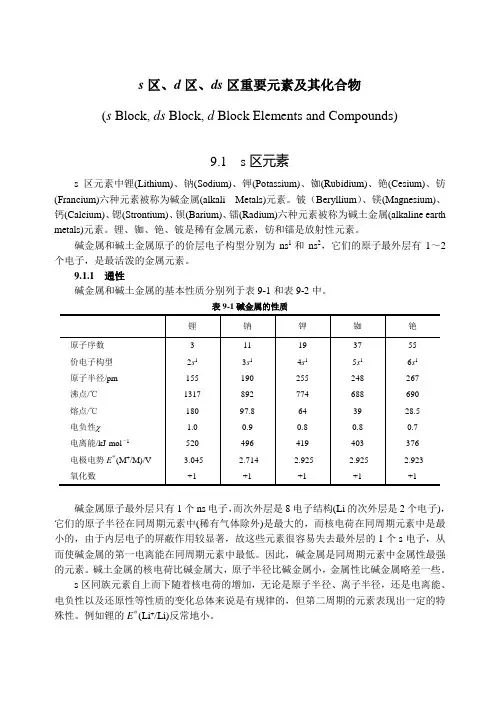
s区、d区、ds区重要元素及其化合物(s Block, ds Block, d Block Elements and Compounds)9.1 s区元素s区元素中锂(Lithium)、钠(Sodium)、钾(Potassium)、铷(Rubidium)、铯(Cesium)、钫(Francium)六种元素被称为碱金属(alkali Metals)元素。
铍(Beryllium)、镁(Magnesium)、钙(Calcium)、锶(Strontium)、钡(Barium)、镭(Radium)六种元素被称为碱土金属(alkaline earth metals)元素。
锂、铷、铯、铍是稀有金属元素,钫和镭是放射性元素。
碱金属和碱土金属原子的价层电子构型分别为ns1和ns2,它们的原子最外层有1~2个电子,是最活泼的金属元素。
9.1.1 通性碱金属和碱土金属的基本性质分别列于表9-1和表9-2中。
表9-1碱金属的性质碱金属原子最外层只有1个ns电子,而次外层是8电子结构(Li的次外层是2个电子),它们的原子半径在同周期元素中(稀有气体除外)是最大的,而核电荷在同周期元素中是最小的,由于内层电子的屏蔽作用较显著,故这些元素很容易失去最外层的1个s电子,从而使碱金属的第一电离能在同周期元素中最低。
因此,碱金属是同周期元素中金属性最强的元素。
碱土金属的核电荷比碱金属大,原子半径比碱金属小,金属性比碱金属略差一些。
s区同族元素自上而下随着核电荷的增加,无论是原子半径、离子半径,还是电离能、电负性以及还原性等性质的变化总体来说是有规律的,但第二周期的元素表现出一定的特殊性。
例如锂的EΘ(Li+/Li)反常地小。
表9-2碱土金属的性质s区元素的一个重要特点是各族元素通常只有一种稳定的氧化态。
碱金属的第一电离能较小,很容易失去一个电子,故氧化数为+1。
碱土金属的第一、第二电离能较小,容易失去2个电子,因此氧化数为+2。
在物理性质方面,s区元素单质的主要特点是:轻、软、低熔点。

ds区金属:铜 银 锌 镉 汞一、实验目的l.熟悉铜、银、锌、镉、汞氢氧化物的酸碱性质和热稳定性;2.熟悉铜、银、锌、镉、汞配合物的性质和应用;3.掌握Cu(I)、Cu(II)重要化合物的性质和相互转化条件;4.熟悉Hg22+、Hg2+的转化,了解锌、镉、汞离子的鉴定反应。
二、实验原理铜、银、锌、镉、汞,分别属于ds区IB和ⅡB簇,常见水合离子有Cu2+、Ag+、Zn2+、Cd2+、Hg2+、Hg22+。
Cu(I)在高温或干态时表现稳定,在水溶液中只以一些配离子形式存在。
室温下,Cu2+、Ag+、Zn2+、Cd2+、Hg2+与适量NaOH反应,分别形成Cu(OH)2、Ag2O、Zn(OH)2、Cd(OH)2、HgO,Cu(OH)2在加热时分解生成黑色的CuO。
这些(氢)氧化物中,Zn(OH)2为典型的两性;Cu(OH)2也呈两性,但其碱性大于酸性;Cd(OH)2则主要呈碱性反应,仅缓慢溶于热的浓强碱液中;Ag2O与HgO基本上呈碱性。
Cu2+、Ag+、Zn2+、Cd2+与适量氨水反应时,Cu2+生成相应的碱式盐沉淀。
Ag+生成AgO沉淀,Zn2+、Cd2+生成Zn(OH)2、Cd(OH)2,它们与过量的NH3·H2O 反应都生成氨配合物。
与此不同,在氨水作用下,氯化汞生成氯化氨基汞盐沉淀物,硝酸汞则生成硝酸氨基氧汞。
在有大量铵盐存在时硝酸氨基氧汞可溶于过量NH3·H2O形成氨配合物,但HgNH2Cl不溶于过量NH3·H2O。
HgCl2+2NH3 =Hg(NH2)Cl↓(白色)+NH4Cl2Hg(NO3)2+4NH3+ H2O = HgO·Hg(NH2)NO3↓(白色)+3NH4NO3 Hg22+与过量氨水反应时,同时发生歧化反应,生成氨基汞化合物和汞。
2Hg2(NO3)2+4NH3+H2O = HgO·Hg(NH2)NO3↓+2 Hg↓+ 3NH4NO3Cu2+与I-反应即生成CuI白色沉淀。


ds区金属元素实验报告ds区金属元素实验报告引言:金属元素是化学中的重要组成部分,它们具有良好的导电性、导热性和延展性等特点,广泛应用于工业生产和科学研究中。
本次实验旨在研究ds区金属元素的性质和特点,以期对其应用领域和未来发展方向有更深入的了解。
实验方法:1. 实验器材准备:试剂瓶、试管、电子天平、酒精灯、显微镜等。
2. 实验步骤:a. 依据实验需求,选取ds区金属元素进行研究。
b. 使用电子天平准确称量所需金属元素。
c. 将金属元素置于试管中,加热至一定温度,观察其物理性质变化。
d. 利用显微镜观察金属元素的晶体结构。
e. 进行相关实验数据的记录和分析。
实验结果与讨论:1. 物理性质变化观察:a. 随着温度的升高,金属元素逐渐熔化,并呈现出液态状态。
不同金属元素的熔点各异,这是由其原子结构和相互作用力决定的。
b. 在一定温度范围内,金属元素呈现出流动性和可塑性,可以通过挤压、拉伸等方式改变其形状,这是金属元素的延展性和塑性的表现。
c. 通过显微镜观察,我们可以发现金属元素的晶体结构呈现出规则的排列和重复性,这是由于金属元素中的原子具有相似的尺寸和电子排布特点所致。
2. 实验数据分析:a. 通过实验测得的金属元素的熔点和密度等数据,我们可以对其物理性质进行定量分析和比较,从而了解不同金属元素之间的差异。
b. 结合实验结果和已有的相关知识,我们可以进一步探讨金属元素的导电性、导热性等特点,以及其在电子、材料等领域的应用。
结论:通过本次实验,我们对ds区金属元素的性质和特点有了更深入的了解。
金属元素具有良好的导电性、导热性和延展性等特点,这使得它们在电子、材料等领域有着广泛的应用前景。
未来,我们可以进一步研究和开发ds区金属元素的新型应用,以满足社会发展的需求。
致谢:感谢实验中提供的相关设备和材料,以及指导老师的指导和帮助。
本次实验取得了较好的结果,也让我们对金属元素有了更加深入的认识和理解。

s区、d区、ds区重要元素及其化合物(s Block, ds Block, d Block Elements and Compounds)9.1 s区元素s区元素中锂(Lithium)、钠(Sodium)、钾(Potassium)、铷(Rubidium)、铯(Cesium)、钫(Francium)六种元素被称为碱金属(alkali Metals)元素。
铍(Beryllium)、镁(Magnesium)、钙(Calcium)、锶(Strontium)、钡(Barium)、镭(Radium)六种元素被称为碱土金属(alkaline earth metals)元素。
锂、铷、铯、铍是稀有金属元素,钫和镭是放射性元素。
碱金属和碱土金属原子的价层电子构型分别为ns1和ns2,它们的原子最外层有1~2个电子,是最活泼的金属元素。
9.1.1 通性碱金属和碱土金属的基本性质分别列于表9-1和表9-2中。
表9-1碱金属的性质碱金属原子最外层只有1个ns电子,而次外层是8电子结构(Li的次外层是2个电子),它们的原子半径在同周期元素中(稀有气体除外)是最大的,而核电荷在同周期元素中是最小的,由于内层电子的屏蔽作用较显著,故这些元素很容易失去最外层的1个s电子,从而使碱金属的第一电离能在同周期元素中最低。
因此,碱金属是同周期元素中金属性最强的元素。
碱土金属的核电荷比碱金属大,原子半径比碱金属小,金属性比碱金属略差一些。
s区同族元素自上而下随着核电荷的增加,无论是原子半径、离子半径,还是电离能、电负性以及还原性等性质的变化总体来说是有规律的,但第二周期的元素表现出一定的特殊性。
例如锂的EΘ(Li+/Li)反常地小。
表9-2碱土金属的性质s区元素的一个重要特点是各族元素通常只有一种稳定的氧化态。
碱金属的第一电离能较小,很容易失去一个电子,故氧化数为+1。
碱土金属的第一、第二电离能较小,容易失去2个电子,因此氧化数为+2。
在物理性质方面,s区元素单质的主要特点是:轻、软、低熔点。
实验二十:ds区金属(铜、银、锌、镉、汞)〔实验目的〕1.了解铜、银、锌、镉、汞氧化物或氢氧化物的酸碱性,硫化物的溶解性;2.掌握Cu(Ⅰ)、Cu(Ⅱ)重要化合物的性质及相互转化条件;3.试验并熟悉铜、银、锌、镉、汞的配位能力,以及Hg22+和Hg2+的转化。
〔实验原理〕铜族元素包括铜、银、金,位于周期表ⅠB族;锌族元素包括锌、镉、汞,位于周期表ⅡB 族。
由于铜、锌族元素价电子层构型为(n-1)d10ns1、(n-1)d10ns2,都属ds区,故一并进行讨论。
一、铜族元素已知铜族元素价电子构型为(n-1)d10ns1,铜族元素原子不仅可以失去ns电子,也可进一步失去部分d电子。
因此铜族元素都有+1、+2、+3三种氧化态。
但由于其稳定性不同,铜常见的氧化态为+2,银为+1,金为+3。
1.铜的化合物①Cu(Ⅰ)的化合物:Cu(Ⅰ)的化合物在固态晨稳定性高于Cu(Ⅱ),但在溶液中容易被氧化为Cu(Ⅱ)。
Cu溶液为无色。
几乎所有的Cu(Ⅰ)化合物都难溶于水,其溶解度顺序为:CuCl>CuBr>CuI>CuSCN>CuCN>Cu2S物质颜色溶解性化学性质Cu2O 红色不溶于水。
弱碱性;对热稳定。
CuOH 黄色或橙色不溶于水。
不稳定,生成后立即分解为Cu2O。
CuX 白色CuCl、CuBr、CuI都不溶于水,溶解度按顺序降低Cu2+ + 2Cl- + Cu = 2CuCl→H[CuCl2] CuCl + CO + HCl → Cu(CO)Cl5H2OCu2S 黑色在盐Cu(Ⅰ)中是最小的3Cu2S+16HNO3(浓)=6Cu(NO3)2+4NO+8H2O+3SCu2S + 4CN- = 2[Cu(CN)2]-+ S2-配合物无色溶于水,由于为d10型离子,因此一般为无色。
[Cu(NH3)2]+ + O2→[Cu(NH3)4]+ [Cu(NH3)2]+ + CO → [Cu(NH3)2(CO)]+②Cu(Ⅱ)的化合物:Cu(Ⅱ)为d9构型,它的化合物或配合物因Cu2+可发生d-d跃迁而呈现颜色。
ds区元素(铜、银、锌、镉、汞)的性质【摘要】ds区元素是指元素周期表中的ⅠB、ⅡB两族元素,包括铜、银、金、锌、镉、汞6种自然形成的金属元素和Rg、Uub2种人工合成元素。
ds区的名称是因为它们的电子构型都是d10s1(ⅠB)或d10s2(ⅡB)。
ds区是d区元素的一部分,ds区元素都是过度金属。
但由于它们的d层是满的,所以体现的性质与其他过渡金属有所不同(比如说最高的氧化态只能达到+3)。
【关键字】元素过渡酸碱性;一、实验目的1、掌握铜、锌氢氧化物的酸碱性;2、掌握铜、银、锌、汞的配合物的生成和性质;6、掌握铜、银、锌、汞离子的分离与鉴定方法。
二、实验原理IB IIBCu Zn Cu(+2,+1)Zn(+2)Ag Cd Ag(+1)Cd(+2)Au Hg Au(+1,+3)Hg(+2,+1)蓝色的Cu(OH)2呈现两性,在加热时易脱水而分解为黑色的CuO。
AgOH在常温下极易脱水而转化为棕色的Ag2O。
Zn(OH)2呈两性,Cd(OH)2显碱性,Hg(I, II)的氢氧化物极易脱水而转变为黄色的HgO(II)和黑色的Hg 2O(I)。
易形成配合物是这两副族的特性,Cu 2+、Ag +、Zn 2+、Cd 2+与过量的氨水反应时分别生成[Cu(NH 3)4]2+、[Ag(NH 3)2]+、[Zn(NH 3)4]2+、[Cd(NH 3)4]2+。
但是Hg 2+和Hg 22+与过量氨水反应时,如果没有大量的NH 4+存在,并不生成氨配离子。
如:HgCl 2 + 2NH 3 = Hg(NH 2)Cl↓白+ 2 NH 4Cl Hg 2Cl 2 + 2NH 3 = Hg(NH 2)Cl↓白+ Hg↓黑+NH 4Cl(观察为灰色)Cu 2+具有氧化性,与I -反应,产物不是CuI 2,而是白色的CuI :Cu2++ I -= 2CuI↓白 + I 2将CuCl 2溶液与铜屑混合,加入浓盐酸,加热可得黄褐色[CuCl 2]-的溶液。