有机化学第十三章羧酸衍生物总结
- 格式:ppt
- 大小:990.00 KB
- 文档页数:30


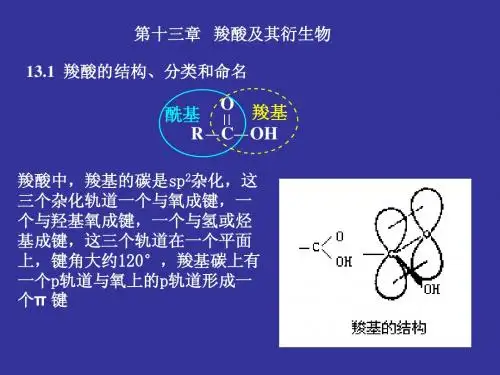



羧酸的衍生反应方程式总结羧酸是一类含有羧基(-COOH)的有机化合物,它们在化学反应中常常经历各种衍生反应。
羧酸的衍生反应方程式既包括它们与其他化合物之间的反应,也包括它们之间的内部反应。
本文将对羧酸的常见衍生反应方程式进行总结,以便更好地理解和应用这些反应。
一、酯化反应酯化反应是羧酸最常见的衍生反应之一,它与醇或酚反应生成酯。
酯化反应的方程式一般如下所示:RCOOH + R′OH → RCOOR′ + H2O其中RCOOH代表羧酸,R′OH代表醇或酚,RCOOR′代表酯,H2O 代表水。
在这个反应中,羧酸中的羧基(-COOH)与醇或酚中的氢氧根离子(-OH)发生酸碱中和反应,生成水,并生成一个酯分子。
二、酰氯化反应酰氯化反应是羧酸中的羧基与氯化物反应生成酰氯的反应。
它的方程式一般如下:RCOOH + SOCl2 → RCOCl + SO2 + HCl其中RCOOH代表羧酸,SOCl2代表硫酰氯,RCOCl代表酰氯,SO2代表二氧化硫,HCl代表盐酸。
在这个反应中,羧酸中的羧基与硫酰氯反应生成酰氯,并产生二氧化硫和盐酸作为副产物。
三、酰溴化反应酰溴化反应是羧酸中的羧基与溴化物反应生成酰溴的反应。
它的方程式一般如下:RCOOH + PBr3 → RCOBr + HBr + POBr3其中RCOOH代表羧酸,PBr3代表溴化亚磷,RCOBr代表酰溴,HBr代表溴化氢,POBr3代表溴化亚磷酸。
在这个反应中,羧酸中的羧基与溴化亚磷反应生成酰溴,并产生溴化氢和溴化亚磷酸作为副产物。
四、酰胺化反应酰胺化反应是羧酸中的羧基与胺反应生成酰胺的反应。
它的方程式一般如下:RCOOH + R′NH2 → RCONHR′ + H2O其中RCOOH代表羧酸,R′NH2代表胺,RCONHR′代表酰胺,H2O 代表水。
在这个反应中,羧酸中的羧基与胺反应生成酰胺,并产生水作为副产物。
五、羧酸的还原反应羧酸在还原剂的作用下可以发生还原反应,将羧基(-COOH)还原为醇(-OH)。



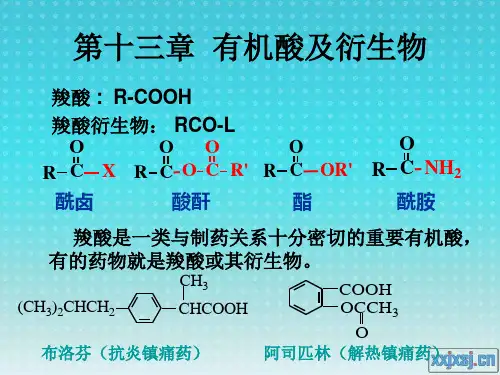

有机化学基础知识点整理羧酸的衍生物与反应羧酸的衍生物与反应羧酸是有机化学中常见的一类化合物,具有羧基(-COOH)的结构特征。
羧酸的衍生物是指通过对羧酸进行化学反应或者取代得到的相关化合物。
羧酸的反应涉及到许多重要的有机合成反应和应用,对于有机化学的学习非常重要。
本文将对羧酸的衍生物以及与之相关的反应进行整理和概述。
一、酯的合成酯是羧酸醇酯化反应的产物,也是羧酸衍生物中使用最广泛的一种化合物。
酯的合成通常通过将羧酸与醇在酸性条件下进行酯化反应而得到。
此反应是通过羧基中的羟基与醇发生酯化反应而形成的,其反应方程式如下所示:羧酸 + 醇→ 酯 + 水酯化反应可以在各种温度下进行,常见的催化剂有硫酸、盐酸等。
酯化反应是有机合成中的重要步骤,能够制备出许多重要的化合物,如乙酸乙酯、苯甲酸甲酯等。
二、酰氯的合成酰氯是羧酸与氯化物反应生成的一种衍生物。
酰氯是有机合成中常用的试剂,可以作为中间体参与进一步的化学反应。
羧酸与氯化物反应生成酰氯的反应方程式如下所示:羧酸 + 氯化物→ 酰氯 + 酸常见的氯化物有氯化亚砜、氯化磷等。
酰氯在合成中起到重要的作用,可以进一步发生亲核取代反应、缩合反应等。
三、酰亚胺的合成酰亚胺是羧酸与胺反应生成的衍生物,分子中含有酰基与氨基。
酰亚胺具有一定的稳定性和活性,可以作为有机化合物的合成中间体。
酰亚胺的反应方程式如下所示:羧酸 + 胺→ 酰亚胺 + 水酰亚胺的合成可以通过将羧酸与胺在酸性条件下反应而得到。
酰亚胺在有机合成中应用广泛,可以进行类似于酯的各种反应。
四、酰胺的合成酰胺是羧酸与氨反应生成的一种衍生物,分子中含有酰基与氨基。
常见的酰胺有酰胺与酰胺。
酰胺的合成通常通过将羧酸与氨在酸性或碱性条件下反应而得到。
酰胺的反应方程式如下所示:羧酸 + 氨→ 酰胺 + 水酰胺是许多药物和生物活性分子的结构基础,也是有机化学中重要的中间体。
综上所述,羧酸的衍生物包括酯、酰氯、酰亚胺和酰胺等,它们在有机合成和应用领域中具有广泛的应用。
有机化学基础知识点整理羧酸衍生物和酰卤化反应羧酸衍生物和酰卤化反应是有机化学中重要的知识点。
本文将对此进行整理和说明,以帮助读者更好地理解和掌握这些概念。
一、羧酸衍生物羧酸衍生物是一类化合物,其分子结构中含有羧酸基(-COOH)。
羧酸基是由羰基(C=O)和羟基(-OH)经过脱水反应得到的。
羧酸衍生物的命名通常以原来化合物的名称加上“酸”的后缀表示。
常见的羧酸衍生物包括酯、酰胺、酰氯、酸酐等。
这些化合物在有机合成和药物化学等领域中具有广泛的应用。
二、酰卤化反应1. 定义和机理酰卤化反应是指羧酸衍生物与卤代烷反应生成相应的酰卤化物。
酰卤化反应的机理是酰基(-COOH)中的羟基被卤原子取代,形成酰卤基(-COX,其中X代表卤素原子)。
2. 较常见的酰卤化反应羧酸与卤代烷反应:羧酸与卤代烷在酸性条件下反应,生成相应的酰卤化物。
反应条件常用到的有硫酸、氯化亚砜等。
酰胺与卤代烷反应:酰胺与卤代烷在碱性条件下反应,生成相应的酰胺卤化物。
反应条件常用到的有氨基氯化亚砜、三甲基溴化膦等。
3. 反应机理酰卤化反应的机理通常涉及到亲核取代反应和脱去质子反应。
以羧酸与卤代烷反应为例,亲核取代反应首先发生,羧酸中的羟基攻击卤代烷中的卤原子;接着,在酸性条件下,脱去质子反应发生,生成稳定的酰卤化物。
4. 应用领域酰卤化反应在有机合成中具有广泛的应用。
酰卤化物可以进一步与其他化合物反应,生成新的有机化合物。
比如,酰卤化物可以与芳香化合物反应,生成酰基取代的芳香化合物;酰卤化物也可以与胺反应,生成酰胺化合物。
5. 注意事项在进行酰卤化反应时,需要注意选择适当的反应条件和催化剂。
不同的羧酸衍生物和卤代烷可能需要不同的反应条件和催化剂来进行反应。
此外,在实验操作过程中,也需要注意个人安全和环境保护。
通过本文的整理和说明,我们对羧酸衍生物和酰卤化反应有了更加清晰的认识。
羧酸衍生物是一类具有羧酸基的化合物,常见的有酯、酰胺、酰氯等;酰卤化反应是羧酸衍生物与卤代烷反应生成相应的酰卤化物,常见的有羧酸与卤代烷反应、酰胺与卤代烷反应等。