噬菌体的分离
- 格式:ppt
- 大小:50.00 KB
- 文档页数:7

噬菌体分离纯化的原理和步骤1. 噬菌体简介好啦,大家,今天我们来聊聊一个有趣又神奇的东西,叫做噬菌体。
听起来像是外星人发明的玩意儿,其实它是一种专门攻击细菌的病毒,简直是细菌界的“灭霸”。
它们在微观世界中偷偷摸摸地工作,悄无声息地解决那些惹人烦的细菌问题。
咱们身边的细菌可不少,有的对我们有益,但有的却是个十足的“败类”。
这时候,噬菌体就像是细菌的天敌,真是太酷了!2. 分离纯化的意义2.1 为何要分离纯化噬菌体?那么,为什么我们要把噬菌体分离和纯化呢?首先,想象一下,如果你在一个大杂烩中找一颗珍珠,那可是相当困难的。
所以我们得把这些小家伙从杂乱的环境中“捞”出来,单独让它们站到聚光灯下。
这样一来,我们就可以更好地研究它们,了解它们是怎么攻击细菌的,有助于开发新的治疗手段,像是抗生素的替代品。
2.2 纯化的重要性再者,纯化的过程就像是给噬菌体洗澡,洗去那些多余的脏东西,只留下最纯粹的样子。
这样才能确保我们研究的数据准确,不然的话,可能会被一些“干扰分子”搞得一团糟。
想想,如果你的咖啡里多了一勺盐,那可就毁了整杯了,不是吗?3. 分离纯化的步骤3.1 收集样本接下来,我们来说说具体步骤。
第一步,得收集样本。
你可以从土壤、水源,甚至是一些腐烂的食物中找到细菌和噬菌体。
这可不是随便捞的,咱得选那些“鱼塘”丰富的地方。
想象一下,像在一片荒野中寻找“金矿”,可是比喻中的“金矿”得小心翼翼,别让细菌给我们添乱。
3.2 培养细菌收集好样本后,我们要把这些细菌培养起来。
通常用一些培养基,就像细菌的“自助餐”。
让它们在温暖的环境中肆意生长,像是细菌的“欢乐派对”。
可是咱可不能忘了,噬菌体也会趁机来“捣乱”,所以这时得时刻盯着它们的动态。
3.3 噬菌体分离一旦细菌培养得差不多了,就可以进行分离了。
这里可以用过滤的方法,把细菌和噬菌体分开。
想象一下,像是在过筛子,把沙子和金子分开,真是一场“筛沙子”的大比拼。
然后把留下来的液体提取出来,这里就大功告成了,噬菌体终于登场了。


噬菌体一、生物学特性噬菌体(Phage)属于非细胞型微生物,是侵染细菌、放线菌等细胞型微生物的病毒。
它们个体微小,通常仅能在电子显微镜下观察到;结构简单,多数噬菌体仅由蛋白质和核酸两种成分组成,蛋白质构成的衣壳包裹着核酸。
在自然界单独存在的噬菌体不表现出生命规象,但具有潜在的生命力。
噬菌体从吸附至宿主细胞上的一瞬间,就开始了自己的生命过程。
根据噬菌体与宿主的关系,可将其分为烈性噬菌体与温和噬菌体。
烈性噬菌体通过吸附、侵人、生物合成、装配与释放等步骤使宿主细胞裂解死亡;而温和噬菌体侵染宿主后,则将其核酸整合在宿主基因组上,并以原噬菌体状态存在,宿主则转为溶原性菌株;但有时也有机率较少的温和噬菌体与烈性噬菌体一样,引起宿主细胞的裂解死亡。
温和噬菌体对溶原状态和裂解途径的选择,取决于感染细胞内的一些宿主基因产物和噬菌体基因产物活性之间的平衡。
[1]噬菌体广泛分布于自然界是与其宿主的广泛分布分不开的。
迄今为止,几乎没有一群细菌尚未发现其相应的噬菌体,只有那些我们了解的还很肽浅的细菌才尚未见其相应噬菌体的报导。
[2] 根据大小、形态结构特征,可以把噬菌体分为3种类型,一是蝌蚪状不可收缩尾的噬菌体,其头部为二十面体,直径约110 -120nm,尾部长220-230 nm,尾宽13-15 nm,无尾鞘、基板、尾丁、尾兹等结构。
二是蝌蚪状可收缩尾的噬菌体,其头部为三十面体,约70nm x 110 nm,尾部长约120 -130 nm,尾宽约18-22nm,有尾鞘、基板、尾丁、尾兹等结构,该噬菌体似有包膜。
三是短尾噬菌体,其头部为二十面体,大小为20 nm,尾部长约2-3 nm。
[3]图1. 噬菌体生活周期二 噬菌体的繁育技术1. 繁殖方式噬菌体为非细胞型微生物,其增殖(复制)方式与细菌的繁殖(二分裂)方式不同,从吸附宿主菌到子代噬菌体的释放是一个爆发的过程,表现为“一步生长”的特点。
一步生长实验于1939年Ellis 和Delbruck 创立,据此可以测知噬菌体在细菌内增殖的潜伏期即每一个细菌产生噬菌体的平均裂解量。

沙门菌烈性噬菌体的分离鉴定及生物学特性的试验马建伟;任慧英;邹玲;刘焕奇;单虎;刘文华【摘要】从商品肉鸭场采集鸭粪及垫料,以实验室保存的沙门菌为宿主菌,采用双层平板法分离到1株烈性噬菌体.对分离到的噬菌体进行纯化、效价测定、裂解谱测定、形态观察,并且进行了最佳感染复数、温度跟pH值稳定性和一步生长曲线的生物学特性研究.结果表明,该噬菌体形成的蚀斑均匀透亮,效价能达到109 PFU/mL 以上,并能裂解多株沙门菌菌株,为宽裂解谱噬菌体,透射电镜显示,该噬菌体为长尾噬菌体;最佳感染复数为0.001;一步生长曲线测定表明,该噬菌体的潜伏期为15 min,暴发期为30 min,暴发量约为320;该噬菌体的温度、pH值耐受性良好;紫外线照射60 min后效价降低3个梯度,由此可见该噬菌体分离株可作为潜在开发的生物消毒剂菌株.【期刊名称】《中国兽医杂志》【年(卷),期】2017(053)006【总页数】4页(P24-27)【关键词】沙门菌;噬菌体;蚀斑;最佳感染复数;一步生长曲线【作者】马建伟;任慧英;邹玲;刘焕奇;单虎;刘文华【作者单位】青岛农业大学动物科技学院,山东青岛266109;青岛农业大学动物科技学院,山东青岛266109;青岛农业大学动物科技学院,山东青岛266109;青岛农业大学动物科技学院,山东青岛266109;青岛农业大学动物科技学院,山东青岛266109;青岛农业大学动物科技学院,山东青岛266109【正文语种】中文【中图分类】S852.61+2沙门菌广泛分布在自然界中,是一种对人和动物有致病性的革兰阴性杆菌。
在兽医临床上沙门菌会引起鸡、鸭、猪、羊等多种动物患病,目前临床上仍以抗生素治疗为主,但抗生素的大量使用导致沙门菌耐药性越来越严重,给养殖业造成了严重的经济损失。
同时沙门菌也是一种重要的食源性致病菌[1-2],是人类健康的一大威胁。
噬菌体是一种能够特异侵染细菌并能将细菌裂解的病毒,噬菌体以自身特定的配体与细菌表面的特定受体结合,沙门菌噬菌体只侵染沙门菌,不会对正常菌群产生影响,并且不受细菌耐药性的限制,在杀死宿主菌的同时能够大量增殖,是一种天然而且安全的杀菌剂。

噬菌体基因组提取方法全文共四篇示例,供读者参考第一篇示例:噬菌体是一类侵染细菌的微生物,其基因组提取方法是研究噬菌体性质和功能的关键步骤之一。
噬菌体基因组提取的目的是获取噬菌体DNA,以便进行后续的分子生物学研究和应用。
本文将系统介绍噬菌体基因组提取的方法及其应用。
一、样品采集在进行噬菌体基因组提取之前,首先需要对需要研究的噬菌体进行样品采集。
样品可以来源于各种环境中的细菌样品,例如水体、土壤、动植物表面等。
在采样时需要注意样品的保存和运输条件,避免对噬菌体DNA的破坏。
二、细胞裂解细胞裂解是基因组提取的第一步,其目的是破坏噬菌体细胞壁和细胞膜,释放出噬菌体DNA。
传统的裂解方法包括化学裂解和物理裂解。
化学裂解使用蛋白酶、SDS等化学试剂破坏细胞结构,物理裂解则是利用高温、高压、超声波等手段使细胞破裂。
近年来,随着生物技术的发展,还出现了新的细胞裂解方法,如离心裂解、酶切裂解等,这些方法具有高效、低成本、易操作等优点。
三、蛋白质和RNA的去除在提取得到的细胞裂解液中,除了目标的噬菌体DNA外还会存在大量的蛋白质、RNA等杂质。
这些杂质会影响后续的DNA纯化和测序分析,因此需要进行去除。
通常采用蛋白酶和RNase酶对裂解液进行处理,将蛋白质和RNA降解分解,然后通过差速离心或柱层析等方法将杂质分离。
四、DNA的纯化经过蛋白质和RNA的去除后,得到的裂解液中含有目标噬菌体DNA。
为了获得纯净的DNA样品,需要进行DNA的纯化。
常见的DNA纯化方法包括酚/氯仿提取、硅胶柱纯化、磁珠分选等。
这些方法可以有效地去除残留的杂质,得到高质量的噬菌体DNA。
五、DNA的测序分析最后一步是对提取得到的噬菌体DNA进行测序分析。
目前,常用的DNA测序技术包括Sanger测序、next-generation sequencing(NGS)和第三代测序技术等。
这些技术可以对噬菌体的基因组结构、功能基因等进行深入的研究和分析,为噬菌体的应用研究提供重要的数据支持。

细菌的噬菌体分型实验二细菌的噬菌体分型第一部分肠杆菌科噬菌体的分离、纯化与增殖噬菌体广泛存在于自然界。
凡是有细菌存在的地方,一般都能找到相应的噬菌体。
例如,土壤、肥料、腐烂有机物、粪便和阴沟污水等常是各种细菌的栖息地,从中能分离到相应的噬菌体。
从自然界分离某一噬菌体需要经过以下步骤:培养宿主菌(或叫做敏感菌);采集含噬菌体的样品;噬菌体富集培养;制备噬菌体裂解液;验证噬菌体的存在;噬菌体的纯化;噬菌体的增殖;噬菌体的效价测定和保存。
下面以大肠杆菌噬菌体为例详细介绍噬菌体的分离和纯化方法。
1( 噬菌体的分离(1)制备菌悬液:取大肠杆菌斜面一支,加4ml无菌水洗下菌苔,制成菌悬液。
(2)增殖培养:于10ml三倍浓缩的肉膏蛋白胨液体培养基的三角烧瓶(1支5ml吸管)中,加入污水样品20ml(1支5ml吸管)与大肠杆菌悬液0.2ml(1支1ml吸管),37?培养12h,24h以增殖噬菌体。
(3)制备裂解液:将以上增殖的混合培养液2500r/min离心15 min(1支5ml吸管)。
将上清液倒入无菌平皿,针管抽取液体,在针栓式滤器上过滤除菌。
所得滤液倒入灭菌瓶内,取少量滤液作无菌试验,即将它接入牛肉膏蛋白胨培养液中(1支5ml吸管、1支1ml吸管、1支无菌带帽华氏管),置于37?培养过夜,以作无菌检查。
(4)噬菌体确证试验:滤液经37?培养过夜,若无细菌生长则表明已经彻底除菌。
需进一步证明噬菌体的存在。
于已烘干的肉膏蛋白胨琼脂平板(平皿1个)表面加一滴大肠杆菌悬液(1支1ml吸管),再用灭菌玻璃涂布器将菌液涂布成均匀的一薄层。
放置数分钟,待琼脂表面干燥,在菌层的表面布点5个,7个,每点滴加上述滤液1小滴(1ml枪1把和枪头10个),同时选择其中一点不加滤液只滴加一小滴生理盐水为对照,再放置数分钟,使液滴被琼脂吸干。
倒置平板,37?培养过夜。
次日观察结果,若平板上滴加滤液的部位出现噬菌斑,而在对照滴中处无噬菌斑,则表明该滤液中肯定含有大肠杆菌相应噬菌体。
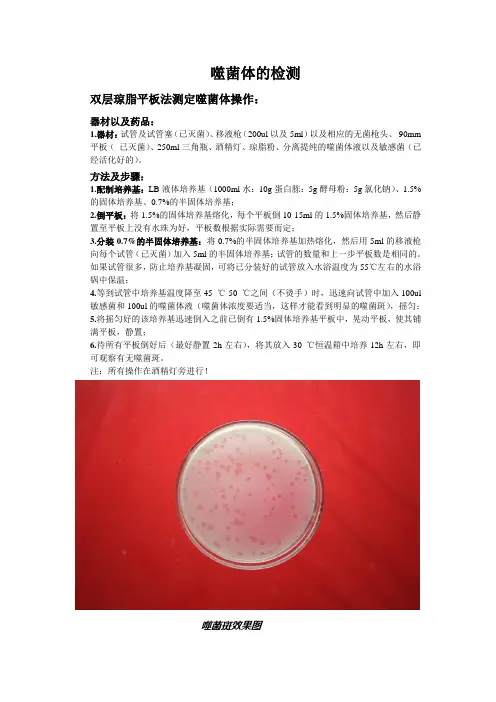
噬菌体的检测双层琼脂平板法测定噬菌体操作:器材以及药品:1.器材:试管及试管塞(已灭菌)、移液枪(200ul以及5ml)以及相应的无菌枪头、90mm 平板(已灭菌)、250ml三角瓶、酒精灯、琼脂粉、分离提纯的噬菌体液以及敏感菌(已经活化好的)。
方法及步骤:1.配制培养基:LB液体培养基(1000ml水:10g蛋白胨:5g酵母粉:5g氯化钠)、1.5%的固体培养基、0.7%的半固体培养基;2.倒平板:将1.5%的固体培养基熔化,每个平板倒10-15ml的1.5%固体培养基,然后静置至平板上没有水珠为好,平板数根据实际需要而定;3.分装0.7%的半固体培养基:将0.7%的半固体培养基加热熔化,然后用5ml的移液枪向每个试管(已灭菌)加入5ml的半固体培养基;试管的数量和上一步平板数是相同的。
如果试管很多,防止培养基凝固,可将已分装好的试管放入水浴温度为55℃左右的水浴锅中保温;4.等到试管中培养基温度降至45 ℃-50 ℃之间(不烫手)时,迅速向试管中加入100ul 敏感菌和100ul的噬菌体液(噬菌体浓度要适当,这样才能看到明显的噬菌斑),摇匀;5.将摇匀好的该培养基迅速倒入之前已倒有1.5%固体培养基平板中,晃动平板,使其铺满平板,静置;6.待所有平板倒好后(最好静置2h左右),将其放入30 ℃恒温箱中培养12h左右,即可观察有无噬菌斑。
注:所有操作在酒精灯旁进行!噬菌斑效果图培养噬菌体的方法:一. 液体培养法1. 将指定之寄主细菌以液体培养法于适当温度下培养,一般培养16~24小时。
2. 将噬菌体原液100 μl 与寄主细菌悬浮液300 μl均匀混合,静置15分钟使其感染。
3. 将混合液接种至含10 ml新鲜液体培养基的试管中,于适当温度下振荡培养约8~24小时,培养时间依噬菌体之不同而异。
4. 将培养液移入离心管中,以10,000 rpm (5,000 g)离心10分钟,以沉淀寄主细菌。
5. 将上清液移至新管中,以0.22μm孔径之过滤器(filter)去除残余菌体,即得不含寄主细菌之噬菌体原液。

噬菌体的分离纯化及一步生长曲线的绘制前言噬菌体是以细菌为寄主的一类非细胞微生物。
目前对于噬菌体的研究大多数集中在人和动物传染性疾病的防治方面,在环境的治理方面的研究报道较少,因此我们试图分离纯化污水中的噬菌体,掌握其生物学性质,应用所得噬菌体处理、净化生活污水,减少生活污水中病原性细菌的危害。
本研究以从小鹅中提取的大肠杆菌为宿主菌,从污水中分离噬菌体并进行纯化,最后绘制一步生长曲线。
1材料与方法1.1材料1.1.1菌种及样品菌种:从小鹅中提取的大肠杆菌,由老师提供。
污水来源:主要来自于农大出水口。
1.1.2试剂1mmol/L CaCl2溶液1.1.3试剂的配制(1) 液体牛肉膏培养基:胰蛋白胨5g,牛肉膏1.5 g,NaCl 2.5g,加H2O至500mL,pH7.4,121 ℃20min高压灭菌。
(2) 3×牛肉膏培养液:胰蛋白陈3g,牛肉膏0.9g,NaCl 1.5g,加H2O 至100mL,pH7.4,121 ℃20min高压灭菌。
(3) 固体牛肉膏培养基:每100mL液体牛肉膏培养基加入1.5g琼脂粉,121 ℃20min高压灭菌。
(4) 半固体牛肉膏培养基:每100mL液体牛肉膏培养基加入0.7g琼脂粉,121℃20min高压灭菌。
1.1.4主要仪器电热恒温培养箱(SHEL·LAB)、电热恒温水温箱(HHW21·Cu600,XMTD)、恒温摇床(中国科学院武汉科学仪器厂)、通风柜(M·TFG-A)、医用净化工作台(苏净集团安泰公司)、台式离心机(eppendorf)、台式高速冷冻离心机(BECKMAN COULTER)、超低温冰箱(Forma Scientific)、YM50全自动不锈钢立式电热蒸汽消毒器、针头式细菌过滤器、0.22μm微孔滤膜(上海市新亚净化器件厂)、微量移液器(GILSON)、UVette(Eppendorf)。
1.2方法1.2.1噬菌体的分离1.2.1.1摇菌老师提供的大肠杆菌液加入5mL1×牛肉膏液体培养基,混合后,37℃振荡(120rpm)14h,此时大肠杆菌达到了对数生长期,取出4℃保存。

大肠埃希氏杆菌噬菌体的分离与纯化【实验目的】1.培养自主查阅资料,自行设计、整理实验方案,自己安排实验的能力。
2.通过综合性大实验进一步掌握微生物实验的基本原理和技术、培养无菌意识。
3.培养互助协作的团队精神和分析解决问题的能力。
4.掌握从污水中分离和纯化大肠埃希氏菌噬菌体的原理。
5.掌握噬菌体的分离与纯化以及用双层琼脂平板法培养噬菌体的方法。
【实验原理】1.凡有寄主细胞存在的地方,一般都能找到其相应的噬菌体。
粪便和阴沟污水等往往是各种肠道细菌尤其是大肠杆菌的栖居地,故常能从其中分离到各肠杆菌噬菌菌株的相应噬菌体。
2.从自然界分离某一噬菌体的一般方法是:(1)培养寄主细胞(大肠杆菌);(2)采集含有相应寄主细胞的噬菌体(阴沟污水);(3)将样品内的细胞进行富集培养;(4)制备噬菌体裂解液;(5)检测噬菌体是否存在;(6)噬菌体的纯化及效价测定。
3.培养基的配制(配方)与灭菌(1)3×牛肉膏蛋白胨培养液:牛肉膏9克,蛋白胨30克,NaCl 15克,自来水1000ml,Ph 7.2-7.4.(2)牛肉膏蛋白胨培养液:牛肉膏3克,蛋白胨10克,NaCl 5克,自来水1000ml,Ph 7.2-7.4.(3)牛肉膏蛋白胨固体培养基:牛肉膏3克,蛋白胨10克,NaCl 5克,琼脂条20克,自来水1000 ml,Ph 7.2-7.4。
(4)牛肉膏蛋白胨琼脂半固体培养基:牛肉膏3克,蛋白胨10克,NaCl 5克,琼脂条7克,自来水1000ml,Ph 7.2-7.4。
封好做好标记于121℃灭菌20min备用【实验材料及器皿】1.菌种:大肠埃希氏菌。
2.噬菌体样品:矛坡的阴沟污水3.培养基:3×牛肉膏蛋白胨培养液,牛肉膏蛋白胨培养液,牛肉膏蛋白胨琼脂培养基,牛肉膏蛋白胨琼脂半固体培养基。
4.仪器:离心机,恒温水浴锅,冰箱,恒温培养箱,高压灭菌锅,酒精灯,量筒,微量移液器及枪头,火柴,接种针,标记笔,无菌涂布棒,培养皿,试管,三角瓶,电热炉,玻璃棒,牛皮纸,纱布,PH试纸,橡皮筋。

细菌噬菌体应该如何检测噬菌体是一类专性寄生于细菌和放线菌等微生物的病毒,其个体形态极其微小,用常规微生物计数法无法测得其数量。
当烈性噬菌体侵染细菌后会迅速引起敏感细菌裂解,释放出大量子代噬菌体,然后它们再扩散和侵染周围细胞,最终使含有敏感菌的悬液由混浊逐渐变清,或在含有敏感细菌的平板上出现肉眼可见的空斑──噬菌斑。
了解噬菌体的特性,快速检查、分离,并进行效价测定,对在生产和科研工作中防止噬菌体的污染具有重要作用。
检样可以是发酵液、空气、污水、土壤等(至于无法采样而需检查的对象,可以用无菌水浸湿的棉花涂拭表面作为检查样品)。
为了易于分离可先经增殖培养,使样品中的噬菌体数量增加。
采用微生物测定法进行噬菌体检测,约需12h左右,因而不能及时判断是否有噬菌体污染。
通过快速检测可大致确定是否有噬菌体污染,以采取必要的防治措施。
根据正常发酵(培养)液离心后菌体沉淀,上清液蛋白含量很少,加热后仍然清亮;而侵染有噬菌体的发酵(培养)液经离心后其上清液中因含有自裂解菌中逸出的活性蛋白,加热后发生蛋白质变性,因而在光线照射下出现丁达尔效应而不清亮。
此法简单、快速,对发酵液污染噬菌体的判断亦较准确。
但不适于溶源性细菌及温合噬菌体的诊断,对侵染噬菌体较少的一级种子培养液也往往不适用。
噬菌体的效价即1mL样品中所含侵染性噬菌体的粒子数。
效价的测定一般采用双层琼脂平板法。
由于在含有特异宿主细菌的琼脂平板上,一般一个噬菌体产生一个噬菌斑,故可根据一定体积的噬菌体培养液所出现的噬菌斑数,计算出噬菌体的效价。
此法所形成的噬菌斑的形态、大小较一致,且清晰度高,故计数比较准确,因而被广泛应用。
检测材料1.菌种敏感指示菌(大肠杆菌)、大肠杆菌噬菌体(从阴沟或粪池污水中分离)2.培养基两倍肉膏蛋白胨培养液,上层肉膏蛋白胨半固体琼脂培养基(含琼脂0.7%,试管分装,每管mL),下层肉膏蛋白胨固体琼脂培养基(含琼脂2%),1%蛋白胨水培养基。

噬菌体的生产工艺主要包括以下几个步骤:
噬菌体的分离:噬菌体感染宿主细胞后,其DNA(或RNA)在细胞体内进行复制、转录,相关基因表达,装配成完整的噬菌体颗粒,最后裂解宿主细胞或通过挤出方式从宿主细胞中释放出来。
因此,在液体培养基中可使浑浊的菌悬液变为清亮或较清亮。
利用噬菌体的这种特性,在样品中加入敏感菌株与液体培养基混合后培养,噬菌体便能大量增殖,释放,从而可分离到特定的噬菌体。
纯化:通过离心、过滤、超滤、凝胶电泳等方法去除杂质和宿主细胞残留,得到纯化的噬菌体。
浓缩:通过高密度离心或超滤等方法对纯化的噬菌体进行浓缩,提高其浓度。
灭活:为了确保噬菌体的安全性,通常需要进行灭活处理,使其失去感染和复制能力。
常用的灭活方法有加热灭活、化学灭活等。
制剂制备:根据需要,将灭活的噬菌体制成不同的剂型,如注射剂、口服剂等。
在整个生产过程中,需要严格控制工艺参数和环境条件,确保产品质量和安全性。
同时,还需要进行质量检测和控制,确保生产的噬菌体符合相关标准和要求。
噬菌体的分离及其寄主细胞的鉴定噬菌体是一种寄生于细菌的病毒,其存在的意义在于调节细菌数量,维持生态平衡。
与其他病毒不同的是,噬菌体的寄主是细菌,而细菌则作为噬菌体的繁殖基质。
因此,了解噬菌体的分离及其寄主细胞的鉴定对于维持微生物群落的稳定,维护人类健康具有重要意义。
一、噬菌体的分离方法噬菌体可以通过两种方法分离:(1)寄主膜破碎法;(2)巨细胞法。
寄主膜破碎法是最常用的噬菌体分离方法,其原理为化学溶解寄主菌的细胞壁和膜,使得噬菌体被释放。
该方法的具体步骤为:(1)将寄主菌接种到培养皿中;(2)加入一定浓度的化学物质,如Tween 80、SDS等,使得细胞壁和膜溶解;(3)离心沉淀,去除寄主菌留下噬菌体。
巨细胞法是一种体外培养细胞法,其原理为在营养缺乏的培养液中,将噬菌体感染到寄主细胞并使其增殖,形成巨细胞,最终分离出噬菌体。
该方法的具体步骤为:(1)通过定量PCR或滴定法测定噬菌体的初始含量;(2)将噬菌体感染到与其适宜的寄主细胞上,培养到合适的时间,直至形成巨细胞;(3)收集巨细胞,离心沉淀,分离出噬菌体。
二、寄主细胞的鉴定方法寄主细胞的鉴定是噬菌体研究中非常关键的一步。
它不仅可以确定噬菌体的寄主范围,还可以研究噬菌体与细菌之间的相互作用和生态响应。
常用的寄主细胞鉴定方法有三种:(1)凝胶探针法;(2)PCR法;(3)无基因片段标记法。
凝胶探针法是一种经典的寄主细胞鉴定方法,其原理为将寄主菌接种到寒暖交替的凝胶中,凝胶中形成的细胞克隆呈现不同的形态,通过寻找与噬菌体作用的细胞克隆,识别寄主细胞。
该方法虽然准确性较高,但需要大量耗时和耗材,难以大量应用。
PCR法是一种简便快速的寄主细胞鉴定方法,其原理为针对细胞壁或内质网上的基因间隔区,设计特异的引物,进行PCR扩增,通过扩增产物的测序或分子量鉴别寻找寄主细胞。
该方法的优势在于对样品的要求低,检测速度快,能够大量应用。
无基因片段标记法是一种新型的寄主细胞鉴定方法,其原理为将受噬菌体感染的细胞进行荧光标记或电化学标记,利用仪器检测关键生化分子的变化,直接寻找寄主细胞。
现代农业科技2021年第8期动物科学摘要噬菌体具有特异性强、无残留、对人畜无感染性、容易筛选获得等独特优势,在无抗养殖趋势下潜力巨大。
本研究从鸡场采集粪便样本,从中分离出大肠杆菌,再从粪便样本中分离、纯化出噬菌体,测定纯化后噬菌体的效价,并对噬菌体的噬菌谱进行研究。
结果表明:噬菌体可以裂解大肠杆菌;分离到的噬菌体为宽宿主谱噬菌体,但有一定的局限性。
关键词噬菌体;大肠杆菌;宿主谱中图分类号S859.1文献标识码A 文章编号1007-5739(2021)08-0183-04DOI :10.3969/j.issn.1007-5739.2021.08.078开放科学(资源服务)标识码(OSID ):Study on Isolation of Escherichia coli Bacteriophage and Its Host SpectrumXU Fangfang 1JIAO Li 2*LI Fenghua 1WANG Yuxia 1LIN Zhiyu 3(1Shandong Xundakang Veterinary Medicine Co.,Ltd.,Jinan Shandong 250316;2Animal Husbandry and Veterinary Department of Cangzhou Polytechnic College,Cangzhou Hebei 061000;3Yantai Tianhua Breeding Co.,Ltd.,Yantai Shandong 264000)Abstract Bacteriophage has the unique advantages of strong specificity,no residue,no infection to human and livestock,easy to screen and so on,which has great potential in the absence of anti breeding trend.In this study,we collected fecal samples from chicken farms,isolated E.coli from them,and then isolated and purified bacteriophages from fecal samples,determined the titer of purified bacteriophages,and studied the bacteriophage spectrum.The results showed that bacteriophage could cleave E.coli ,and bacteriophage isolated had a wide host spectrum,but it had some limitations.Keywords bacteriophage;Escherichia coli ;host spectrum大肠杆菌噬菌体分离及宿主谱研究许方方1焦莉2*李凤华1王玉霞1林治钰3(1山东迅达康兽药有限公司,山东济南250316;2沧州职业技术学院畜牧兽医系,河北沧州061000;3烟台天华饲养有限公司,山东烟台264000)大肠杆菌(Escherichia coli )是健康畜禽肠道中正常存在的菌种,可分为致病性和非致病性2类。
大肠杆菌发酵中强裂解性噬菌体的分离和鉴定陈江坡;程江红;康培;刁刘洋【摘要】:噬菌体在自然界中种类很多,在细菌发酵的工业生产中极易感染噬菌体.从工业苏氨酸生产菌(大肠杆菌M G1655来源)的培养液中分离到一株裂解能力强大的噬菌体,分析其生物学特性并鉴定其种类能够为以后抗性菌株的制备和防止再次感染提供研究基础.采用双层琼脂平板法分离、纯化噬菌体,观察噬菌斑特征,通过电镜观察噬菌体形态特征.分离、纯化获得一株能高效裂解大肠杆菌M G1655的噬菌体.噬菌斑呈圆形、大而透明、边缘整齐.电镜观察噬菌体的头部呈二十面体立体对称,尾部较长.酶切鉴定结果表明噬菌体的核酸类型为dsDNA,确定其属于有尾噬菌体目长尾噬菌体科成员,命名为M HV4.分离鉴定了一株裂解效率极高的大肠肝菌MG1655噬菌体,并确认其为长尾噬菌体科成员,为后续抗噬菌体菌株的筛选和改造奠定基础,并为苏氨酸工业生产提供保障.【期刊名称】《发酵科技通讯》【年(卷),期】2018(047)004【总页数】4页(P209-211,248)【关键词】噬菌体;大肠杆菌MG1655;苏氨酸;生物学特性【作者】陈江坡;程江红;康培;刁刘洋【作者单位】廊坊梅花生物技术开发有限公司,河北廊坊 065001;梅花生物科技集团股份有限公司,河北廊坊 065001;廊坊梅花生物技术开发有限公司,河北廊坊065001;梅花生物科技集团股份有限公司,河北廊坊 065001;梅花生物科技集团股份有限公司,河北廊坊 065001;梅花(上海)生物科技有限公司,上海 201203;廊坊梅花生物技术开发有限公司,河北廊坊 065001;梅花生物科技集团股份有限公司,河北廊坊 065001;梅花(上海)生物科技有限公司,上海 201203【正文语种】中文【中图分类】TQ92噬菌体是一类普遍存在于自然界中的感染细菌并在细菌内完成复制的病毒,数量是细菌的10倍以上[1]。
病理学家Twort和微生物学家D’Herelle在1915年和1917年分别独立发现了噬菌体[2]。
噬菌体的分离和鉴定部分菌株对应的噬菌体分离过程步骤:1、噬菌体分离(1) 以新鲜鸽粪4g 加入100ml 普通液体培养基内,放入37 ℃温箱培养24h。
(2) 次日从中取出10ml70 ℃加热30min ,离心2000r/ 10min ,上清液用滤器过滤后保存于4 ℃冰箱备用。
(3) 在普通琼脂平板底面分别注明1、2、3 号。
(4)在1 号平板接种事先培养好的6h 幼龄菌乙型副伤寒杆菌一接种环;2 号平板接种幼龄菌福氏痢疾杆菌一接种环;3 号平板接种幼龄菌大肠杆菌一接种环,各平板的细菌密集涂布于琼脂平板表面。
(5) 再用无菌接种环取鸽粪培养滤液一接种环,分别滴加于3 个已接种细菌的平板中央,放入37 ℃温箱孵育24h。
2、噬菌体的分离和鉴定先后从农贸市场采集各类海产品158 份, 分别用15 株假单胞菌作指示菌, 共分离到27 株噬菌体, 分离率为1711%。
检出的噬菌体经实验室反复增殖、裂解等鉴定试验, 从中精选出9 株裂解力较强, 生物学性状较典型的噬菌体, 分别用双层琼脂法作单斑纯化培养。
这9 株噬菌体的噬菌斑圆形透明, 边缘有的整齐有的稍不整齐, 直径均在110~21 0 mm; 在电镜下的形态可见有头部和尾部, 均呈蝌蚪状; 增殖液的效价均可达10829pf uˆm l。
3、噬菌体的分离在有指示菌的双层琼脂平板上逐格滴加备用的待检噬菌体液,进行交叉裂解试验,即每一株菌均被所有待检噬菌体液逐一滴加。
待平皿干后,置37 ℃培养过夜。
若有相应的噬菌体存在,即可在平皿上出现裂解噬斑(即为阳性) ,不裂解者为阴性。
对分离到的每一噬菌体均经单噬斑分离纯化3 次以上,增殖后置4 ℃冰箱保存。
4、大连近海河流弧菌Ⅱ噬菌体的分离与研究4.1 材料与方法4.2 菌株噬菌体分离所用的指示菌为河流弧菌29301 , 用于宿主范围测定的菌株共8 株: 河流弧菌Ⅱ9302 , 9401 , 9402 , 9403 , 9404 , 9501 , 9502 及9503 均为本实验室保存。