实验室里研究不同价态硫元素间的转化
- 格式:ppt
- 大小:1.03 MB
- 文档页数:13

《第三节硫的转化》导学案实验室里研究不同价态硫元素间的转化学习目标1、通过在实验室探究不同价态硫元素之间的相互转化,能够运用氧化还原反应寻找合适的氧化剂和还原剂,实现不同价态硫元素之间的相互转化。
2、二氧化硫是酸性氧化物,具有酸性氧化物的通性,还具有氧化性和还原性,能够与氧气、氯水、硫化氢等物质发生反应,另外还具有漂白性,能使品红等有色物质褪色。
3、通过硫元素在生产、生活中转化的实例,了解酸雨的危害,能够提出减少向大气中排放二氧化硫的措施。
实验报告☆实验目的:探究硫元素不同价态间的转化关系。
☆实验预测:硫元素常见的化合价有,不同价态间的硫元素可以相互转化,寻求合适的氧化剂或还原剂来实现0价、+4价、+6价硫元素之间的转化。
☆知识准备:1、选择下列三种价态S元素的代表物质0价:+4价:+6价:2.研究该转化的理论依据。
3.SO2气体可以由亚硫酸钠和浓硫酸反应来制备。
4.SO2能使品红溶液褪色,可以用这一性质来检验SO2。
5.常见的氧化剂有:酸性高锰酸钾溶液,氯水,溴(Br2)水、硝酸、浓硫酸、氧气等。
常见的还原剂有:C、CO、H2、H2S,KI,金属单质(Cu、Fe…)等。
☆设计要求:1.方案设计时先个人思考,然后小组讨论形成。
2.设计方案时要先明确用什么试剂来实现该转化。
再考虑如何操作还要考虑如何才能判断是否实现了这一转化。
3.设计的方案尽量减少环境污染(二氧化硫,硫化氢有毒)要考虑尾气处理。
提供试剂:硫黄,亚硫酸钠,浓硫酸,氢硫酸,氢氧化钠溶液。
酸性高锰酸钾,KI溶液,酚酞,氯化钡溶液,碘水,品红溶液,铜片,溴水。
1、二氧化硫的性质⑴物理性质:通常状况下,二氧化硫是一种色,味毒的气体,易溶于水(1:40),容易液化(沸点-10℃)密度比空气大。
⑵化学性质:①酸性氧化物的通性:与碱溶液(如氢氧化钠溶液)反应,化学方程式与水反应化学方程式②氧化性:如与H2S气体反应。
化学方程式③还原性:如与氧气反应。

硫的转化第2课时不同价态硫元素间的转化酸雨及其防治【学习内容】一.实验室里研究不同价态硫元素间的转化(一)预测不同价态硫元素的性质价态性质-2价的S0价的S+4价的S+6价的S(二)硫的几种常见的化合物1、SO2的性质A:物理性质:二氧化硫是一种色气味的毒气体,易溶于水且生成,说明二氧化硫是一种氧化物。
B化学性质:(1)酸性氧化物(与CO2性质相似)SO2+H2O===(是它的酸酐)SO2+NaOH===+(SO2少量)SO2+NaOH===(SO2过量)(2)氧化性:SO2→S(3)还原性:SO2→SO42-(4)漂白性:现象:将SO2通入品红溶液后,品红溶液很快变为溶液。
再加热后,无色溶液又重新恢复为色。
原理:。
总结]总结学过的有漂白性的物质,并分析它们的漂白原理有何不同?迁移应用]①将SO2通入到紫色石蕊试液中,褪色,而将Cl2通入到紫色石蕊试液中,先,后。
②将等物质的量的SO2和Cl2的混合气体通入到品红试液中,发现品红并不褪色。
解释其原理。
2、浓H2SO4的性质A:物理性质:通常浓硫酸是无色油状液体,难挥发,与水以任意比混溶,溶解时放出大量热。
(稀释浓硫酸时应将浓硫酸沿容器内壁缓缓注入水或溶液中,并用玻璃棒不断搅拌。
)B:化学性质:(1)强氧化性①与金属的反应浓H2SO4+Cu△++思考](1)此反应中表现了浓H2SO4的什么性质?氧化剂与还原剂的物质的量之比是多少?(2)反应规律:浓H2SO4+金属△++合作探究]常温下,为何盛浓H2SO4的容器可以用铁(铝)制品?②与非金属的反应浓H2SO4+C△++思考]1.在此反应中浓H2SO4表现了什么性质?2.浓H2SO4、稀H2SO4的氧化性有何不同?(2)吸水性将浓H2SO4放置在空气中,其质量会。
所以,可以用浓H2SO4来干燥、气体。
(3)脱水性浓硫酸把蔗糖、木屑、纸屑和棉花等物质中的有机物按水分子中氢氧原子数的比(2∶1)夺取被脱水物中的氢原子和氧原子。







不同价态含硫物质的转化教学设计引言在化学教学中,含硫物质的转化是一个重要的内容。
硫元素在自然界中广泛存在,我们身边的很多物质都含有硫。
通过了解含硫物质的不同价态,能够更好地理解化学反应的过程和机理。
本文将就如何设计一堂关于不同价态含硫物质的转化的教学活动进行探讨。
一、探究含硫物质的不同价态1. 硫元素的价态硫元素可根据与其他元素的化合物中所呈现的氧化态的不同而分为不同的价态,如+2、+4和+6等。
在日常生活中,我们接触到的含硫物质也有不同的价态。
2. 含硫物质的实验观察通过在实验室中进行一系列实验观察,可以让学生直观地感受到含硫物质在不同反应条件下的转化过程,从而理解不同价态的含硫物质。
实验1:硫的氧化 1. 将一定量的硫粉加入干净的试管中; 2. 加入氧气并点燃硫粉; 3. 观察硫粉的颜色变化。
实验2:亚硫酸钠和过氧化氢的反应 1. 将一定量的亚硫酸钠溶液倒入试管中; 2. 加入少量的过氧化氢溶液; 3. 观察反应产物的颜色变化。
实验3:亚硫酸钠和氯气的反应 1. 将一定量的亚硫酸钠溶液倒入试管中; 2. 加入氯气; 3. 观察反应产物的颜色变化。
3. 实验结果的讨论通过对实验结果的讨论,引导学生思考不同反应条件下,含硫物质的价态转化过程。
可以进行以下讨论:1.硫粉燃烧时,硫的价态如何改变?2.亚硫酸钠和过氧化氢反应时,亚硫酸钠的价态如何改变?3.亚硫酸钠和氯气反应时,亚硫酸钠的价态如何改变?二、不同价态含硫物质的转化反应1. 原理概述通过前面的探究,学生对含硫物质的不同价态有了一定的了解。
接下来,我们将探讨不同价态含硫物质的转化反应。
2. 实验演示为了帮助学生更好地理解不同价态含硫物质的转化,可以进行以下实验演示:实验4:二氧化硫的氧化 1. 取一只试管,加入二氧化硫气体; 2. 加入酸性高锰酸钾溶液; 3. 观察气体和产物的变化。
3. 实验结果的讨论通过观察实验结果、产物的性质和反应条件的变化,引导学生进行以下讨论:1.二氧化硫气体与酸性高锰酸钾溶液反应时,二氧化硫的价态如何改变?2.反应产生的产物的性质如何?三、含硫物质的应用与环境问题1. 含硫物质的应用学生通过对含硫物质的不同价态及其转化的学习,可以了解到含硫物质在日常生活和工业中的广泛应用。
不同价态硫元素的转化课前预习学案【预习目标】1.以价态变化为主线,初步了解不同价态硫元素之间的转化关系2.运用氧化还原反应原理寻找合适的氧化剂和还原剂,预测不同价态硫元素之间的相互转化。
3.从物质分类的角度认识二氧化硫的性质【预习过程】解决下列问题一.硫的常见化合价及其所对应的物质S的常见价态常见的物质性质(氧化性还原性)-2价0价+4价+6价二.课前设计【实验活动探究】☆实验目的:探究硫元素不同价态间的转化关系。
☆知识准备:1、选择下列三种价态S元素的代表物质0价: +4价: +6价:2.研究该转化的理论依据。
3.常见的氧化剂:________________________________________常见的还原剂:_____________________________________________4.SO2能使品红溶液褪色,可以用这一性质来检验SO2。
5.SO2气体可以由亚硫酸钠和浓硫酸反应来制备。
☆设计要求:a.方案设计时先个人思考,然后小组讨论形成。
b.设计方案时要先明确用什么试剂来实现该转化。
再考虑如何操作还要考虑如何才能判断是否实现了这一转化。
c.设计的方案尽量减少环境污染(二氧化硫,硫化氢有毒)要考虑尾气处理。
☆提供试剂:硫化钠,亚硫酸钠,浓硫酸,稀盐酸,氢硫酸,氢氧化钠溶液,酸性高锰酸钾,氯水,酚酞,氯化钡溶液。
☆实验设计及预测:不同价态间的硫元素可以相互转化,寻求合适的氧化剂或还原剂来实现0价、+4价、+6价硫元素之间的转化并预测现象。
转化选择试剂操作方案预测现象+4→0+4→+6+6→+4☆.小组讨论优选实验设计方案三.从物质分类的角度解决下列问题1.在物质的分类中SO2属于什么类型?根据其所属有哪些化学性质2.稀硫酸有哪些化学性质?写出下列反应的离子方程式不同价态硫元素的转化课堂探究学案【学习目标】1.以价态变化为主线,了解不同价态硫元素之间的转化关系2.学会从价态的角度认识物质的化学性质3.掌握代表物质二氧化硫、浓硫酸的性质【过程与方法】:以价态变化为主线,了解不同价态硫元素之间的转化关系【情感态度与价值观】能力目标:培养学生探究、观察、思考、判断的能力情感目标:通过实验探究激发学生兴趣和热情,体验科学探究的乐趣。
【同步实验课】 不同价态含硫物质的转化【实验目的】1.通过实验加深对硫及其化合物性质的认识。
2.应用氧化还原反应原理实现不同价态含硫物质的转化。
【实验原理】2 Na 2S + 3H 2SO 3== 3S ↓+ 3H 2O+2Na 2SO3 ; Cu +2H 2SO 4(浓)CuSO4+SO 2↑+2H 2O5S 2+2Mn O 4-+16H +==== 2M n 2++8H 2O +5S↓; Fe + S FeS【实验试剂】浓硫酸、铜片、硫粉、铁粉、Na 2S 溶液、酸性KMnO 4溶液、NaOH 溶液、H 2SO 3溶液、品红溶液。
【实验仪器】试管、天平、量筒、酒精灯、铁架台、试管架、橡胶塞、乳胶管、胶头滴管、玻璃导管、石棉网(或陶土网)、玻璃棒、药匙、棉花、镊子、火柴。
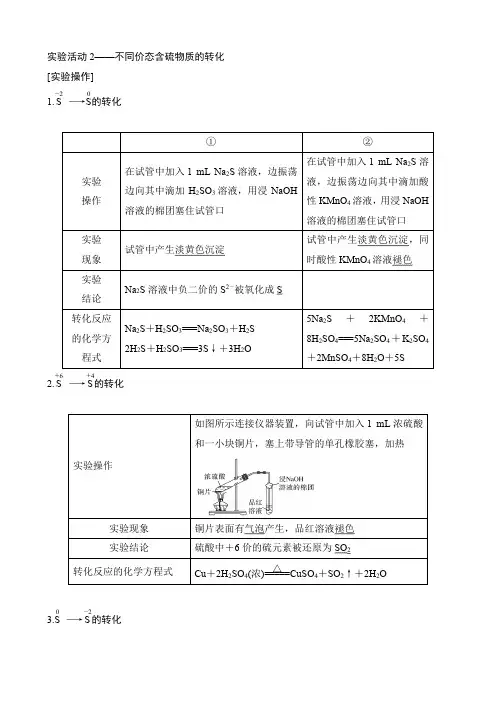
【实验一】Na 2S 的还原性实验操作图解操作实验现象 实验结论 (1)在试管中加入1mL N a 2S 溶液,边振荡边滴加H 2S O 3溶液,用浸NaOH 溶液的棉团塞住试管口,观察并记录实验现象。
(2)在试管中加入1mL N a 2S 溶液,边振荡边滴加酸性KMnO 4溶液,用浸NaOH 溶液的棉团塞住试管口,观察并记录实验现象。
1.滴加H 2SO 32.出现黄色沉淀 ,棉团塞住试管口1.滴加KMnO 4,出现黄色沉淀,棉团塞住试管口产生淡黄色沉淀。
溶液紫红色褪去,产生淡黄色沉淀。
2 Na 2S + 3H 2SO 3=3S ↓+3H 2O+2Na 2SO 35S 2+2MnO 4-+16H += 2Mn 2++8H 2O+5S↓ S 元素化合价变化 2价S 具有还原性,+4价S 表现氧化性。
【实验二】验证浓硫酸的氧化性实验操作图解操作实验现象实验结论△ △01实验梳理 02实验点拨 03典例分析 04对点训练 05真题感悟如上图所示连接仪器装置,向试管中加入1mL浓硫酸和一根铜丝,塞上带导管的单孔橡胶塞,加热,观察并纪录实验现象。
实验七:不同价态硫元素间的转化
一、实验目的:
1.探究不同价态硫元素之间的相互转化,了解不同价态硫元素的氧化性和还原性;
2.归纳二氧化硫和浓硫酸的主要性质;
3.培养运用所学知识设计实验方案的能力、操作能力、观察能力、实验归纳能力;
4.体会实验探究过程,激发学习化学的兴趣。
二、实验用品:
仪器和装置:
烧杯、试管、酒精灯、导管、玻璃棒、胶头滴管、弹孔橡皮塞、铁架台、药匙、橡皮管,坩埚、三脚架、石棉网等
试剂和材料:
硫粉、亚硫酸钠固体、浓硫酸、浓盐酸、酸性高锰酸钾溶液、氯水、稀硝酸(体积比为1:10)、稀盐酸(体积比为1:10)、双氧水、硫化钠溶液(1mol/L)、稀硫酸、品红溶液、碘粒、饱和氢硫酸、氯化钡溶液(质量比为1:40)、铜片、铁粉、铜粉、二氧化锰。
三、实验原理:
四、实验步骤:
五、注意事项
1.要保证每个实验的实验环境不受污染,如不存在其他实验产生的二氧化硫、氯气等;
2.在做铁与硫的反应、铜与硫的反应时,混合物要置于坩埚内,不可置于试管中,温度过高,试管易炸裂;硫粉要过量,尽量保证反应进行的完全。
3.尽量用现制的氯气、硫化氢等,而不取用氯水,饱和硫化氢等。
4.本组实验在进行当中,有氯气、二氧化硫等有毒气体产生,注意要在通风橱中操作。
5.取用浓硫酸,浓盐酸,浓硝酸时注意安全。
六、整理与归纳。