高一化学不同价态硫元素间的转化
- 格式:ppt
- 大小:548.00 KB
- 文档页数:10



硫元素不同价态化合物的转化
硫元素具有多种不同价态,包括硫化氢(H2S)、二氧化硫(SO2)、三氧化硫(SO3)等。
这些化合物在生产和生活中广泛应用,因此对它们之间的转化及其反应机理有着重要的研究价值。
本文将介绍硫元素不同价态化合物的转化过程及相关的反应机理和应用。
1、硫化氢反应
硫化氢(H2S)是一种无色有毒的气体,主要应用于化学工业、冶金工业和医药工业等领域。
硫化氢可以通过以下反应进行制备:
FeS + 2HCl → FeCl2 + H2S
此反应可用于制备纯净的硫化氢气体,还可以用于分析化学中的气体定量分析。
另外,硫化氢还可以通过以下反应进行氧化反应:
此反应可以用于除臭和净化空气等领域。
另外,二氧化硫还可以与碱金属反应生成硫酸盐:
此反应可以用于制备碱性硫酸盐,常应用于纺织、造纸和食品等行业。
三氧化硫(SO3)是制备硫酸的重要中间体,也是制备其他化学品的重要原料。
它可以通过以下反应制备:
2SO2 + O2 → 2SO3
此反应可用于制备纯净的三氧化硫,其中V2O5是催化剂。
SO3在工业生产中,通常是在氧气的催化下合成的。
由于SO3的不稳定性和强腐蚀性,它必须与其他传热介质混合使用。
总结
硫元素的不同价态化合物在工业生产和生活中得到了广泛应用。
在这些化合物之间进行反应转化的研究,对于生产高质量产品、保护环境和人类健康等方面有着重要的作用。
不同硫化合物的反应机理及其应用也是未来研究的重点之一。
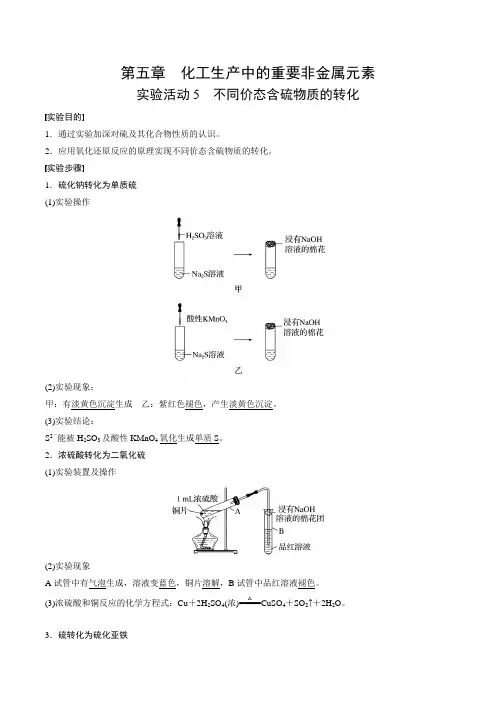
第五章 化工生产中的重要非金属元素实验活动5 不同价态含硫物质的转化实验目的1.通过实验加深对硫及其化合物性质的认识。
2.应用氧化还原反应的原理实现不同价态含硫物质的转化。
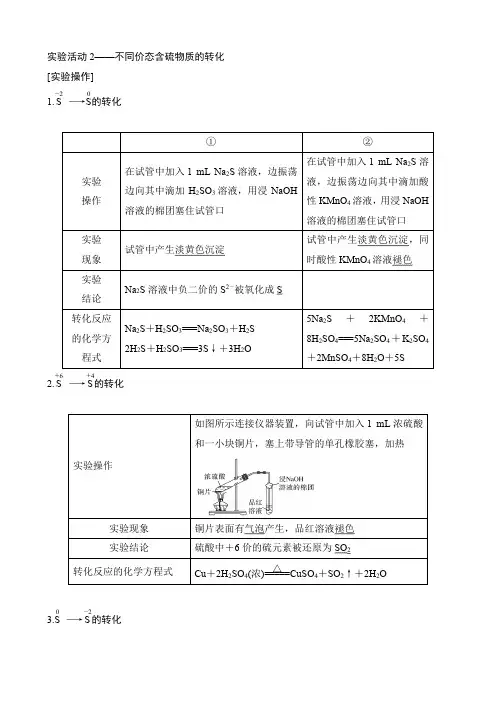
实验步骤1.硫化钠转化为单质硫 (1)实验操作(2)实验现象:甲:有淡黄色沉淀生成 乙:紫红色褪色,产生淡黄色沉淀。
(3)实验结论:S 2-能被H 2SO 3及酸性KMnO 4氧化生成单质S 。
2.浓硫酸转化为二氧化硫 (1)实验装置及操作(2)实验现象A 试管中有气泡生成,溶液变蓝色,铜片溶解,B 试管中品红溶液褪色。
(3)浓硫酸和铜反应的化学方程式:Cu +2H 2SO 4(浓)=====△CuSO 4+SO 2↑+2H 2O 。
3.硫转化为硫化亚铁(1)实验装置及操作(2)实验现象:混合物继续保持加热,最后生成黑色固体。
(3)硫粉和铁粉反应的方程式:Fe +S=====△FeS 。
【问题】1.在上述实验中,含硫物质中硫元素的价态发生了怎样的变化? 答案:转化前的含硫物质转化后的含硫物质价态变化 Na 2S S -2→0 H 2SO 3 S +4→0 H 2SO 4 SO 2 +6→+4 SFeS0→-22.实验1中用浸有NaOH 溶液的棉花团塞住试管口的作用是什么? 答案: 吸收实验过程中可能产生的有毒气体硫化氢和二氧化硫。
3.铁粉与硫粉在空气中混合燃烧时,可能发生哪些反应?答案: ①S +O 2=====△SO 2 ②Fe +S=====△FeS ③3Fe +2O 2=====△Fe 3O 4。
【例题讲解】1.在一定条件下进行的下列化学反应,已知A 、B 、C 中均含有同种元素,则下列对应物质不正确的是选项 A 物质 B 物质 C 物质 D 物质 A NaOH 溶液 Na 2CO 3溶液 NaHCO 3溶液 CO 2 B Fe FeCl 2 FeCl 3 Cl 2 C AlCl 3溶液 Al(OH)3 NaAlO 2溶液 NaOH 溶液 DH 2SSSO 2O 2【答案】B【解析】【详解】A.若A为NaOH溶液,D为CO2,则NaOH可与CO2反应生成Na2CO3,Na2CO3可与H2O 和CO2反应生成NaHCO3,NaOH可与NaHCO3反应生成Na2CO3,故A正确;B.若A为Fe,D为Cl2,则Fe 与Cl2反应生成FeCl3而不是FeCl2,故B错误;C.若A为AlCl3溶液,D为NaOH溶液,则AlCl3可与NaOH反应生成Al(OH)3,Al(OH)3可与NaOH反应生成NaAlO2,AlCl3可与NaAlO2反应生成Al(OH)3,故C 正确;D.若A为H2S,D为O2,则H2S可与O2反应生成S,S可与O2生成SO2,H2S可与SO2生成S,故D正确;故选:B。


第2节硫的转化第1课时不同价态硫元素之间的转化[核心素养发展目标] 1.了解含硫物质在自然界中的存在与转化过程,并能通过实验探究了解不同价态含硫物质的相互转化,增强科学探究与创新意识。
2.能从物质类别和化合价的角度认识硫、二氧化硫、三氧化硫的性质,并能设计实验进行验证,分析、解释有关的实验现象,培养证据推理和模型认知能力。
一、自然界中的硫1.自然界中不同价态硫元素之间的转化(1)硫的存在①自然界中游离态的硫存在于火山口附近或地壳的岩层里,煤中也含有少量硫。
②自然界中化合态的硫广泛存在于硫酸盐、硫化物、火山喷发时释放的气体中、地下水里、动植物体内。
(2)自然界中不同价态硫元素间的转化(3)不同类别含硫物质中硫元素的化合价硫元素化合价物质类别氢化物单质氧化物含氧酸含氧酸盐+6 --SO3H2SO4Na2SO4+4 --SO2H2SO3Na2SO30 -S ----2 H2S ----2.认识硫单质(1)物理性质①单质硫俗称硫黄,是一种黄色或淡黄色的固体,很脆,易研成粉末; ②不溶于水,微溶于酒精,易溶于二硫化碳; ③熔点和沸点都不高。
(2)同素异形体①概念:由同一种元素组成的性质不同的几种单质。
②硫的同素异形体有多种,如正交硫和单斜硫等。
③常见非金属元素的同素异形体:金刚石和石墨、白磷和红磷、O 2和O 3等。
(3)硫的性质实验探究实验操作实验现象 用灼热的玻璃棒触及一端,当混合物呈红热状态后,移开玻璃棒,混合物继续保持红热,最终生成黑色固体 熔化后的硫粉在氧气中燃烧,发出蓝紫色火焰,同时可闻到刺激性气味 实验结论 该反应为放热反应,反应生成黑色的硫化亚铁(FeS) 硫能够在氧气中燃烧,反应生成二氧化硫(SO 2)(4)化学性质①写出下列反应的化学方程式②硫与热碱液反应生成金属硫化物和亚硫酸盐。
如3S +6NaOH=====△2Na 2S +Na 2SO 3+3H 2O ,该反应中硫体现氧化性和还原性。

硫的价态转化及方程式
以《硫的价态转化及方程式》为标题,本文将详细介绍硫的价态转化及其表示方法。
硫元素可以以多种价态存在,它们之间可以通过一系列的反应进行转变。
除了原子态外,硫还可以呈现出-2、0、+2、+4、+6的价态,且这些价态都可以通过多种反应实现转化,以及用于许多实验中。
硫在0价态下可以与氢气或水反应,形成亚硫酸根和升硫酸根,这一反应的方程式可以表示如下:
2HS- + H2 2H2S
2HS- + H2O S + 2OH- + H2
硫在-2价态下可以与氧气反应,形成硫酸,该反应的方程式可以表示如下:
2S2- + O2 2SO4-
硫在+2价态下可以与氧气反应,形成硫酸根,该反应的方程式如下:
2S2+ + O2 2SO3
硫在+4价态下可以与氯气反应,形成硫酰氯,这一反应的方程式可以表示为:
2S2+ + Cl2 2SO2Cl
此外,硫以+6价态存在时,可同氧气反应,生成亚硫酸,其方程式为:
2S2+ + O2 2SO3-
以上就是硫的几种价态转化及相应的方程式。
从以上可以看出,硫的价态转换是由不同的反应和反应条件来决定的,这些反应方程式也为进一步研究硫的性能提供了基础。
硫元素的价态转换是物理和化学方面研究的重要课题,从不同价态可以观察出硫的毒性、腐蚀性以及生物作用能力。
在环境污染领域也有重要的意义。
比如,硫的价态转换可以检测污染源的种类和浓度,以及有效地控制污染物的活性状态。
综上所述,硫的价态转换是物理、化学和生态方面的重要内容,对于提高环境保护和检测污染源也有重要的意义。
此外,硫的价态转换及方程式是有效地研究硫性质和功能的基础。



硫及其化合物之间的转化一、硫的转化关系1.自然界中不同意价态硫元素间的转化2.常见含硫的物质的转化3.硫的化合价与性质的关系二、不同价态硫的化合物的转化(1)价态与性质①- 2价硫处于最低价态,只有还原性,可被O、Cl2等氧化剂氧化为S;②0价、+4价硫处于中间价态,既有氧化性又有还原性;③+6价硫处于最高价态,只有氧化性。
(2)价态变化规律当硫元素的化合价升高或降低时,一般升高或降低到其相邻的价态,即台阶式升降,如:(3)含硫物质的连续氧化注:请完成下列关系图中序号对应的化学方程式(注明反应条件)典例剖析(2020·安徽省明光中学高一月考)物质的类别和核心元素的化合价是研究物质性质的两个重要角度。
请根据如图所示,回答下列问题:(1)Y的化学式为__________________(2)气体X和气体Y混合产生淡黄色的烟,写出该反应的化学方程式________。
(3)欲制备Na2S2O3,从氧化还原角度分析,合理的是______(填序号)。
a.Na 2S +Sb.Na 2SO 3+Sc.Na 2SO 3+Na 2SO 4d.SO 2+Na 2SO 4 (4)如图为铜丝与W 的浓溶液反应并验证其产物性质的实验装置。
①反应①中体现的浓硫酸的化学性质是________。
想要立即终止①的反应,最恰当的方法是__________。
a.上移铜丝,使其脱离溶液 b.撤去酒精灯 c.拔去橡胶塞倒出溶液 ②装置④中品红溶液的作用是________,棉花团的作用__________。
③反应停止后,待装置冷却,把③取下后向其中加入氯水,观察到白色沉淀生成,写出相关反应的离子方程式__________。
精选习题1.(2020·大庆外国语学校高一月考)下列气体不能用浓硫酸干燥的是( ) A .H 2B .H 2SC .SO 2D .Cl 22.(2020·山东省微山县第二中学高一月考)下列说法正确的是( )A .单质2O+−−−→氧化物2+H O−−−→酸或碱+NaOH HCl −−−−−→或盐,铁单质可以按上述关系进行转化B .若a 、b 、c 分别为S 、SO 3、H 2SO 4,则可以通过一步反应实现如图所示的转化C .太阳能电池板中的硅在元素周期表中处于金属与非金属的交界位置D .单质硅常用于制造光导纤维3.(2020·安徽省屯溪一中高一开学考试)如图所示是一系列含硫化合物的转化关系(反应中生成的水已略去),其中说法正确的是A.反应①说明SO2具有漂白性,反应②说明SO2具有酸性B.反应②中生成物n(Na2SO3):n(NaHSO3)=1:1时,则反应物n(SO2):n(NaOH)=1:2 C.反应③④⑤均属于氧化还原反应D.工业上可利用反应②和反应④回收SO24.(2020·甘肃省张掖市第二中学高一开学考试)A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如图(部分反应条件及产物略去)。
不同价态含硫物质的转化含硫物质是指其中所含的主要化学元素为硫的化合物。
在不同价态下,含硫物质的化学性质也不尽相同。
下面就来介绍一下含硫物质不同价态下的转化情况。
一、硫氧化物的转化1、二氧化硫的转化在高温条件下,二氧化硫可被还原成硫化氢,如下面的化学反应所示:SO2 + 2H2S → 3S + 2H2O而当存在过量的氧气时,则会发生下面的化学反应:2SO2 + O2 → 2SO3SO3 + H2O → H2SO4由此可见,二氧化硫可同时被还原和氧化,从而形成硫化氢和硫酸。
2、三氧化硫的转化三氧化硫在高温下可分解为二氧化硫和氧气,如下反应式:2SO3 → 2SO2 + O2此外,三氧化硫还可以被水蒸气还原成二氧化硫和水:SO3 + H2O → H2SO4二、不同硫酸盐的转化1、硫酸亚铁的转化硫酸亚铁(FeSO4)如果在空气中放置很长一段时间,会逐渐氧化成硫酸铁(Fe2(SO4)3)。
同时,如果将其在氧气条件下加热,也会发生同样的氧化反应。
2、硫酸钠的转化硫酸钠(Na2SO4)和氢氧化钠(NaOH)在适当的条件下可以发生置换反应,生成硫酸氢钠(NaHSO4)和氢氧化钠(NaOH):Na2SO4 + 2NaOH → 2Na2O + H2SO42Na2O + CO2 → 2Na2CO33、硫酸铜的转化硫酸铜(CuSO4)如果加热到500℃以上就会发生分解反应,生成氧化铜(CuO)和二氧化硫(SO2):CuSO4 → CuO + SO2 + 1/2O24、硫酸钙的转化硫酸钙(CaSO4)在高温条件下可分解为次氟酸(HF)和二氧化硫(SO2),如下所示:Ca SO4 → CaF2 + SO2 + 1/2O2以上就是含硫物质不同价态转化的相关内容。
可能比较枯燥,但具有一定的学术价值。
不同价态含硫物质的转化化学方程
不同价态含硫物质之间的转化涉及到多个化学反应。
以下是一些常见的含硫物质转化及其化学方程式:
硫化氢(H2S)与二氧化硫(SO2)的反应:
H2S + SO2 = 3S + 2H2O
这个反应中,硫化氢和二氧化硫反应生成硫和水。
硫与氧气的反应,生成二氧化硫:
S + O2 = SO2
这个反应中,硫在氧气中燃烧生成二氧化硫。
二氧化硫与氧气的反应,生成三氧化硫(SO3):
2SO2 + O2 = 2SO3
这个反应中,二氧化硫在氧气中进一步氧化生成三氧化硫。
三氧化硫与水的反应,生成硫酸(H2SO4):
SO3 + H2O = H2SO4
这个反应中,三氧化硫与水反应生成硫酸。
硫酸与氢氧化钠的反应,生成硫酸钠(Na2SO4)和水:
H2SO4 + 2NaOH = Na2SO4 + 2H2O
这个反应中,硫酸与氢氧化钠发生中和反应生成硫酸钠和水。
这些反应展示了不同价态含硫物质之间的转化关系。
需要注意的是,这些反应的条件和产物可能会受到反应条件(如温度、压力、催化剂等)的影响而有所变化。
因此,在实际应用中,需要根据具体情况选择合适的反应条件和反应方程式。