t
v
V(正)
原平衡 V(逆)
V’ (逆) 新平衡 V’ (正)
0
t
减小反应物的浓度
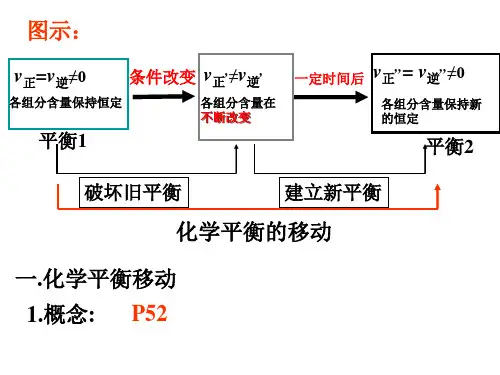
1. 浓度变化对化学平衡的影响
1)结论:在其它条件不变的情况下,增加反应 物的浓度(或减少生成物的浓度),平衡向正反应 方向移动; 反之,增加生成物的浓度(或减少反应物的浓 度 ),平衡向逆反应方向移动。
2)意义:
(衡3正)向通移入动N2,; c保(C持O密2) 闭容减器小压强和。温度不变,则平
课堂练习
2.恒温下, 反应aX(g) bY(g) +cZ(g)达到平 衡后, 把容器体积压缩到原来的一半且达到 新平衡时, X的物质的量浓度由0.1mol/L增
大到0.19mol/L, 下列判断正确的是: A
A. a>b+c B. a<b+c C. a=b+c D. a=b=c
V’正= V’逆
速率-时间关系图:
0
t2
T(s)
课堂练习
1. 在密闭容器中进行下列反应
CO2(g)+C(s)
2CO(g) △H﹥0
达到平衡后,改变下列条件,则指定物质的浓度及 平衡如何变化:
(衡1逆)向减移小动密闭容; c器(C体O2积) ,保增持大温度。不变,则平 (衡2不)移通动入N;2c,(C保O持2) 密不闭变容器体积。和温度不变,则平
V(molL-1S-1)
V,正
增ቤተ መጻሕፍቲ ባይዱ
大
反
应 V正 物 浓
V正= V逆 V’逆 平衡状态Ⅰ
度 V逆 0
t1 t2
t3
V”正 = V”逆 平衡状态Ⅱ
t(s)
v v
V(正)
原平衡