相平衡、化学平衡和热力学(唐有祺著)思维导图
- 格式:xmin
- 大小:5.58 KB
- 文档页数:1
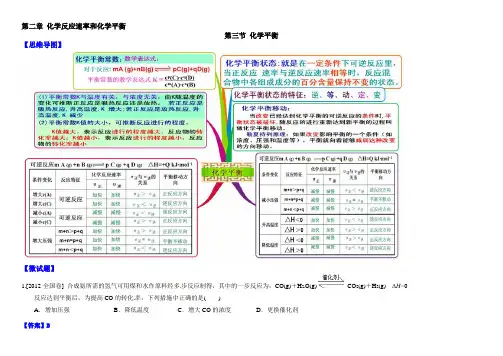
第二章化学反应速率和化学平衡第三节化学平衡【思维导图】【微试题】1.[2012·全国卷] 合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为:CO(g)+H2O(g)CO2(g)+H2(g)ΔH<0反应达到平衡后,为提高CO的转化率,下列措施中正确的是()A.增加压强B.降低温度C.增大CO的浓度D.更换催化剂【答案】B2.向绝热恒容密闭容器中通入SO2和NO2,在一定条件下使反应SO2(g)+NO2(g)SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如下所示。
由图可得出的正确结论是()A.反应在c点达到平衡状态B.反应物浓度:a点小于b点C.反应物的总能量低于生成物的总能量D.△t1=△t2时,SO2的转化率:a~b段小于b~c段【答案】D3.(2012·安徽卷)一定条件下,通过下列反应可实现燃煤烟气中硫的回收:SO2(g)+2CO(g)2CO2(g)+S(l)ΔH<0若反应在恒容的密闭容器中进行,下列有关说法正确的是()A.平衡前,随着反应的进行,容器内压强始终不变B.平衡时,其他条件不变,分离出硫,正反应速率加快C.平衡时,其他条件不变,升高温度可提高SO2的转化率D.其他条件不变,使用不同催化剂,该反应的平衡常数不变【答案】D4.(2014山东理综)研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g)K1∆H < 0 (I)2NO(g)+Cl2(g )2ClNO(g)K2∆H < 0 (II)(1)4NO2(g)+2NaCl(s )2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示)。
(2)为研究不同条件对反应(II)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(II)达到平衡。


化学平衡思维导图统特点不做非膨胀功参与反应各物质的量不再随时间改变而改变正向反应速率等于逆向动态平衡定条件下反应能否进行大转化率计算应条件改变对反应影响何控制反应条件等温等压下,反应方向判据适参与反应各物质的化学势不变定条件下反应方向热力学定律><>=<=反应限度R 点,D 和未混合时吉布斯自由能之和P点,D 和混合后但尚未进行反应时系统的吉布斯自由能之和T点,反应达平衡时,所有物质的吉布斯自由能之总和,包括混合吉布斯自由能;点,纯产物的吉布斯自由能防止反应物之间或反应物与产物之间的任何形式的混合,使反应进行到底亲和势A >0,反应正向进行A <0,反应逆向进行A =0,反应达平衡温方程式理想气体混合系统非理想气体混合物反应系统理想液态混合物反应系统非理想液态混合物反应系统相反应热力学平衡常数适用于任意相态的化学反应与标准态化学势有关,故与各物的性质和标准态的选择有关仅是温度的函数,压力已指定为标准压力它是量纲一的量,单位为通过标准状态下反应吉布斯自由能变化求得与理论上所能获得的最大转化率有关,可计算反应的最大转化率例题用等温方程式判断反应方向判断方向(理想气体)即反应限度,可通过标准平衡常数计算最大转化率平衡常数与等温方程式应用例题例题相反应标准平衡常数理想稀溶液中enry 定律发生偏差平衡常数与化学反应方程式的关系标准平衡常数经验平衡常数理想气体标准平衡常数只取决于温度和物质本性的量纲一的数值者关系准吉布斯自由能、标准平衡常数、经验平衡常的联系与应用对于溶液同理例题个反应系统中,有不同相态的物质参与的反有凝聚相(纯态液相或固相)参单个理想气体或是理想气体混合物只与气体反应物有关多个气体解离压力某固体物质发生解离反应时,所产生气体的压力,称为解离压力,定温下有定值究意义断反应方向当环境中的CO2分压小于离解压力,反应正向进行当CO2分压大于离解压力,反应逆向进行例题准平衡常数测定方法测定反应系统达到平衡时的压力或浓度物理方法直接测定与浓度或压力呈线性关系的物理量化学方法用骤冷、抽去催化剂或冲稀等方法使反应停留在原来的平衡状态,然后用合适的化学分析方法分析平衡的组成衡转化率及平衡组成的计算理论转化率实际转化率准平衡常数与平衡转化率的计算与应用温度an’t Hoff 公式微分式an’t Hoff 公式的定积分式应用压力只影响有气体物质参与并反应前后气体分子数不等的反应的平衡组成惰性气体惰性气体只影响有气体物质参与的反应的平衡组成例题在一个反应体系中,如果同时发生几个反应,当到达平衡态时,这种情况称为同时平衡设体系中发生两个化学反应,若一个反应的产物在另一个反应中是反应物之一,则这两个反应称为耦合反应例子估算估计反应的有利温度转折温度时的温度题。





化学平衡知识点梳理及平衡图像分析化学平衡对于可逆反应,当V正=V逆时,反应体系中各物质的质量不再发生变化化学平衡的标志:(1)V正=V逆时同种物质需要大小相等方向相反不同种物质需要大小成对应的化学计量数之比,方向相反(2)百分数一定。
包括质量、体积、物质的量百分数(3)转化率、产率一定(4)体系的颜色、在绝热条件下体系的温度不再发生变化(5)条件一定时某物质的浓度一定(6)对于有气体参与的反应,当a+b≠c+d时,即反应前后有气体体积变化的,当M或P一定时则达到平衡(7)对于有气体参与的反应,当a+b≠c+d时,即反应前后有气体体积变化的,当T、P、V一定时,密度不在发生变化时,则反映达到平衡(8)对于有气体参与的反应,当a+b=c+d时,即反应前后无气体体积变化的,当反应中有一个固体或者是液体时,若有混合气体的密度不在发生变化则反应达到平衡8、化学平衡的影响化学平衡的影响主要有浓度、温度、压强、催化剂(1)浓度的影响增大反应物或者是减小生成物的浓度,反应向正反应方向移动;减小反应物或者是增大生成物的浓度,反应向逆反应方向移动(2)温度的影响升高温度反应向吸热方向移动;降低温度反应向放热方向移动(3)压强的影响对于有气体参与的反应,增大压强反应向着气体体积减小的方向移动;减小压强反应向着气体体积增大的方向移动(4)催化剂的影响催化剂不影响平衡移动,只缩短平衡所需要的时间化学平衡图像的分析常用方法:1、先拐先平数值大2、定一议二9、化学平衡常数、转化率化学平衡常数K的计算:反应方程式中后面的浓度幂之积比上前面的浓度幂之积(纯固、纯液除外)K值只受温度的影响,温度不变K值不变转化律=消耗的/总的1.一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如右图所示,下列描述正确的是()A.反应开始到10s,用Z表示的反应速率为0.158mol/(L·s)B.反应开始时10s,X的物质的量浓度减少了0.79mol/LC.反应开始时10s,Y的转化率为79.0%D.反应的化学方程式为:X(g)+Y(g)Z(g)2.T℃时,A气体与B气体反应生成C气体。



静态平衡合力为零静止或匀速直线运动动态平衡自由落体运动运动学问题超重竖直上抛运动失重和与速度共线匀变速直线运动完全失重合力恒定动力学两类基本问题力与运动平抛运动与初速度不共线匀变速曲线运动带电粒子在匀强电场中的类平抛运动方向与速度垂直匀速圆周运动合力大小一定、方向变化方向周期性变化-周期性加速、减速图象法运动轨迹是圆周能量守恒定律或牛顿运动定律合力大小和方向都变化运动轨迹是曲线但不是圆周能量观点匀速直线运动(F 合=0)直线运动小球压缩弹簧雨滴下落至收尾速度粒子在交变电场中运动匀变速直线运动(F吝恒定)x-t图象v-1图象基本公式常用推论与F 关系v=vo+atx=Vot+ ar²v²-v²=2ax△x=aT²力的运算F=ma自由落体运动竖直上抛运动刹车问题斜面上物体的运动合成法正交分解法非匀变速直线运动(F+ 变化)图象描述条件Fa 与v 不 共 线研究方法运动的合成与分解F ·方向与轨迹关系Fa 指向轨迹的凹侧恒力初速度u 与F△垂 直u 方向的匀速直线运动 合力方向的匀变速直线运动合力恒定特例初速度x 与F 合不共线水平方向以ucos θ做匀速直线运动 竖直方向做匀变速直线运动圆周运动位移分解 速度分解 加速度分解斜抛运动(类斜抛运动)平抛运动 (类平抛运动)曲 线 运 动特点特点分解分解运动描述实例线速度:v=△tAs△0角速度:w=At周期TT=频率f向心加速度:a=向心力:F=ma水平面内的圆周运动模型竖直面内的圆周运动模型v=wrw)π1f4π²T²F=汽车转弯、火车转弯、圆锥摆绳模型,最高点vmm=√gr杆模型,最高点vmin=0v²m-rmw²rm4π²r²=w²r=rT'-圆周运动能量观点标量矢量动量观点能量功W=Flcos a平均功率F= W瞬时功率P=Fucos α机车启动动能定理,W,=△E机械能守恒定律功能关系能量守恒动量定理Ft=mv₂-mv缓冲问题连续体问题电磁感应中的电荷量问题动量守恒定律mi2₁+m₂=m₁v′+m₂₂'碰撞爆炸反冲弹性碰撞非弹性碰撞完全非弹性碰撞动量p=mu-冲量l=FtT力在空间力在时间效果积累效果积累能量与动量力学三大观点常见过程动力学观点能量观点动量观点常见模型匀变速直线运动平抛运动圆周运动一般的曲线运动滑块、滑板斜面弹簧传送带碰撞性质作用电场强度(E= ,E=k Q ,E= d U ),电场线 电势(φ: 9E . ,U=4A-4s,W=qU), 等势面平衡带电粒子在对电荷:F=qE 加速匀强电场中偏转对导体:静电感应(静电平衡、静电屏蔽)电容(定义式C= 决定式C= E,S )4πkd'电场与磁场性质作用带电粒子在电、 磁场中的运动磁感应强度 B= F (I ⊥B)L对通电导线: F=BIL(I ⊥B)对运动电荷:F=quB(v ⊥B) ①仅受电场力②仅受洛伦兹力 ③在复合场中运动 ①直线运动② 类平抛运动 ③圆周运动 ④一般曲线运动应用实例 ①示波管 ②直线加速器 ③速度选择器 ④磁流体发电机 ⑤电磁流量计 ⑥霍尔元件 ⑦质谱仪 ⑧回旋加速器v//B,F=0,做匀速直线运动u⊥B,F=quB,做匀速圆周运动带电粒子在 匀强磁场中带电粒子的受力情况带电粒子的运动性质磁感线,磁通量φ=BSQ U' 磁场电场合力为零合力方向与速度方向在同一直线上合力指向轨迹凹侧速度偏转角:,v6%侧移距离:y=yo+l'tanPIfu某一位置,牛顿第二定律 某一过程,动能定理匀速直线运动 变速直线运动曲线运动规律:牛顿 运动定律或 动能定理 带电粒子在电场中的运动运动的 分解类平抛 运动圆周运动常见磁场磁场的描述磁场对电流的作用磁场对运动电荷的作用匀强磁场条形磁铁的磁场通电直导线周围的磁场通电圆环周围的磁场磁感线磁感应强度安培力洛伦兹力提供向心万大小、方向大小F=BIL(I⊥B)方向左手定则方向-大小F=quB(v⊥B)mi匀速圆R= qB周运动T=qB安培定则2πm磁场在电 场中在组合场 中的运动 (不计重力)在磁 场中计重 力在叠加场中的运动不计 应 重力 用般曲线运动v//E,匀变速直线运动⊥E, 类平抛运动v//B,匀速直线运动v⊥B.匀速圆周运动匀速直线运动 qE 、mg 、quB 平 衡匀速圆周运动 速度选择器质谱仪回旋加速器 磁流体发电机电磁流量计 霍尔元件功能关系注意两个过程的 衔接,前一过程 的末速度是下一 过程的初速度aE=mg,auB 提供向心力quB=mr 电:子复场 的 动 带粒在合中运Aφ电源直流电路用电器电路产 生 交变电流(正、余弦) 描述输送感应电流方向的判定: 楞次定律、右手定则电 磁 感 应感应电动势的大小:E=n²△,E Lv总功率:P=EI输出功率:P=U 内耗功率:P=I²r直流电路的动态分析 含容直流电路的分析 电路故障的分析电路中的能量转化部分电路欧姆定律l=闭合电路欧姆定律l= UR ER+r 电阻:R=p; S T电功: W=uit电热: Q=FRt交流电“四值” 周期、频率变压器远距离输电基本关系制约关系运用牛顿运动定律分析导体棒切割磁感线问题运用动量定理、动量守恒定律分析导体在导轨 上的运动问题运用能量守恒定律分析电磁感应问题运用电磁感应与欧姆定律的有关知识分析图象场、路结合问题 电路与电磁感应探究型实验验证型实验实验仪器实验方法测量做直线运动物体的瞬时速度探究弹簧弹力与形变量的关系探究加速度与物体受力、物体质量的关系探究平抛运动的特点探究向心力大小与半径、角速度、质量的关系探究两个互成角度的力的合成规律验证机械能守恒定律验证动量守恒定律长度测量仪器刻度尺、游标卡尺、螺旋测微器时间测量仪器打点计时器、秒表(不估读)数字计时器(光电门)等效法控制变量法倍增法力学实验探究型实验测量型实验测量仪器读数观察电容器的充、放电现象探究影响感应电流方向的因素探究变压器原、副线圈电压与匝数的关系测量金属丝的电阻率测量电源的电动势和内阻用多用电表测量电学中的物理量电压表、电流表、欧姆表、电阻箱电表的改装电学实验描述方法回复力特点简谐运动共振受迫振动实验:用单摆测量重力加速度的大小描述方法形成条件干涉、衍射波速、波长和频率(周期)的关系光的折射全反射sin C= 1光的干涉薄膜干涉光的衍射光的偏振实验:测量玻璃的折射率实验:用双缝干涉实验测量光的波长麦克斯韦电磁场理论电磁波的产生机械振动机械波光学电磁波机械振动与机械波光电磁波n分子直径数量级为10-*”m.阿伏加德罗常数 扩散现象、布朗运动引力、斥力同时存在分子力表现为引力和斥力的合力 温度是分子平 均动能的标志各向异性晶体各向同性液体玻意耳定律(等温):p.V=p ₂V 查理定律(等容):Pi P:T T 盖一吕萨克定律(等压):V VTT p ₁V p ₂V ₂理想气体状态方程:T T热力学第一定律△U=W+Q热力学第二定律(两种表述)用油膜法估测油酸分子的大小探究等温情况下一定质量气体压强与体积的关系分子动理论固体和液体气体实验定律热力学定律实验分子力- 内能单晶体多晶体分子动能 分子势能非晶体热学固体原子核式结构能级玻尔理论跃迁,hv=E-E(m>n)天然放射现象、三种射线、原子核的组成:中子、质子衰变核反应 电荷数守恒、裂变 质量数守恒聚变核力 (比)结合能 质量亏损,核能,△E=△mc²极限频率最大初动能 E ₁=hv-W ₀饱和光电流 光的强度电子的干涉和衍射h λ=p光子能量ε=hv光电效应物质波原子结构原子物理α粒子散射实验近代物理人工核转变波粒二象性遏止电压原子核。