(人教版)化学选修四思维导图:2-2影响化学反应速率的因素(含答案)
- 格式:doc
- 大小:1.41 MB
- 文档页数:5

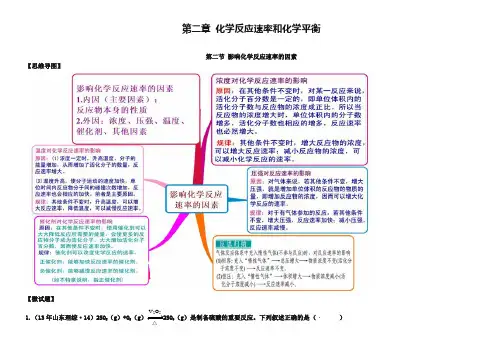
第二章化学反应速率和化学平衡第二节影响化学反应速率的因素【思维导图】【微试题】V2O51.(13年山东理综·14)2SO2(g)+O2(g)2SO3(g)是制备硫酸的重要反应。
下列叙述正确的是()△A .催化剂V 2O 5不改变该反应的逆反应速率B .增大反应体系的压强,反应速度一定增大C .该反应是放热反应,降低温度将缩短反应达到平衡的时间则时间间隔t 1~t 2内,SO 3(g )生成的平均速率为2121c c u t t -=- D .在t 1、t 2时刻,SO 3(g )的浓度分别是c 1,c 2,【答案】B2.等质量的铁与过量的盐酸在不同的试验条件下进行反应,测定在不同时间t 产生氢气体积v 的数据,根据数据绘制得到图1,则曲线a 、b 、c 、d 所对应的试验组别可能是( )组别 c(HCl)(mol·L-1) 温度(℃) 状态1 2.0 25 块状2 2.5 30 块状3 2.5 50 粉末状 42.530粉末状A.4-3-2-1 B.1-2-3-4 C.3-4-2-1 D.1-2-4-3【答案】C3.把铝条放入盛有过量稀盐酸的试管中,不影响...氢气产生速率的因素是()A.盐酸的浓度 B.铝条的表面积 C.溶液的温度 D.加少量Na2SO4【答案】D4.(海南16分)下表是稀硫酸与某金属反应的实验数据:实验序号金属质量/g金属状态C(H2SO4)/mol·L-1V(H2SO4)/mL溶液温度/℃金属消失的时间/s反应前反应后1 0.10 丝0.5 50 20 34 5002 0.10 粉末0.5 50 20 35 503 0.10 丝0.7 50 20 36 2504 0.10 丝0.8 50 20 35[: 2005 0.10 粉末0.8 50 20 36 256 0.10 丝 1.0 50 20 35 1257 0.10 丝 1.0 50 35 50 508 0.10 丝 1.1 50 20 34 1009 0.10 丝 1.1 50 30 44 40分析上述数据,回答下列问题:(1)实验4和5表明,对反应速率有影响,反应速率越快,能表明同一规律的实验还有(填实验序号);(2)仅表明反应物浓度对反应速率产生影响的实验有(填实验序号);(3)本实验中影响反应速率的其他因素还有,其实验序号是。



(人教版选修4)第二章《化学反应速率和化学平衡》教学设计第二节影响化学反应速率的因素(第二课时温度、催化剂对化学反应速率的影响)【科学探究】已知4H++4I―+O2 == 2I2 +2H2O ,现有1 mol/L KI溶液、0.1 mol/L H2SO4溶液和淀粉溶液,请探究溶液出现蓝色的时间与温度的关系。
【交流】试剂种类及用量 2 mL KI溶液、2滴淀粉溶液、2 mL 稀硫酸实验温度①室温②冰水混合物试剂加入顺序及理由分别向2 mL KI溶液滴加2滴淀粉溶液后,再分别加入2 mL 稀硫酸。
因为在不加酸的情况下,O2不能氧化I―实验现象①室温的一组溶液快出现蓝色结论其他条件相同时,升高温度反应速率加快,降低温度反应速率减慢【问题讨论1】对吸热反应和放热反应,温度对反应速率的影响规律是否相同?【交流】其他条件不变时,升高温度,不管是吸热反应还是放热反应,反应物分子的能量增加,使一部分原来能量较低的分子变成活化分子(如图所示)→活化分子百分数增加→有效碰撞次数增多→反应速率增大。
因此,升高温度均可以增大反应速率。
反之,降低温度均可以降低反应速率。
如图:【问题讨论2】通常情况下,你认为温度、浓度、压强对反应速率的影响谁更强一些呢?在日常生活中有哪些应用?【交流1】一般而言,温度对化学反应速率的影响比浓度、压强等对化学反应速率的影响要大,【交流】当其他条件不变时,使用催化剂,化学反应速率增大。
【问题讨论2】请从微观角度对上述规律作出解释。
【交流】使用催化剂→改变了反应的路径(如下图),反应的活化能降低→活化分子的百分数增大→单位时间内有效碰撞几率增加→反应速率加快。
如下图所示:【小组讨论1】我们在讨论催化剂对化学反应速率的影响时,还应注意哪些问题?【交流1】催化剂有正、负之分,一般情况下的催化剂是指正催化剂。
【交流2】催化剂有选择性,不同的化学反应的催化剂不相同,催化剂具有一定的活化温度。
【小组讨论2】根据催化剂对化学反应速率的影响实质,分析催化剂对可逆反应中的正、逆反应速率的影响是否相同?【交流】因催化剂对化学反应速率的影响是降低反应的活化能,增加有效碰撞次数,对正、逆反应的影响是相同的,所以催化剂对正、逆反应速率的影响相同。





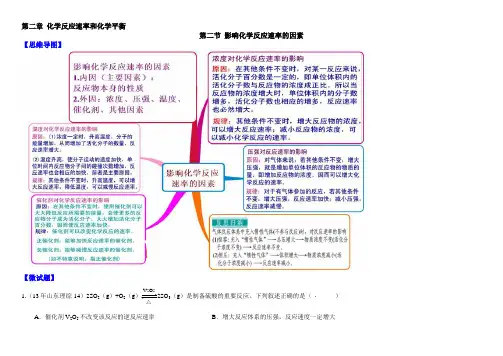
第二章 化学反应速率和化学平衡第二节 影响化学反应速率的因素【思维导图】【微试题】1.(13年山东理综·14)2SO 2(g )+O 2(g )2SO 3(g )是制备硫酸的重要反应。
下列叙述正确的是( )A .催化剂V 2O 5不改变该反应的逆反应速率B .增大反应体系的压强,反应速度一定增大△V 2O 5C .该反应是放热反应,降低温度将缩短反应达到平衡的时间则时间间隔t 1~t 2内,SO 3(g )生成的平均速率为2121c c u t t -=- D .在t 1、t 2时刻,SO 3(g )的浓度分别是c 1,c 2,【答案】B2.等质量的铁与过量的盐酸在不同的试验条件下进行反应,测定在不同时间t 产生氢气体积v 的数据,根据数据绘制得到图1,则曲线a 、b 、c 、d 所对应的试验组别可能是( )A.4-3-2-1 B.1-2-3-4 C.3-4-2-1 D.1-2-4-3【答案】C3.把铝条放入盛有过量稀盐酸的试管中,不影响...氢气产生速率的因素是()A.盐酸的浓度B.铝条的表面积C.溶液的温度D.加少量Na2SO4【答案】D4.(海南16分)下表是稀硫酸与某金属反应的实验数据:分析上述数据,回答下列问题:(1)实验4和5表明,对反应速率有影响,反应速率越快,能表明同一规律的实验还有(填实验序号);(2)仅表明反应物浓度对反应速率产生影响的实验有(填实验序号);(3)本实验中影响反应速率的其他因素还有,其实验序号是。
(4)实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,推测其原因:。
【答案】(1)固体反应物的表面积;表面积越大;1、2 (2)1、3、4、6、8(或2、5)(3)反应温度;6、7(或8、9)(4)因为所有反应中,金属质量和硫酸溶液体积均相等,且硫酸过量,产生热量相等,故溶液温度变化值相近。
【解析】本题考查影响化学反应速率的因素,侧重实验探究浓度对反应速率的影响,注意表格中的数据分析即可解答,题目难度不大;(1)实验4和5,金属和稀硫酸的量相同,金属的状态不同,可知固体的表面积越大反应速率越快,故答案为:固体反应物的表面积;表面积越大;1和2;(2)仅表明反应物浓度对反应速率产生影响的实验,金属的状态就应该相同,或者为丝状,或者为粉末,故答案为:1、3、4、6、8或2、5;(3)本实验中,反应温度也影响化学反应速率,如实验6和7或8和9,故答案为:反应温度;6和7或8和9;(4)由于所以反应中,金属质量和硫酸溶液体积均相等,且硫酸过量,产生热量相等,所以实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,故答案为:因为所以反应中,金属质量和硫酸溶液体积均相等,且硫酸过量,产生热量相等,故溶液温度变化值相近.。
高中化学学习材料金戈铁骑整理制作第二节影响化学反应速率的因素名师导航知识梳理1.有效碰撞和活化分子化学反应的实质是反应物分子中________,生成物分子中________的过程。
即反应物分子中的原子重新组合成生成物分子的过程,而反应物分子发生碰撞时并不都能发生反应,有的碰撞能发生化学反应,有的不能。
化学反应速率与分子间的________频率有关,因此所有能够改变________、________,以及________的外界条件,都可以用来________、________反应的速率。
________、________、________等都可以改变反应速率。
2.影响化学反应速率的因素影响化学反应速率的因素分为内因和外因两个方面。
内因是指反应物本身的性质,如金属钠与冷水剧烈反应,而镁和沸水仅能微弱反应。
影响化学反应速率的决定因素是内因。
外因是指外界条件如________、________、________、________等。
改变了这些条件,可以改变化学反应速率,其根本原因是改变了单位体积内________的数目,也就改变了分子间发生________的机会,从而改变了化学反应速率。
其他条件:除上述四种常见的反应条件外,还有光、超声波、激光、放射线、电磁波等均可改变化学反应速率。
3.浓度对反应速率的影响分析实验2-2的数据,表明______________________________________。
结论:在其他条件相同时,增大反应物的浓度,化学反应速率________;减小反应物浓度,化学反应速率________。
在其他条件不变时,活化分子在反应物分子中所占的百分数是一定的,因此单位体积内活化分子的数目与单位体积内反应物分子的总数成正比,也就是与反应物的浓度成正比。
当反应物浓度增大时,单位体积内分子总数________,活化分子数也相应________,单位时间内有效碰撞次数________,化学反应速率加快。
第二章 化学反应速率和化学平衡
第二节 影响化学反应速率的因素
【思维导图】
【微试题】
1.(13年山东理综·14)2SO 2(g )+O 2(g )
2SO 3(g )是制备硫酸的重要反应。
下列叙述正确的是( )
A .催化剂V 2O 5不改变该反应的逆反应速率
B .增大反应体系的压强,反应速度一定增大
△
V 2O 5
C .该反应是放热反应,降低温度将缩短反应达到
平衡的时间
则时间间隔t 1~t 2内,SO 3(g )
生成的平均速率为21
21
c c u t t -=- D .在t 1、t 2时刻,SO 3(g )的浓度分别是c 1,c 2,【答案】
B
2.等质量的铁与过量的盐酸在不同的试验条件下进行反应,测定在不同时间t 产生氢气体积v 的数据,根据数据绘制得到图1,则曲线a 、b 、c 、d 所对应的试验组别可能是( )
A.4-3-2-1 B.1-2-3-4 C.3-4-2-1 D.1-2-4-3
【答案】C
3.把铝条放入盛有过量稀盐酸的试管中,不影响
...氢气产生速率的因素是()A.盐酸的浓度B.铝条的表面积C.溶液的温度D.加少量Na2SO4【答案】D
4.(海南16分)下表是稀硫酸与某金属反应的实验数据:
分析上述数据,回答下列问题:
(1)实验4和5表明,对反应速率有影响,反应速率越快,能表明同一规律的实验还有(填实验序号);
(2)仅表明反应物浓度对反应速率产生影响的实验有(填实验序号);
(3)本实验中影响反应速率的其他因素还有,其实验序号是。
(4)实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,推测其原因:。
【答案】(1)固体反应物的表面积;表面积越大;1、2 (2)1、3、4、6、8(或2、5)(3)反应温度;6、7(或8、9)(4)因为所有反应中,金属质量和硫酸溶液体积均相等,且硫酸过量,产生热量相等,故溶液温度变化值相近。
【解析】本题考查影响化学反应速率的因素,侧重实验探究浓度对反应速率的影响,注意表格中的数据分析即可解答,题目难度不大;
(1)实验4和5,金属和稀硫酸的量相同,金属的状态不同,可知固体的表面积越大反应速率越快,
故答案为:固体反应物的表面积;表面积越大;1和2;
(2)仅表明反应物浓度对反应速率产生影响的实验,金属的状态就应该相同,或者为丝状,或者为粉末,
故答案为:1、3、4、6、8或2、5;
(3)本实验中,反应温度也影响化学反应速率,如实验6和7或8和9,故答案为:反应温度;6和7或8和9;
(4)由于所以反应中,金属质量和硫酸溶液体积均相等,且硫酸过量,产生热量相等,所以实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,故答案为:因为所以反应中,金属质量和硫酸溶液体积均相等,且硫酸过量,产生热量相等,故溶液温度变化值相近.。