氯气实验室制法
- 格式:docx
- 大小:18.87 KB
- 文档页数:20


氯气的三种实验室制法
氯气是一种有用的元素,它的实验室制法有三种,分别是锂——
氢氧化氯、钠—氢氧化氯和氯水法。
其中锂——氢氧化氯是最常用的
实验室制法,它是通过把锂硫酸和氢氧化钠放入温度控制在700℃的下间炉中;这时,在把氢氧化钾喷给溶液时,将产生氯气。
经过过滤和
冷却,最终就可以得到所需要的浓度是普通气体;其次是钠——氢氧
化氯,这种方法被称为氯气生产技术中“Fritsch”方法。
它是通过把
钠溶液放到白铁坛子中,再把氢氧化钾加入其中,并将温度维持在700℃;在这种情况下,就会产生氯气。
经过过滤和消毒,氯气就可以
使用了。
最后是氯水法,这种实验室制法也被称为酰胺法,通常使用
由除水以外的氯和酰胺头部组成的氯酰胺或者有机溶剂。
在实验室中,将氯气与氯酰胺接触;这将形成氯气,经过过滤和冷却,然后就可以
得到所需要的纯度的氯气。
总之,氯气的实验室制法有三种,即锂——氢氧化氯、钠—氢氧
化氯和氯水法,它们都是通过不同的反应方式来制备氯气,其中锂——氢氧化氯是最常用的实验室制法,而氯水法也是实验室中非常有效
的一种方法。
每种方法都要经过过滤、冷却和消毒等步骤,最终才可
以得到所需要的纯氯气。


实验室制取氯气的方法以及对应化学方程式制取氯气的方法有以下几种:
1.非电解法:将氢氯酸与过氧化锌反应制取氯气。
化学方程式:2HCl+ZnO2→ZnCl2+H2O+Cl2
2.热解法:将氯化钠与二氧化锰加热反应制取氯气。
化学方程式:2NaCl+MnO2→Na2MnO4+Cl2
3.电解法:将氯化钠溶液进行电解制取氯气。
化学方程式:2NaCl+2H2O→2NaOH+H2+Cl2
4.过氧化氢法:将过氧化氢与盐酸反应制取氯气。
化学方程式:H2O2+2HCl→2H2O+Cl2
5.二氧化锰法:将氯化亚铁与二氧化锰反应制取氯气。
化学方程式:4FeCl2+MnO2→4FeCl3+MnCl2
6.含氧酸反应法:将氯化钠与硫酸反应制取氯气。
化学方程式:2NaCl+H2SO4→2HCl+Na2SO4
这些方法中,非电解法是最常用的制取氯气的方法之一、通过将氢氯酸与过氧化锌反应,可以制取氯气。
氢氯酸是一种强酸,过氧化锌是一种强氧化剂,两者反应生成氯气、氧化锌和水。
这个反应过程是一个氧化还原反应,其中氯气是氧化还原反应的产物。
在制取氯气的过程中,应注意安全操作。
氯气具有强烈的刺激性气味,对人体有毒性,对眼睛和呼吸道有刺激作用,因此应在通风良好的实验室
中进行操作,并佩戴适当的防护装备。
总结:制取氯气的方法有非电解法、热解法、电解法、过氧化氢法、
二氧化锰法和含氧酸反应法等。
其中非电解法是最常用的方法之一、在选
择制取氯气的方法时,需要根据实验室的条件和实际需要进行选择,并严
格遵守操作规范,确保安全。


氯气的三种实验室制法氯气是一种常用化学制剂,它可以用来制备其他化学制剂,也可以用来完成各种实验室制法。
在本文中,我们将讨论氯气的三种实验室制法,包括氯气空气混合物的制备、氯气水溶液的制备和氯气固体的制备。
我们将介绍这三种制法的原理、步骤和应用。
Introduction氯气是一种常用化学制剂,它可以用来制备其他化学制剂,也可以用来完成各种实验室制法。
在本文中,我们将讨论氯气的三种实验室制法,包括氯气空气混合物的制备、氯气水溶液的制备和氯气固体的制备。
我们将介绍这三种制法的原理、步骤和应用。
I. Preparation of Chlorine-Air Mixture氯气空气混合物的制备是一个简单的过程,主要分为三个步骤:用氯气溶液稀释氯气气体,混合氯气气体和空气,得到氯气空气混合物。
首先,将氯气溶液稀释,使其满足使用要求,然后将氯气气体和空气混合,可以使用小型机械设备,如搅拌器、离心机等,用来快速混合。
最后,在混合液中加入一定量的空气,即可得到所需的氯气空气混合物。
氯气空气混合物的应用非常广泛,被用于高氯气碱的制备、氯气聚合物的制备、氯气溶液的制备、氧化氯的还原制硫等实验中。
II. Preparation of Chlorine-Water Solution氯气水溶液的制备主要包括以下步骤:首先,将氯气气体加入水中,接着使用搅拌器、离心机等机械设备进行混合,最后可以得到所需的氯气水溶液。
在加入氯气气体时,应冷却水,以防止水沸腾而导致氯气损失。
氯气水溶液的应用很广泛,可以用来制备氯气聚合物、氧化氯、正硅酸钠和正氯酸等。
III. Preparation of Chlorine Solid氯气固体的制备是将氯气气体加入溶剂(如水、乙醇或乙醚)中,接着冷却,使溶质析出而形成固体。
这一步骤及其相关参数(如加入剂量、冷却时间和温度等)可以通过实验调整以获得所需的产品。
氯气固体的应用很广泛,可以用来制备氯气聚合物、氯乙烯和氯气酸等。

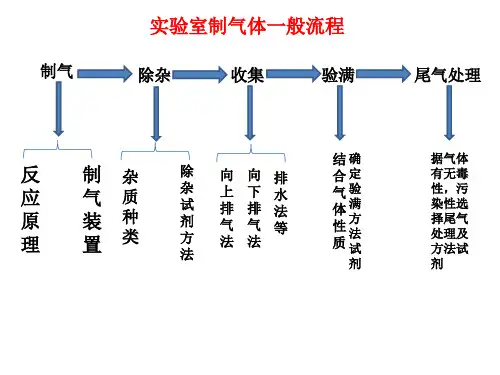
22 其次章 其次节 氯及其化合物第 3 讲 氯气的试验室制法【讲】学问点 1 氯气的试验室制法1. 反响原理(1) 化学方程式:MnO +4HCl(浓)==△===MnCl+Cl ↑+2H O 。
22 22(2) 原理:利用强氧化剂氧化浓盐酸中的Cl -生成 Cl ,该反响中 MnO 为氧化剂,浓盐酸为复原剂并且该试验还表达了浓盐酸的酸性。
2. 仪器装置(1) 气体发生装置类型:固+液――△→气(2) 发生装置所用仪器:分液漏斗、圆底烧瓶、酒精灯。
(3)除杂装置:装置C 的作用是除去 Cl 2 中少量的 HCl 气体。
装置D 的作用是枯燥氯气(或除去氯气中的水蒸气)。
3. 收集方法(1) 向上排空气法(氯气密度大于空气)。
(2) 排饱和食盐水法(氯气在饱和氯化钠溶液中的溶解度很小,用此法可除去试验中挥发产生的氯化氢气体)。
4.验满方法观看到E 中布满黄绿色气体,则证明已集满。
5.尾气处理烧杯 F 中盛放的液体是 NaOH 溶液。
该液体的作用是吸取过量的氯气,防止污染环境。
6、留意事项:(1)试验室制取氯气的反响原理是选用氧化剂(如 MnO 2、KMnO 4 等)将盐酸中的局部氯离子氧化而得到氯气。
(2)制取的氯气有毒,且在加热时简洁逸出,所以应选用分液漏斗,而不用长颈漏斗。
(3)尾气处理时,不能用澄清石灰水吸取氯气,由于澄清石灰水中Ca(OH)2 的含量少,吸取不完全。
(4)试验完毕后,先使反响停顿并排出装置中残留的氯气,再拆卸装置,避开污染空气。
【练】1. 以下关于试验室制氯气的说法中错误的选项是( )A .该反响是一个氧化复原反响,其中二氧化锰是氧化剂B .HCl 表现复原性和酸性C .该反响的离子方程式为 MnO +4H ++4Cl -==△===MnCl+2H O +Cl ↑2222222 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2D .该方法是瑞典化学家舍勒最先觉察的 答案 C解析 由 MnO +4HCl(浓)==△===MnCl +2H O +Cl ↑可知,二氧化锰是氧化剂,HCl 中氯元素局部化合价上升,HCl 既表现复原性,又表现酸性;氯化锰是可溶于水的强电解质,在离子方程式中应写成离子符号。

氯气实验室制法的实验原理氯气实验室制法原理实验原理是通过将酸性氯化物与强氧化剂反应产生氯气。
最常用的实验室制法有酸性氯化物法和电解氯化钠法。
一、酸性氯化物法的实验原理:首先,通过化学反应将氢氧化钠与氧氯化碳(也称为碳酸氯)反应生成氯气和碳酸钠。
4NaOH + COCl2 -> Cl2 + CO2 + 2Na2CO3 + 2H2O该反应需要在酸性条件下进行,因此酸性氯化物法通常在丁酸或稀硫酸的存在下进行。
其中,酸性中和反应为:2HCl + NaOH -> NaCl + H2O通过酸性中和反应可以消耗生成的氢氧化钠,保持反应的进行,确保较高的氯气产量。
二、电解氯化钠法的实验原理:电解氯化钠法是目前工业上生产氯气的主要方法。
其原理是利用电流通过电解质溶液中的氯化钠,产生氯气和氢气。
在电解槽中,放置两根导电性良好的电极,即阴极和阳极。
阴极一般由钢材制成,阳极则由铅材料制成。
随后,将溶解在水中的氯化钠加入电解槽中。
氯化钠在水中分解成氯离子(Cl-)和钠离子(Na+):NaCl -> Na+ + Cl-通过外加电源,阴极与阳极之间形成电解槽中的电流。
电流流经电解槽中的氯化钠溶液,使得溶液中的氯离子与阳极反应,产生氯气,而钠离子与阴极反应,产生氢气:2Cl- -> Cl2 + 2e-2H2O + 2e- -> H2 + 2OH-在整个电解过程中,由于生成氯气的反应速度较慢,因此将氯化钠溶液搅拌,以提高氯气的产量。
由于氯气及氢气是有毒和易燃的,因此在电解槽上方设有排气装置,确保实验室的安全。
以上就是氯气实验室制法的实验原理,其中酸性氯化物法通过酸性环境下的化学反应产生氯气,而电解氯化钠法则是利用电流作用于溶液中的氯化钠产生氯气和氢气。
这两种方法在实验室制取氯气时常被使用。

实验室制取氯气原理
在实验室中制取氯气的原理是通过将盐酸与漂白粉反应产生氯气。
盐酸(HCl)是一种气味刺激的无色液体,漂白粉则是一种含有次氯酸钠(NaClO)的白色固体。
当盐酸与漂白粉混合时,次氯酸钠发生分解反应生成氯气(Cl2)和氢氧化钠(NaOH)。
反应方程式如下:
NaClO + 2HCl → Cl2 + NaOH + H2O
实验操作时,首先将适量的盐酸倒入一个反应瓶中。
然后,将漂白粉一点一点地加入盐酸中,并搅拌使其充分混合。
盐酸和漂白粉的反应会产生氯气,可以通过一个玻璃吸管或导管将气体收集到气体收集瓶中。
由于氯气具有剧毒性和高度刺激性,实验室中制取氯气时需采取严格的安全措施。
操作人员应佩戴防护眼镜、防护手套和防护面罩,以免皮肤和眼睛接触到氯气。
实验室应保持良好的通风,避免氯气浓度过高。
实验结束后,氯气需要妥善处理或释放到安全环境中。

氯气实验室制法化学方程式双氧水合成氯气制法实验室化学方程式
一、双氧水合成氯气:
对氯也称双氧水过氧化物,又称氯气。
1. 反应物:
(1)氯乙烷:CH3-CHCl-CH3
(2)二氧化氢:H2O2
(3)双氧水:H2O2
2. 化学方程式:
CH3-CHCl-CH3 + H2O2 → CH3-CHO-CH3 + HCl + H2O
3. 反应条件:
(1)温度:80℃
(2)催化剂:硫酸铜
(3)酸度:pH = 8-9
二、接下来是双氧水合成氯气实验室制法的详细步骤:
1. 准备实验用品:
(1)铜币、硫酸铜、氯乙烷、氢氧化物、双氧水
(2)温度计、pH试纸
2. 实验步骤:
(1)准备实验室量具装置,将硫酸铜(催化剂)用棉絮塞入实验烧杯,并用铜币拧紧;
(2)将氯乙烷于实验烧杯中加入;
(3)将氢氧化物加入实验烧杯中并搅拌均匀;
(4)将双氧水加入烧杯中搅拌均匀,将温度计安装至烧杯中,调温至80℃;
(5)用pH试纸测量反应液的酸度,确定酸度调节至pH = 8-9;
(6)将烧杯放入室温中,搅拌均匀,等待反应完成;
(7)反应完后,将残留物粗筛,然后进行收集并干燥,最后用空气吹干,得到氯气。
3. 注意事项:
(1)反应过程中温度应当尽可能的控制在80℃;
(2)量用反应物应精确,否则影响反应效率;
(3)搅拌均匀,保证反应混合效果;
(4)最后得到的氯气应该是室温下的,而不是热的。
实验室制氯气三种方法方程式
嘿,小伙伴们!今天咱就来好好聊聊实验室制氯气的三种方法方程式!
先说第一种方法,用二氧化锰和浓盐酸反应,这就像是一场激烈的战斗!方程式就是:MnO₂ + 4HCl(浓) → MnCl₂ + Cl₂↑ + 2H₂O。
这不就像两个
强者相遇,产生了强大的氯气嘛!你想想,二氧化锰就像一位勇猛的战士,浓盐酸就是它的强劲对手,两者一碰撞,氯气就诞生啦!比如说,这就好像拳击台上两个高手对决,最后打出了震撼的效果。
再来看看第二种方法,用高锰酸钾和浓盐酸反应,哇塞,那场面可热闹啦!方程式是:2KMnO₄ + 16HCl(浓) → 2KCl + 2MnCl₂ + 5Cl₂↑ + 8H₂O。
这就好像是一场魔法表演,高锰酸钾施了个魔法,就让浓盐酸变出了氯气!好比魔术师从帽子里变出兔子一样神奇呢!
还有第三种方法呢,用重铬酸钾和浓盐酸反应,也是很厉害的哟!方程式是:K₂Cr₂O₇ + 14HCl(浓) → 2KCl + 2CrCl₃ + 3Cl₂↑ + 7H₂O。
就如同
一场精彩的竞赛,重铬酸钾和浓盐酸在跑道上你追我赶,最后产生了厉害的氯气!像不像运动员们在赛场上努力拼搏,为了赢得胜利呢!
这三种方法各有各的奇妙之处,是不是很有趣呀?大家可得好好记住这些方程式哦!。
实验室制氯气的反应方程式
第一种方法是,高锰酸钾和浓盐酸反应制取氯气,方程式为:
2KMnO4+16HCl=2KCl+2MnCl2+8H2O+5Cl2
第二种方法是,高氯酸钾和浓盐酸反应制取氯气,方程式为:
KClO4+8HCl=KCl+4H2O+4Cl2
第三种方法是,氯酸钾和浓盐酸反应制取氯气,方程式为:
KClO3+6HCl=KCl+3H2O+3Cl2
氯气的用途
化学工业用于生产次氯酸钠、氯化铝、三氯化铁、漂白粉、溴素、三氯化磷等无机化工产品,还用于生产有机氯化物,如氯乙酸、环氧氯丙烷、一氯代苯等。
也
用于生产氯丁橡胶、塑料及增塑剂。
日用化学工业用于生产合成洗涤剂原料烷基磺酸钠和烷基苯磺酸钠等。
实验室氯气的制备
实验室制备Cl2一般有3种方法:MnO2+4HCl==△==MnCl2+Cl2↑+2H2O;
2KMnO4+16HCl=2MnCl2+5Cl2↑+2KCl+8H2O;KClO3+6HCl=KCl+3Cl2+3H2O。
防止氯气泄漏的.方法
氯气外泄极容易导致人身死伤和区域性污染,避免氯气外泄的方法存有:
1、不能选用存在缺陷的设备和部件,各设备和部件要定期检测和检验;
2、强化工艺管理,严格控制工艺指标,辨认出问题必须及时检查和处置;
3、加强事故氯处理装置的管理和检修,相关装置采用多路电源供电,定期清洗事故氯处理装置,机泵定期试车;
4、为了及时发现氯气外泄,在生产、储存、运送和采用的岗位都必须加装氯气报警器,一旦氯气外泄,可以及早辨认出,避免事故不断扩大,并在液化岗位加装电视监控和碱液喷淋装置。
第1篇一、实验目的1. 了解氯气的制备原理和实验方法。
2. 掌握氯气的性质和检验方法。
3. 培养实验操作技能和实验数据处理能力。
二、实验原理氯气是一种黄绿色、有刺激性气味的有毒气体,化学式为Cl2。
氯气可以通过实验室制备,常用的方法是将浓盐酸与二氧化锰反应生成。
反应方程式如下:4HCl + MnO2 → MnCl2 + 2H2O + Cl2↑三、实验器材与试剂1. 器材:试管、酒精灯、集气瓶、导管、铁夹、铁架台、镊子、滴管、滤纸、玻璃片等。
2. 试剂:浓盐酸、二氧化锰、蒸馏水、淀粉碘化钾试纸。
四、实验步骤1. 准备工作:将浓盐酸倒入试管中,加入适量的二氧化锰,搅拌均匀。
2. 加热:用酒精灯加热试管,观察反应现象。
开始时,反应较慢,随着反应进行,试管内压力增大,气泡逐渐增多。
3. 收集氯气:将集气瓶倒置在试管口,用玻璃片盖住集气瓶口,将氯气收集在集气瓶中。
4. 检验氯气:将淀粉碘化钾试纸湿润,放入集气瓶中,观察试纸颜色变化。
若试纸变蓝,则证明氯气已收集满。
5. 实验结束:关闭酒精灯,将集气瓶倒置在桌面上,用铁夹固定,等待氯气逸散。
五、实验数据与结果1. 实验数据:氯气收集时间为10分钟,收集到的氯气体积为100mL。
2. 实验结果:淀粉碘化钾试纸变蓝,证明氯气已收集满。
六、实验分析1. 实验原理分析:根据反应方程式,浓盐酸与二氧化锰反应生成氯气、氯化锰和水。
反应过程中,试管内压力增大,气泡逐渐增多,最终收集到氯气。
2. 实验现象分析:实验过程中,随着反应进行,气泡逐渐增多,说明氯气生成速率逐渐加快。
收集到的氯气体积为100mL,符合实验预期。
3. 实验误差分析:实验过程中,可能存在以下误差因素:(1)加热不均匀,导致反应速率不一致;(2)氯气逸散,导致收集到的氯气体积小于实际生成量;(3)实验操作不规范,导致实验结果偏差。
七、实验结论1. 本实验成功制备了氯气,验证了反应方程式的正确性。
2. 实验过程中,掌握了氯气的性质和检验方法,提高了实验操作技能。
实验室制取氯气的方法以及对应化学方程式
1.盐酸与漂白粉反应法:
这是制备氯气最常用的方法之一、具体步骤如下:
-取一烧瓶或集气瓶,内装一定量的盐酸溶液(浓度约为20%);同时准备漂白粉(NaClO)。
-将漂白粉逐渐加入盐酸溶液中,同时观察。
-观察到气体生成时,立即将气体收集器与瓶口连接。
-氯气生成后,通过阀门进行收集。
化学方程式如下:
NaClO+HCl->Cl2+H2O+NaCl
2.盐水电解法:
这是一种常用的制取氯气的电解方法。
具体步骤如下:
-准备两个碳电极,并将其插入装有盐水的电解槽中。
-将电解槽的两个电极连接到直流电源的正负极上。
-打开电源,让电解槽中的盐水进行电解。
-在电解的过程中,氯离子(Cl-)在阳极处放出氯气,并收集。
化学方程式如下:
2NaCl+2H2O->2NaOH+H2+Cl2
3.氯化亚铁与硫酸反应法:
这是一种利用氯化亚铁与硫酸反应制取氯气的方法。
具体步骤如下:-取一定量的氯化亚铁(FeCl2),并将其放入反应瓶中。
-加入足量的稀硫酸(H2SO4)溶液。
-观察到气体生成时,立即将气体收集器与瓶口连接。
-氯气生成后,通过阀门进行收集。
化学方程式如下:
FeCl2+H2SO4->FeSO4+2HCl
以上是实验室制取氯气的三种常见方法以及对应的化学方程式。
需要注意的是,制备氯气时要注意安全措施,避免氯气泄漏对人体和环境造成伤害。
氯气实验室制法在化学实验室中,氯气的制备是一种常见的实验操作。
氯气是一种黄绿色、有毒、具有强烈刺激性的气体,其制备通常通过以下步骤进行。
实验室制备氯气通常采用二氧化锰(MnO2)与浓盐酸反应。
具体来说,就是将二氧化锰与浓盐酸在加热的条件下进行反应,生成氯化锰和氯气。
反应方程式可以表示为:4HCl(浓) + MnO2 → MnCl2 + 2H2O + Cl2↑需要注意的是,由于氯气的溶解度和腐蚀性,制备过程中需要使用安全措施以防止氯气泄漏和腐蚀。
实验所需材料和设备包括:二氧化锰(MnO2)、浓盐酸、玻璃棒、烧杯、加热装置、通风装置、手套、护目镜等。
准备实验设备:将浓盐酸倒入烧杯中,加入适量的二氧化锰,用玻璃棒搅拌均匀。
加热:将装有反应物的烧杯放置在加热装置上加热,观察反应情况。
收集氯气:随着反应的进行,氯气会不断产生并排出。
此时,开启通风装置以防止氯气积聚。
提取产物:当反应完成后,停止加热并冷却反应物。
然后,用玻璃棒将生成的固体产物与液体产物分离。
清洗和整理:清洗烧杯和其他实验设备,整理实验现场。
在实验过程中,要始终保持通风良好,防止氯气积聚导致中毒。
实验结束后,要彻底清洗烧杯和其他实验设备,防止腐蚀和污染。
不要将氯气直接排放到空气中,以免对环境和人体造成危害。
应将其通过特定的吸收装置进行处理。
在操作过程中要小心谨慎,避免烫伤和中毒等事故发生。
最好在导师或安全员的监督下进行实验。
实验后应及时清理实验现场,确保实验室的安全和卫生。
通过观察实验过程和收集到的产物,我们可以确认实验室制备氯气的成功与否。
如果观察到黄绿色的氯气产生,且固体产物为氯化锰,那么实验就达到了预期的效果。
此时,我们可以进一步研究氯气的性质和应用。
实验室制备氯气是一个重要的化学实验操作,它使我们能够更深入地了解氯气的性质和合成方法。
通过本实验的操作,我们不仅能够提高自己的动手能力和实践经验,还能够增强对化学知识的理解和掌握。
我们也应该注意实验过程中的安全问题,确保实验的顺利进行和自身的健康安全。
乙炔,化学式为C2H2,是一种重要的有机化合物,具有广泛的用途。
在实验室中,我们可以通过以下步骤制备乙炔:将饱和食盐水倒入广口瓶或烧瓶中,直到大约一半的容积。
通过橡皮管将漏斗连接到广口瓶或烧瓶上,确保漏斗的尖端紧贴广口瓶或烧瓶的瓶口。
将碳化钙(CaC2)或电石放入漏斗中,确保它与食盐水接触。
关闭止水夹,将盐水从漏斗中排出,同时打开通风设备。
在通风良好的环境下进行实验,注意不要吸入气体。
通过观察,你会看到广口瓶或烧瓶内有气泡产生,这就是乙炔气体。
在操作过程中,要小心处理碳化钙和电石,避免直接接触皮肤或吸入粉尘。
为了保证实验的安全性,一定要在通风良好的环境下进行,且人员要佩戴实验室安全眼镜和手套。
在实验结束后,应立即将产生的乙炔气体排放到通风管道中,并确保所有设备和工具都妥善清理。
如果不慎接触到眼睛或皮肤,应立即用大量清水冲洗,并寻求专业医疗帮助。
在实验过程中,应保持地面的干燥和整洁,避免因液体溅出而导致的火灾或地面湿滑等危险情况。
在使用实验室设备时,一定要遵循实验室规定和操作流程,确保实验过程的安全性和准确性。
在处理实验废弃物时,应按照实验室废弃物处理规定进行分类处理和排放,避免对环境和人类造成危害。
碳化钙和电石应储存在干燥、阴凉的地方,远离明火和热源。
在使用碳化钙和电石时,一定要遵循实验室安全规定和操作流程。
在实验过程中,要时刻实验反应的变化情况,如有异常应立即停止实验并寻求帮助。
在实验结束后,应将所有设备和工具进行妥善清理和存放。
在化学实验室中,二氧化碳的制取是一个基础且重要的实验。
本文将详细介绍实验室中如何通过化学反应制备二氧化碳。
实验室设备:烧杯、试管、烧瓶、分液漏斗、橡皮管、集气瓶等。
化学试剂:稀盐酸、石灰石或大理石、稀盐酸。
将块状的石灰石或大理石放置在烧杯中,并加入适量的稀盐酸。
确保所用的稀盐酸是质量好的,以避免产生其他干扰气体。
迅速用橡皮管连接烧杯和集气瓶,使得产生的二氧化碳可以顺利地进入集气瓶中。
观察集气瓶中的变化。
你可以看到二氧化碳收集在瓶中,而空气则从分液漏斗的出口排出。
当反应结束,断开连接烧杯和集气瓶的橡皮管,将集气瓶中的二氧化碳通过分液漏斗倒入指定的容器中以供后续使用。
在进行实验时,确保所有的设备和试剂都是干净的,以避免引入其他气体或杂质。
确保稀盐酸的浓度和纯度是足够的,以获得最佳的反应效果。
反应过程中要注意安全,避免接触刺激性气体或试剂。
收集二氧化碳时,要确保集气瓶是干燥的,以避免影响二氧化碳的纯度。
在实验结束后,要对所有的设备和试剂进行适当的清理和归位。
通过以上步骤,我们可以成功地在实验室中制取二氧化碳。
这个实验不仅帮助我们理解了化学反应的基本过程,也教会了我们如何在安全的前提下进行实验操作。
二氧化碳作为自然界中广泛存在的一种气体,其在很多领域都有着重要的应用。
因此,掌握其制取方法对于理解和应用化学知识具有重要意义。
氢气,这个轻盈而神秘的气体,在化学实验中扮演着重要的角色。
了解如何制备氢气,不仅有助于我们理解其性质,而且能够让我们探索更多关于氢气的应用。
本篇文章将围绕《氢气的实验室制法》这一主题,通过课件的形式,引导初中生们掌握氢气的制备方法和实验操作技巧。
我们需要了解氢气的性质,包括物理性质(如无色、无味、密度低)和化学性质(如易燃、易爆)。
这些性质决定了氢气在日常生活和工业生产中的应用,例如填充气球、探空气球以及作为工业原料。
接下来,我们将探讨实验室制备氢气的原理。
最常用的方法是使用锌粒与稀盐酸反应。
在这个过程中,锌粒与稀盐酸中的氢离子反应,生成氢气。
通过这个实验,我们可以深入理解化学反应速率的概念,以及如何通过控制反应条件来影响化学反应速率。
在实验室中制备氢气需要遵循一定的操作步骤和注意事项。
我们将在课件中详细介绍实验所需器材(如试管、镊子、锌粒、稀盐酸等)、实验步骤以及注意事项。
学生们将通过观看视频教程,学习如何安全、有效地进行实验操作。
完成实验后,我们需要对实验数据进行记录和分析。
我们将教授学生们如何使用图表和数据分析工具来记录实验数据,如反应速率、气体产生量等。
通过对数据的分析,学生们可以更深入地理解化学反应的本质。
我们将鼓励学生们总结实验经验,反思实验过程中的不足之处,以及如何在未来的实验中改进。
通过这个《氢气的实验室制法》课件,我们希望能够帮助初中生们掌握氢气的制备方法和实验操作技巧。
通过学习这个实验,学生们将更深入地理解化学反应速率的概念和影响因素,提高他们的实验能力和科学素养。
我们希望这种教学方法能够激发学生们对化学的兴趣和热爱,让他们在探索科学的道路上更加自信和坚定。
上海粽子,又被称为“角黍”,是端午节期间的重要食品。
传统的上海粽子以精白糯米为主料,配以赤豆、绿豆、猪肉、蛋黄等馅料,清香可口,美味无穷。
下面,让我们一起学习如何制作美味的上海粽子吧。
你需要准备一些基本的材料。
精白糯米是粽子的主体,需要提前浸泡,至少需要4到6小时。
你也可以加入一些粳米,以增加口感。
赤豆、绿豆也需要提前浸泡,大约需要8到10小时。
猪肉可以根据个人口味选择瘦肉或者五花肉,切成小块备用。
另外,你还需要准备一些棕叶,用来包裹粽子。
准备好材料后,就可以开始制作粽子了。
将浸泡过的糯米和赤豆、绿豆混合在一起,加入一些盐和糖,搅拌均匀。
然后,将棕叶洗净,放在热水中烫软。
接下来,将棕叶折叠成漏斗形状,放入一些糯米混合物,再加上一块猪肉,最后再放一些糯米混合物。
接着,将棕叶包裹好,用线扎紧。
最后一步是将粽子放入锅中,加入足够的水,用大火煮沸后转小火煮约3到4小时。
煮好的粽子可以直接享用,或者冷藏后再享用。
解开棕叶,香气扑鼻,一口咬下去,糯米和馅料的味道交织在一起,让人回味无穷。
上海粽子不仅美味可口,还具有清热解毒、开胃消食的功效,是端午节期间不可或缺的美食。
制作上海粽子虽然有些繁琐,但是当大家尝到自己亲手制作的美味粽子时,那种满足感和成就感是无法用言语来形容的。
在这个端午节,不妨尝试一下制作上海粽子,与家人朋友一起分享这份美味和快乐吧!了解氯气的物理性质,包括颜色、气味、状态、密度等。
掌握氯气的化学性质,包括与金属、非金属、水、碱的反应。
理解氯气的来源和用途,了解其在工业和日常生活中的重要性。
难点:氯气的物理性质和化学性质的关系,氯气的制备和储存。
课前预习:阅读本节教材,了解氯气的颜色、气味、状态等物理性质,尝试预测其在日常生活中的用途。
课堂讲解:通过实验和演示,讲解氯气的化学性质,包括与金属、非金属、水、碱的反应。
同时讲解氯气的来源和用途。
实验操作:通过实验操作,让学生亲手体验氯气的性质,并观察其与水反应的结果。
课后复习:复习本节内容,完成课后练习题,加深对氯气性质的理解。
对比学习法:对比氯气与其他气体的物理性质和化学性质,找出异同点。
实验法:通过实验操作,观察氯气的性质和反应结果,加深理解。
问题引导法:提出具有引导性的问题,让学生在解决问题的过程中掌握知识。
课堂表现:观察学生在课堂上的参与度,是否能积极回答问题。
实验操作:评估学生的实验操作技能和观察能力。
课后作业:完成课后练习题,评估学生对氯气性质的理解程度。
知识目标:掌握氯气的物理性质、化学性质及用途。
能力目标:通过实验探究,培养学生的观察能力、实验操作能力和归纳能力。
情感态度和价值观目标:培养学生对化学现象的好奇心,提高学习化学的兴趣。
导入新课:通过展示氯气的相关图片和视频,引导学生思考氯气的性质及其应用。
探究氯气的物理性质:通过观察氯气的外观、闻其气味,得出氯气的物理性质。
探究氯气的化学性质:通过实验探究氯气与金属、非金属、水的反应,得出氯气的化学性质。
氯气的用途:通过讲解和展示相关图片,介绍氯气在工业、生活和科研中的应用。
课堂练习:通过练习题,巩固学生对氯气性质的理解和应用。
总结与回顾:通过回顾本节课的内容,总结氯气的性质及其应用。
评价方式:通过观察学生的实验操作、回答问题情况进行评价,同时结合课后练习进行检测。
反馈方式:给予学生及时反馈,针对出现的问题进行指导和讲解。
反思本节课的教学内容是否符合学生的认知规律和学习需求。
反思教学方法是否有效,是否能激发学生的学习兴趣和参与度。
反思评价方式是否合理,是否能真实反映学生的学习情况。
针对存在的问题,思考如何改进教学方法和内容,提高教学效果。
相关图片和视频素材。
氯气是一种常见的化学物质,具有广泛的工业和日常生活应用。
然而,因其特有的物理和化学性质,氯气在生产、储存和使用过程中也存在一定的安全风险。
因此,对氯气的性质进行深入的研究和理解,对于防范其潜在的危险性,合理利用其特性,具有重要的现实意义。
本文将重点探讨氯气的性质研究及在教学过程中的逻辑设计。
氯气是一种黄绿色、有毒、有强烈刺激性气味的气体。