高一化学参考答案(仅供参考)
- 格式:doc
- 大小:36.00 KB
- 文档页数:1

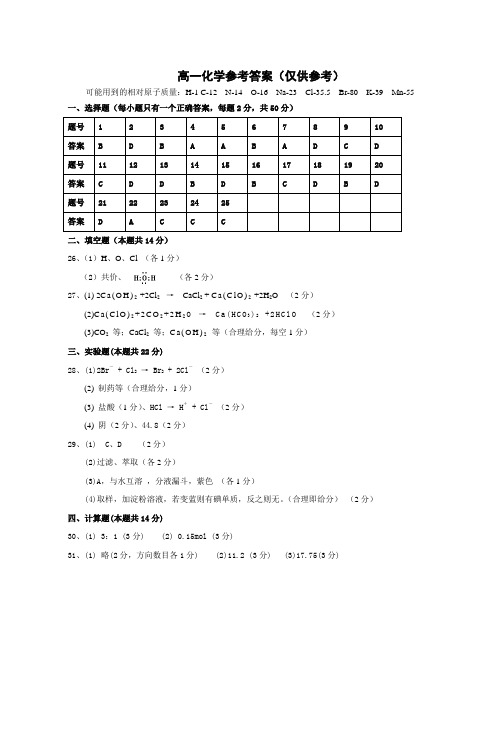
高一化学必修1 课后习题参考答案第一章第一节1.C 2.C 3.CD 4.略5.乳化原理或萃取原理6.利用和稀盐酸反应产生气体7.不可靠,因为碳酸钡也是白色沉淀,碳酸根干扰了硫酸根的检验。
由于硫酸钡是难溶的强酸盐,不溶于强酸,而碳酸钡是难溶弱酸盐,可溶于强酸,因此可先取样,再滴入氯化钡溶液和几滴稀硝酸或稀盐酸,如果出现白色沉淀,说明有硫酸根。
第一章第二节1.D 2.B 3.B 4.B5.65 mg/dL ~110mg/dL (1mmol=10-3mol)6.这种操作会使得结果偏低,因为倒出去的溶液中含有溶质,相当于容量瓶内的溶质有损失。
7.14mL8.n(Ca):n(Mg):n(Cu):n(Fe)=224:140:35:29.1)0.2mol 2)Cu2+:0.2mol Cl-:0.4mol10.40 (M=40 g/mol,该气体的相对分子质量为40。
)第一章复习题1.C 2.B 3.A 4.BC 5.C6.(1) 不正确。
(标况下)(2)不正确。
(溶液体积不为1L)(3)不正确。
(水标况下不是气体)(4)正确。
(同温同压下气体的体积比即为物质的量之比,也就是分子个数比)7.(1)5% (2)0.28mol/L8.铁粉过滤Fe、CuFeSO4溶液稀硫酸过滤FeSO4溶液蒸发结晶9.1.42 g,操作步骤略。
第二章第一节1.②⑧①④⑤⑥⑦⑩⑨ 2.树状分类法略5.7.胶体区别于其他分散系得本质特征是胶体粒子的大小在1~100nm范围。
胶体的应用,例如明矾净水、豆浆加石膏成豆腐、静电除尘、江河入海口易形成沙洲、血液透析、饱和氯化铁溶液用于应急性止血等。
第二章第二节1.水溶液熔融状态电离阴阳离子阳离子 H+ 阴离子 OH- 金属离子或铵根离子酸根离子 H+ + OH-=H2O2.两种电解质在溶液中相互交换离子的反应生成难溶物、易挥发物质、弱电解质3.C 4.C 5.C 6.B 7.D8.(1) NaOH=Na++OH- (2) CuCl2=Cu2++2Cl-(3) Fe2(SO4)3=2Fe3++3SO42- (4) Ba(NO3)2=Ba2++2NO3-9.(1) SO42-+Ba2+=BaSO4 (2) 2Al+3Hg2+=3Hg+2Al3+(3) CO32-+2H+=H2O+CO2 (4) 不反应。

高一化学学试题及答案一、选择题(每题3分,共30分)1. 下列物质中,属于纯净物的是:A. 矿泉水B. 蒸馏水C. 空气D. 盐水答案:B2. 化学反应中,反应物的总能量高于生成物的总能量,则该反应是:A. 吸热反应B. 放热反应C. 既不吸热也不放热D. 无法判断答案:B3. 根据元素周期表,下列元素中属于金属元素的是:A. 碳B. 氧C. 钠D. 硫答案:C4. 根据化学方程式,下列物质中不能作为还原剂的是:A. 氢气B. 氧气C. 铁D. 铜5. 在标准状况下,1摩尔任何气体的体积约为:A. 22.4升B. 22.4毫升C. 224升D. 2240毫升答案:A6. 根据酸碱中和反应的原理,下列物质中属于酸的是:A. 碳酸钠B. 氢氧化钠C. 硫酸D. 氢氧化钙答案:C7. 根据化学键的类型,下列物质中属于离子化合物的是:A. 二氧化碳B. 氯化钠C. 氮气D. 氢气答案:B8. 在化学反应中,催化剂的作用是:A. 改变反应速率B. 改变反应物的量C. 改变生成物的量D. 改变反应的平衡位置答案:A9. 根据氧化还原反应的原理,下列物质中属于氧化剂的是:B. 氧气C. 铁D. 铜答案:B10. 在化学实验中,用于加热的仪器是:A. 试管B. 烧杯C. 量筒D. 漏斗答案:A二、填空题(每空2分,共20分)1. 铁在氧气中燃烧生成的化合物是______。
答案:四氧化三铁2. 根据质量守恒定律,化学反应前后______不变。
答案:元素种类和质量3. 氢氧化钠的化学式是______。
答案:NaOH4. 硫酸铜溶液呈______性。
答案:酸性5. 根据电子排布规律,最外层电子数为8的元素属于______区元素。
答案:稳定6. 根据酸碱中和反应的原理,酸和碱反应生成盐和______。
答案:水7. 根据化学键的类型,共价化合物中存在的化学键是______。
答案:共价键8. 根据氧化还原反应的原理,氧化剂在反应中被______。

高一化学试题及答案(免费)
本文档为高一化学试题及答案,共包含800字以上的内容。
以下是试题及答案的详细内容:
1. 试题题目:化学反应速率的影响因素
答案:化学反应速率受温度、浓度、催化剂和表面积等因素的影响。
2. 试题题目:离子键和共价键的区别
答案:离子键是由电子的转移形成的,电子从金属原子转移到非金属原子,在形成的化学式中带电的离子彼此吸引着;共价键是由电子共享形成的,电子对彼此吸引力造成的相互排斥被核吸引而被束缚在一起。
3. 试题题目:为什么钠在水中会发生剧烈的反应?
答案:钠在水中会发生剧烈的反应是因为钠是活泼金属,它与水反应时,会迅速氧化产生氢气,并释放出大量的热量。
4. 试题题目:简述酸和碱的性质及区别。
答案:酸是指能产生H+离子的物质,具有酸味和腐蚀性;碱
是指能产生OH-离子的物质,具有苦味和滑润性。
酸和碱的区别在
于酸味和腐蚀性与苦味和滑润性的不同以及产生的离子不同。
5. 试题题目:举例说明物质的物理性质和化学性质。
答案:物质的物理性质是指物质在不改变其化学组成的情况下
表现出来的性质,如颜色、密度、熔点等;物质的化学性质是指物
质在与其他物质发生化学反应时表现出来的性质,如燃烧、氧化等。


《化学(必修)1》 课后习题参考答案第一章第一节 p101.C 2.C 3.CD 4.略5.乳化原理或萃取原理 6.利用和稀盐酸反应产生气体7.不可靠,因为碳酸钡也是白色沉淀,碳酸根干扰了硫酸根的检验。
由于硫酸钡是难溶的强酸盐,不溶于强酸,而碳酸钡是难溶弱酸盐,可溶于强酸,因此可先取样,再滴入氯化钡溶液和几滴稀硝酸或稀盐酸,如果出现白色沉淀,说明有硫酸根。
第一章第二节 p171.D 2.B 3.B 4.B5.65 mg/dL ~110mg/dL (1mmol=10-3mol )6.这种操作会使得结果偏低,因为倒出去的溶液中含有溶质,相当于容量瓶内的溶质有损失。
7.14mL8.n(Ca):n(Mg):n(Cu):n(Fe)=224:140:35:2 9.1)0.2mol 2)Cu2+:0.2mol Cl-:0.4mol 10.40 (M=40 g/mol ,该气体的相对分子质量为40。
)第一章复习题 p191.C 2.B 3.A 4.BC 5.C6.(1) 不正确。
(标况下或没有明确O2的状态)(2)不正确。
(溶液体积不为1L )或氢氧化钠加入水中后,形成溶液的体积不能确定 (3)不正确。
(水标况下不是气体)或水在常温下是液体(4)正确。
(同温同压下气体的体积比即为物质的量之比,也就是分子个数比) 7.(1)5% (2)0.28mol/L 8.9.1.42 g , 操作步骤 (1)计算所需硫酸钠的质量,m (硫酸钠)=0.2mol/L×0.05L×142g/mol=0.56g(2) 称量(3)溶解并冷却至室温(4)转移至50ml 容量瓶,并洗涤小烧杯2次~3次,将洗涤液转移到容量瓶中,轻轻摇动容量瓶,使溶液混合均匀铁 粉 过 滤Fe 、CuFeSO 4溶液稀硫酸过 滤FeSO 4溶液蒸发 结晶第二章第一节p291.②⑧①④⑤⑥⑦⑩⑨2.树状分类法略6.BD7.胶体区别于其他分散系得本质特征是胶体粒子的大小在1~100nm范围。
人教版高一化学必修一课后习题答案《化学(必修)1》课后习题参考答案第一章第一节 p10 1.C2.C3.CD4.略5.乳化原理或萃取原理6.利用和稀盐酸反应产生气体7.不可靠,因为碳酸钡也是白色沉淀,碳酸根干扰了硫酸根的检验。
由于硫酸钡是难溶的强酸盐,不溶于强酸,而碳酸钡是难溶弱酸盐,可溶于强酸,因此可先取样,再滴入氯化钡溶液和几滴稀硝酸或稀盐酸,如果出现白色沉淀,说明有硫酸根。
第一章第二节 p17 1.D 2.B 3.B4.B5.65 mg/dL ~110mg/dL(1mmol=10-3mol)6.这种操作会使得结果偏低,因为倒出去的溶液中含有溶质,相当于容量瓶内的溶质有损失。
7.14mL8.n(Ca):n(Mg):n(Cu):n(Fe)=224:140:35:2 9.1)0.2mol2)Cu2+:0.2molCl-:0.4mol 10.40(M=40 g/mol,该气体的相对分子质量为40。
)第一章复习题 p19 1.C 2.B 3.A 4.BC 5.C 6.(1)不正确。
(标况下或没有明确O2的状态)(2)不正确。
(溶液体积不为1L)或氢氧化钠加入水中后,形成溶液的体积不能确定(3)不正确。
(水标况下不是气体)或水在常温下是液体(4)正确。
(同温同压下气体的体积比即为物质的量之比,也就是分子个数比)7.(1)5%(2)0.28mol/L 8.9.1.42 g,操作步骤(1)计算所需硫酸钠的质量,m(硫酸钠)=0.2mol/L×0.05L×142g/mol=0.56g(2)称量(3)溶解并冷却至室温(4)转移至50ml容量瓶,并洗涤小烧杯2次~3次,将洗涤液转移到容量瓶中,轻轻摇动容量瓶,使溶液混合均匀第二章第一节 p29 1.②⑧①④⑤⑥⑦⑩⑨ 2.树状分类法略5.分散系分散质粒子大小主要特征举例浊液>100 nm不稳定,不均一泥浆水溶液稳定,均一饱和NaCl溶液胶体1~100 nm较稳定,均一豆浆6.BD7.胶体区别于其他分散系得本质特征是胶体粒子的大小在1~100nm范围。
高一化学练习册答案一、选择题1. 根据题目分析,正确答案是B。
2. 根据题目所给的化学反应方程式,正确答案是C。
3. 根据物质的量守恒定律,正确答案是A。
4. 根据题目所给的实验现象,正确答案是D。
5. 根据原子结构的相关知识,正确答案是E。
二、填空题1. 物质的量单位是摩尔,符号为mol。
2. 化学反应中,反应物和生成物的总能量之差称为反应热。
3. 根据题目所给的化学方程式,反应物A的摩尔质量为40g/mol。
4. 根据题目所给的溶液浓度,可以计算出溶质的质量为5g。
5. 根据题目所给的原子结构示意图,该元素的原子序数为17。
三、简答题1. 化学反应速率的影响因素包括温度、压力、催化剂和反应物浓度等。
2. 根据题目所给的化学方程式,可以写出反应物和生成物的化学式。
3. 根据题目所给的实验数据,可以计算出反应的平衡常数K。
四、计算题1. 根据题目所给的化学方程式和已知条件,可以计算出反应物的摩尔数。
2. 根据题目所给的溶液浓度和体积,可以计算出溶液中溶质的摩尔数。
3. 根据题目所给的原子结构,可以计算出该元素的电子排布。
五、实验题1. 实验目的:验证化学反应的可逆性。
2. 实验原理:根据化学平衡原理,反应物和生成物在一定条件下可以相互转化。
3. 实验步骤:按照题目所给的实验步骤进行操作。
4. 实验结果:观察到反应物和生成物在一定条件下可以相互转化,验证了化学反应的可逆性。
5. 实验结论:化学反应具有可逆性。
结束语:本练习册答案仅供参考,希望同学们在做题过程中能够深入理解化学知识,提高解题能力。
同时,要注意培养科学探究精神,不断探索化学世界的奥秘。
高一化学必修1 课后习题参考答案第一章第一节1.C 2.C 3.CD 4.略5.乳化原理或萃取原理6.利用和稀盐酸反应产生气体7.不可靠,因为碳酸钡也是白色沉淀,碳酸根干扰了硫酸根的检验。
由于硫酸钡是难溶的强酸盐,不溶于强酸,而碳酸钡是难溶弱酸盐,可溶于强酸,因此可先取样,再滴入氯化钡溶液和几滴稀硝酸或稀盐酸,如果出现白色沉淀,说明有硫酸根。
第一章第二节1.D 2.B 3.B 4.B5.65 mg/dL ~110mg/dL (1mmol=10-3mol)6.这种操作会使得结果偏低,因为倒出去的溶液中含有溶质,相当于容量瓶内的溶质有损失。
7.14mL8.n(Ca):n(Mg):n(Cu):n(Fe)=224:140:35:29.1)0.2mol 2)Cu2+:0.2mol Cl-:0.4mol10.40 (M=40 g/mol,该气体的相对分子质量为40。
)第一章复习题1.C 2.B 3.A 4.BC 5.C6.(1) 不正确。
(标况下)(2)不正确。
(溶液体积不为1L)(3)不正确。
(水标况下不是气体)(4)正确。
(同温同压下气体的体积比即为物质的量之比,也就是分子个数比)7.(1)5% (2)0.28mol/L8.铁粉过滤Fe、CuFeSO4溶液稀硫酸过滤FeSO4溶液蒸发结晶9.1.42 g,操作步骤略。
第二章第一节1.②⑧①④⑤⑥⑦⑩⑨ 2.树状分类法略5.7.胶体区别于其他分散系得本质特征是胶体粒子的大小在1~100nm范围。
胶体的应用,例如明矾净水、豆浆加石膏成豆腐、静电除尘、江河入海口易形成沙洲、血液透析、饱和氯化铁溶液用于应急性止血等。
第二章第二节1.水溶液熔融状态电离阴阳离子阳离子 H+ 阴离子 OH- 金属离子或铵根离子酸根离子 H+ + OH-=H2O2.两种电解质在溶液中相互交换离子的反应生成难溶物、易挥发物质、弱电解质3.C 4.C 5.C 6.B 7.D8.(1) NaOH=Na++OH- (2) CuCl2=Cu2++2Cl-(3) Fe2(SO4)3=2Fe3++3SO42- (4) Ba(NO3)2=Ba2++2NO3-9.(1) SO42-+Ba2+=BaSO4 (2) 2Al+3Hg2+=3Hg+2Al3+(3) CO32-+2H+=H2O+CO2 (4) 不反应。