无机化学-硼族、碳族元素-氢化物 (1)
- 格式:ppt
- 大小:5.70 MB
- 文档页数:31


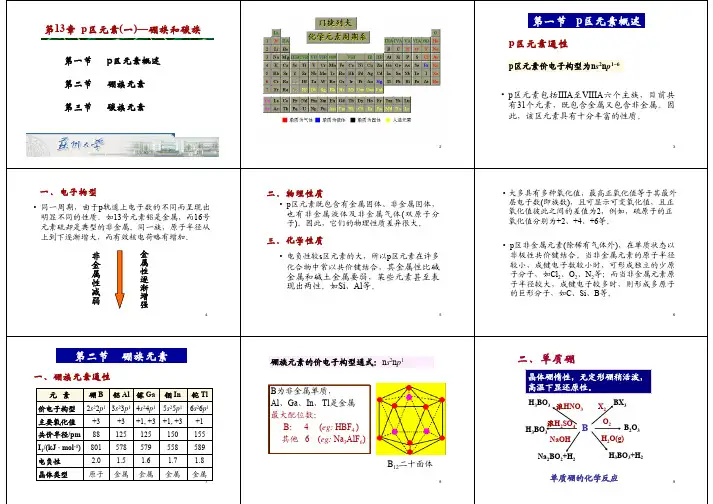
一硼单质及其化合物制作成员:摆宫泽贾震韦仕富(1) 硼单质硼单质可以分为晶体与无定形两大类。
晶体硼呈灰黑色,硬度极高,导电性差,但它的电导率却随着温度的升高而增大,从而显示出与金属导体的不同。
不太纯的无定形硼为棕色粉末。
晶体硼单质的化学反应活性较低,无定形硼相对活泼。
①硼单质的晶体结构晶体硼单质基本结构单元为正二十面体,12个硼原子占据着多面体的顶点。
α—菱形硼:B12结构单元间的硼硼化学键属于三中心二电子键。
由片层间B12结构单元按面心立方最密堆积方式形成晶体,其中所以硼原子间均形成共价键,使单质硬度大,导热能力强,导电能力弱。
β—菱形硼:结构更复杂,其中含B84结构单元。
②硼单质的化学性质1 常温下与F2化合:2B+3F2=2BF32 在空气中燃烧,放出大量热:4B+3O2=2B2O33 由于硼氢键的键能很大,所以硼能从许多稳定的氧化物如SiO2,P2O5中夺取氧。
硼在炼钢过程中可以作为去氧剂。
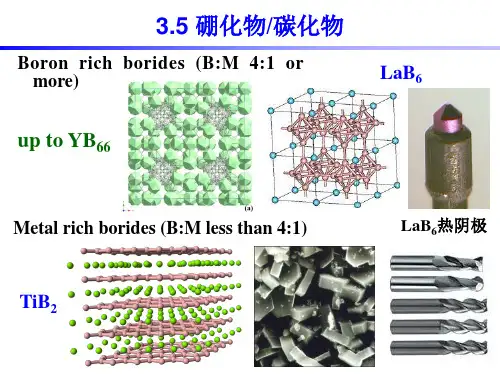
4 赤热下,无定形硼与水蒸气反应:2B+6H2O(g)=2B(OH)3+2H25 在高温下硼能同N2,S,X2等非金属单质反应2B+N2=2BN2B+3Cl2=2BCl22B+3S=B2S36 在高温下硼也能同金属反应生成金属硼化物,如NbB4,ZrB2,LaB6等。
硼化物一般具有高硬度高熔点。
7 无定形硼不与非氧化性酸作用,但可以与热浓H2SO4,热的HNO3反应:B+3HNO3(浓)=B(OH)3+3NO2↑2B+3H2SO4(浓)=2B(OH)3+3SO2↑8 有氧化剂存在时,硼与强碱共熔可得到偏硼酸盐:2B+2NaOH+3KNO3=2NaBO2+3KNO2+H2O③硼单质的制备工业上用碱法分解硼镁矿制取单质硼。
Mg2B2O5•H2O+2NaBO2=2NaBO2+2Mg(OH)24NaBO2+CO2+10H2O=NaB4O7•10H2O+Na2CO3NaB4O7+H2SO4+5H2O=4H3BO3+Na2SO42H3BO3=B2O3+3H2OB2O3+Mg=2B+3MgO用硫酸与硼镁矿反应一步制得硼酸:Mg2B2O5•H2O+2H2SO4=2H3BO3+2MgSO4(2) 硼氢化合物称为硼烷,已知的有:B2H6,B4H10,B5H9,B8H16,B8H18等,BnHn+4与BnHn+6共20 多种。




常见元素的化合价记忆口诀
一、碱金属(IA族元素):一价阳离子
二、氢氧化物:氢氧化物,氢氧化金属
二、碱土金属(IIA族元素):二价阳离子
其中铍镁钙锌,铍镁钙锌镁铵
三、硼族元素(IIIA族元素):三价阳离子
硼及其氯化物,硼氯氧植堆一旁
四、碳族元素(IVA族元素):四价
碳硅锗锡铅石,硅锗锡铅石碳
五、氮族元素(VA族元素):五价
氮磷及砷锑,碘钋砷锑氮
六、氧族元素(VIA族元素):二价阴离子
氧硫硒及硒碲,氧硫硒碲氧
七、卤素族元素(VIIA族元素):一价阴离子
氟氯碘溴氟,氯溴碘氟氯
八、氢元素(IA族元素):一价阳离子
除了卤素,氢唯一
九、八、氢与十八族元素(0、VIII、VIIIA族元素):不形成离子
氢氧氟化合物,水、氢氧化物
十、二十与十八族元素(0、IIB、VIIIB族元素):通常是二价阳离子
锌及镍铜银,亚铁锰钴亦能
以上是常见元素的化合价记忆口诀,用于帮助记忆元素的化合价。

化学竞赛无机化学绝密课件硼族元素-(含多场合)化学竞赛无机化学绝密课件硼族元素摘要:本文主要介绍了化学竞赛中无机化学部分的重要知识点——硼族元素。
通过对硼族元素的概述、性质、化合物以及应用等方面的详细讲解,旨在帮助参赛者更好地掌握这一部分内容,提高化学竞赛成绩。
一、硼族元素概述硼族元素位于元素周期表的第二族,包括硼(B)、铝(Al)、镓(Ga)、铟(In)和铍(Tl)等元素。
硼族元素在自然界中分布广泛,其中硼和铝是地壳中含量较多的元素。
硼族元素在化学性质上具有一定的相似性,但在物理性质和应用方面存在较大差异。
二、硼族元素的性质1.电子结构:硼族元素的原子结构中,最外层电子数为3个,因此它们在化学反应中容易失去3个电子,形成+3价离子。
2.金属性和非金属性:从上到下,硼族元素的金属性逐渐增强,非金属性逐渐减弱。
硼和铝具有较强的非金属性,而铟和铍的金属性较强。
3.离子半径:硼族元素的离子半径随着原子序数的增加而增大,这是因为原子核对最外层电子的吸引力逐渐减弱。
4.电负性:硼族元素的电负性随着原子序数的增加而减小,这是因为原子核对最外层电子的吸引力逐渐减弱。
三、硼族元素的化合物1.氧化物:硼族元素与氧元素形成的氧化物具有多种类型,如硼酸、氧化铝、氧化镓等。
这些氧化物在工业、医药等领域具有广泛的应用。
2.硼化物:硼族元素与金属元素形成的硼化物具有高熔点、高硬度和良好的导电性等特点,如碳化硼、氮化硼等。
3.氢化物:硼族元素与氢元素形成的氢化物在有机合成中具有重要应用,如硼氢化钠、硼氢化铝等。
4.硼酸盐:硼酸盐是一类重要的无机化合物,如硼砂、硼酸铝等。
它们在玻璃、陶瓷、洗涤剂等领域具有广泛应用。
四、硼族元素的应用1.金属铝:铝是硼族元素中应用最广泛的元素,广泛应用于建筑、交通、包装、电力等领域。
铝具有良好的导电性、导热性和轻质等特点,是国民经济的重要支柱产业。
2.硼化合物:硼化合物在农业、医药、化工等领域具有重要应用。


无机化学总结硼族元素无机化学总结硼族元素无机化学总结硼族元素一硼单质及其化合物制作成员:摆宫泽贾震韦仕富硼单质硼单质可以分为晶体与无定形两大类。
晶体硼呈灰黑色硬度极高,导电性差但它的电导率却随着温度的升高而增大从而显示出与金属导体的不同。
不太纯的无定形硼为棕色粉末。
晶体硼单质的化学反应活性较低无定形硼相对活泼。
硼单质的晶体结构晶体硼单质基本结构单元为正二十面体,12个硼原子占据着多面体的顶点。
a—菱形硼:B12结构单元间的硼硼化学键属于三中心二电子键。
由片层间B12结构单元按面心立方最密堆积方式形成晶体其中所以硼原子间均形成共价键使单质硬度大导热能力强,导电能力弱。
B—菱形硼:结构更复杂其中含B84结构单元。
硼单质的化学性质常温下与F2化合:2B+3F2=2BF3在空气中燃烧放出大量热:4B+3O2=2B2O33由于硼氢键的键能很大所以硼能从许多稳定的氧化物如SiO2,P2O5中夺取氧。
硼在炼钢过程中可以作为去氧剂。
4赤热下无定形硼与水蒸气反应:2B+6H2O(g)=2B(OH)3+2H2 5在高温下硼能同N2,S,_2等非金属单质反应2B+N2=2BN2B+3CI2=2BCI22B+3S=B2S36在高温下硼也能同金属反应生成金属硼化物如NbB4,ZrB2,LaB6等。
硼化物一般具有咼硬度咼熔点。
7无定形硼不与非氧化性酸作用但可以与热浓H2SO4,热的HN03反应:B+3HN03(浓)=B(OH)3+3NO2f2B+3H2SO4(浓)=2B(0H)3+3SO2f8有氧化剂存在时硼与强碱共熔可得到偏硼酸盐:2B+2NaOH+3KNO3=2NaBO2+3KNO2+H2O硼单质的制备工业上用碱法分解硼镁矿制取单质硼。
Mg2B2O5?H2O+2NaBO2=2NaBO2+2Mg(OH)24NaBO2+CO2+10H2O=NaB4O7?10H2O+Na2CO3NaB4O7+H2SO4+5H2O=4H3BO3+Na2SO42H3BO3=B2O3+3H2OB2O3+Mg=2B+3MgO用硫酸与硼镁矿反应一步制得硼酸:Mg2B2O5?H2O+2H2SO4=2H3BO3+2MgSO4硼氢化合物称为硼烷已知的有:B2HqB4Hio,B5H9,B8Hi6,B8Hi8等,BnHn+4与BnHn+6共20多种。
氢qing1 氦hai4锂li3 铍pi2 硼peng2 碳tan4 氮dan4 氧yang3 氟fu2 氖nai3钠na4 镁mei3 铝lv3 硅gui1 磷lin2 硫liu2 氯lv4 氩ya4钾jia3 钙gai4 钪kang4 钛tai4 钒fan2 铬ge4 锰meng3 铁tie3 钴gu3 镍nie4 铜tong2 锌xin1 镓jia1 锗zhe3砷shen1 硒xi1 溴xiu4 氪ke4铷ru2 锶si1 钇yi3 锆gao4 铌ni2 钼mu4 锝de2 钌liao3 铑lao3 钯ba3 银yin2 镉ge2 铟yin1 锡xi1 锑ti1 碲di4 碘dian3 氙xian1铯se4 钡bei4 镧lan2 铈shi4 镨pu3 钕nv3 钷po3 钐shan1 铕you3 钆ga2 铽te4 镝di1 钬huo3 铒er3 铥diu1 镱yi4 镥lu3 铪ha1 钽tan3 钨wu1 铼lai2 锇e2 铱yi1 铂bo2 金jin1 汞gong3 铊ta1 铅qian1 铋bi4 钋po1 砹ai4 氡dong1钫fang1 镭lei2 锕a1 钍tu3 镤pu2 铀you2 镎na2 钚bu4 镅mei2 锔ju2 锫pei2 锎kai1 锿ai1 镄fei4 钔men2 锘nuo4 铹lao2 钅卢lu2 钅杜du4 钅喜xi3 钅波bo1 钅黑hei1 钅麦mai4 钅达da2 钅仑lun2氢(H)氢是元素周期表中的第一号元素,元素名来源于希腊文,原意是"水素"。
氢是由英国化学家卡文迪许在1766年发现,称之为可燃空气,并证明它在空气中燃烧生成水。
1787年法国化学家拉瓦锡证明氢是一种单质并命名。
氢在地壳中的丰度很高,按原子组成占15.4%,但重量仅占1%。
在宇宙中,氢是最丰富的元素。
在地球上氢主要以化和态存在于水和有机物中。
有三种同位素:氕、氘、氚。