配位化学的创始人---维尔纳(AlfredWerner)
- 格式:pdf
- 大小:233.45 KB
- 文档页数:5

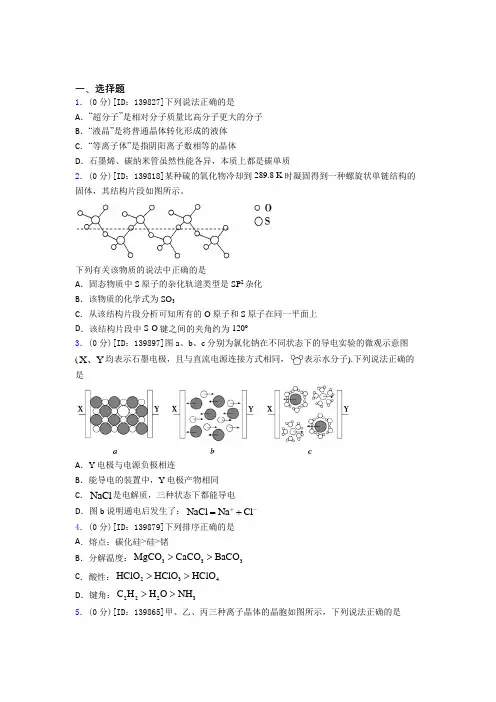
一、选择题1.(0分)[ID :139827]下列说法正确的是 A .“超分子”是相对分子质量比高分子更大的分子 B .“液晶”是将普通晶体转化形成的液体 C .“等离子体”是指阴阳离子数相等的晶体D .石墨烯、碳纳米管虽然性能各异,本质上都是碳单质2.(0分)[ID :139818]某种硫的氧化物冷却到289.8 K 时凝固得到一种螺旋状单链结构的固体,其结构片段如图所示。
下列有关该物质的说法中正确的是A .固态物质中S 原子的杂化轨道类型是SP 2杂化B .该物质的化学式为SO 3C .从该结构片段分析可知所有的O 原子和S 原子在同一平面上D .该结构片段中S-O 键之间的夹角约为120º3.(0分)[ID :139897]图a 、b 、c 分别为氯化钠在不同状态下的导电实验的微观示意图(X Y 、均表示石墨电极,且与直流电源连接方式相同,表示水分子).下列说法正确的是A .Y 电极与电源负极相连B .能导电的装置中,Y 电极产物相同C .NaCl 是电解质,三种状态下都能导电D .图b 说明通电后发生了:NaCl Na Cl +-=+ 4.(0分)[ID :139879]下列排序正确的是 A .熔点:碳化硅>硅>锗B .分解温度:333MgCO CaCO BaCO >>C .酸性:234HClO HClO HClO >>D .键角:2223C H H O NH >>5.(0分)[ID :139865]甲、乙、丙三种离子晶体的晶胞如图所示,下列说法正确的是A .甲的化学式(X 为阳离子)为XYB .乙中A 、B 、C 三种微粒的个数比是1:3:1 C .丙是CsCl 晶体的晶胞D .乙中与A 距离最近且相等的B 有8个 6.(0分)[ID :139863]下列叙述正确的是 A .熔沸点由高到低的顺序:AsH 3>PH 3>NH 3 B .熔沸点由高到低的顺序:硅>金刚石>NaCl>I 2C .某物质熔点 1067℃,易溶于水,其水溶液和熔融态均能导电,其晶体一定为离子晶体D .硫磺与金刚石晶体熔化时,所克服的微粒间相互作用相同 7.(0分)[ID :139855]下列有关说法正确的是A .新能源可燃冰(CH 4•nH 2O)中甲烷分子与水分子之间存在氢键B .SO 3 与 HCHO 的分子空间构型均为平面三角形,都是非极性分子C .HClO 分子中既有“s -p σ键”又有“p -p σ键”D .向含有1 mol [Co(NH 3)4Cl 2]Cl 的水溶液中加入足量AgNO 3溶液能生成3mol AgCl 8.(0分)[ID :139850]下列晶体中属于原子晶体的是 A .I 2B .SiCC .CuD .CsCl9.(0分)[ID :139846]下列说法不正确的是A .用价层电子对互斥理论预测H 2S 、BF 3的立体结构分别为V 形、平面正三角形B .分子晶体中一定存在分子间作用力,不一定存在共价键C .1 mol 晶体硅中含有4 mol Si-Si 键D .仅含极性共价键的分子可以是极性分子,也可以是非极性分子10.(0分)[ID :139837]吡啶又称为氮苯,与苯都有大π键。



配位化学的创始人---维尔纳(Alfred.Werner)上官亦卿(西北大学化学系05级材料化学专业 西安 710069)摘要:本文主要介绍配位化学之父——维尔纳发现配位理论的过程、所获得的成就、与同时代科学家袁根生的争论以及简谈配位化学的发展。
关键词:维尔纳 配位化学理论 配位化学的发展1913年诺贝尔奖金获得者,配位化学的奠基人维尔纳(1866—1919,瑞士)是第一个认识到金属离子可以通过不只一种“原子价”同其他分子或离子相结合以生成相当稳定的复杂物类,同时给出与配位化合物性质相符的结构概念的伟大科学家。
一、实践与挑战配位化合物曾经是对无机化学家的一个挑战。
在早期的化学中,他们似乎是不寻常的和反抗通常原子规律的。
通常元素都有固定的原子价,如Na +、O 2-、Cu +2/+3、P -3/+3/+5。
然而,某些元素的化合物却难以用通常原子价图式去解释。
例如Cr 的原子价是+3,为什么原子价都已经满足CrCl 分子和NH 分子,却依然能够相互作用形成CrCl ·6NH 分子?同样,PtCl 可以继续同NH 作用生成PtCl ·4NH ?33332323对于CoCl 3·6H 2O 的有趣故事,人们知道的更早。
1799年的塔萨厄尔(Tassaert)往CoCl 2溶液中加入氨水,先生成Co(OH)2沉淀,继续加入氨水则Co(OH)2溶解,放置一天后便析出一种橙色晶体,经过分析得知是CoCl 3·6NH 3,Co(OH)2在过量氨的存在下被氧化成3价。
起初,人们把这种橙色晶体看成是稳定性较差的CoCl 3和6NH 3分子加合物;但事实却相反,当把它加热到150°C 时,却无法释放出氨;用稀硫酸溶解后,回流几个小时也不生成硫酸铵。
这一特征引起了人们的注意[1]。
1847年前后,根特(F.A.Genth)进一步研究了三价钴盐与氨生成的几种化合物,并分析了他们的组成。


配合物思考题与答案1.设计一些实验,证明粗盐酸的黄色是Fe3+与Cl-的络离子而不是铁的水合离子或者羟合离子的颜色。
(略)2.配位化学创始人维尔纳发现,将等物质的量的黄色CoCl3.6NH3﹑紫红色CoCl3.5NH3﹑绿色CoCl3.4NH3和紫色CoCl3.4NH3四种配合物溶于水,加入硝酸银,立即沉淀的氯化银分别为3 ﹑2 ﹑1 ﹑1mol,请根据实验事实推断它们所含的配离子的组成。
答:配离子分别是[Co(NH3)6]3+, [Co(NH3)5Cl]2+ , [Co(NH3)4Cl2] +, [Co(NH3)4Cl2] +,颜色不同的原因是有同分异构体。
3.实验测得Fe(CN)64-和Co(NH3) 63+均为反磁性物质(磁矩等于零),问它们的杂化轨道类型。
答:中心二价Fe2+亚铁离子外层价电子排布是3d6,有4个未成对电子,测得Fe(CN)64-为抗磁性物质,说明中心的铁离子的外层价电子排布发生变化,进行了重排,使得内层3d轨道上没有未成对电子,所以应采取的是d2sp3杂化方式。
三价Co离子外层价电子排布也是3d6,也有4个未成对电子,测得Co(NH3) 63+为反磁性物质,原理同上,也是d2sp3杂化方式。
4.实验证实,Fe(H2O)63+和Fe(CN) 63-的磁矩差别极大,如何用价键理论来理解?答:Fe(H2O)63+的中心离子铁是采用sp3d2杂化方式,外轨型配合物,高自旋,有5个成单电子,磁矩高;而Fe(CN) 63-采用的是d2sp3杂化方式,内轨型配合物,低自旋,只有1个成单电子,所以磁矩低。
5.上题的事实用晶体场理论又作如何理解?略6.用晶体场理论定性地说明二价和三价铁的水合离子的颜色不同的原因。
略7.FeF63-为 6 配位,而FeCl4-为四配位,应如何解释?答:三价Fe的外层价电子层电子排布是3d3,d轨道上有2个空轨道。
同样作为中心离子,作为负电荷的配体之间的排斥力是需要重点考虑的。




维尔纳(Alfred Werner,1866~1919)
维尔纳(Alfred Werner,1866~1919)
1866年12月12日生于法国米卢斯,1919年11月15日卒于苏黎世。
1884年开始学习化学,在自已家里做化学实验。
1885~1886年, 在德国卡尔斯鲁厄工业学院听过有机化学课程。
1886年入瑞士的苏黎世联邦高等工业学校学习,1889年获工业化学毕业文凭,即做G.隆格的助手, 从事有机含氮化合物异构现象的研究,1890年获苏黎世大学博士学位。
1891~189 2年,在巴黎法兰西学院和M. 贝特洛一起做研究工作。
1892年回苏黎世联邦高等工业学校任助教,1893年任副教授, 1895年任教授。
1909 ~1915年,任苏黎世化学研究所所长。
韦尔纳是配位化学的奠基人。
他的主要贡献有:1890年和A.R.汉奇一起提出氮的立体化学理论;1893年在《无机化学领域中的新见解》一书中提出络合物的配位理论, 提出了配位数这个重要概念。
韦尔纳的理论可以说是现代无机化学发展的基础,因为它打破了只基于碳化合物研究所得到的不全面的结构理论,并为化合价的电子理论开辟了道路。
韦尔纳在无机化学领域中的新见解的可贵之处,在于抛弃了 F.A.凯
库勒关于化合价恒定不变的观点, 大胆地提出了副价的概念, 创立了配位理论。
1911年他还制得非碳的旋光性物质。
韦尔纳因创立配位化学而获得1913年诺贝尔化学奖。
他发表170余篇论文(包括与人合作的)。
著有《立体化学教程》。
配位化学的发展史摘要自从1893年瑞士化学家维尔纳创立配位化学已来,配位化学理论得到不断发展,逐渐完善。
经过化学家们100多年的努力,由传统经典的配合物,发展到今天的配位超分子化合物,并显示出结构和功能上的优越特性,成为现代无机化学的一个发展方向。
关键词配位化学晶体工程配位超分子化学自从1893年瑞士化学家维尔纳(Werner)在德国《Journal of Inorganic Chemistry》上发表了题为“对于无机化合物结构的贡献”的配位化学方面的第一篇经典著作之后[1],原本作为无机化学分支的配位化学发展极为迅速,并始终处于无机化学研究的主流。
配位化学的发展打破了传统的有机化学和无机化学之间的界限,在众多配合物中金属离子和有机配体形成的配合物以其花样繁多的价键形式和空间结构,在化学键理论发展、配合物性能等多样性方面引起了人们广泛的研究兴趣。
1 经典配位化学的产生和发展配合物的记载在很早就有,国外文献[2]最早记录的配合物—普鲁士蓝(Prussian Blue)是在1704年,其化学结构是FeIII4[FeII(CN)6]3,距今已有300年历史了。
我国《诗经》记载“缟衣茹藘”,“茹藘在阪”,实际上是二羟基蒽醌和铝钙离子生成红色配合物(比普鲁士蓝发现早2000多年)。
最早关于配合物的研究是1798年法国塔索尔特(Tassert)关于黄色氯化钴([Co(NH3)6]Cl3)的研究,他在CoCl2溶液中加入NH3•H2O 后没有得到Co(OH)3,而是得到了桔黄色结晶,起初认为是一种复合物(CoCl3•6NH3),但他在该桔黄色结晶的溶液中加碱后得不到NH3,也检查不出Co3+离子的存在,可见Co3+与NH3是紧密结合在一起的,而加AgNO3后却得到了AgCl沉淀,证明Cl-是游离的。
塔索尔特的报道使一些化学家开始研究这类化合物,因为当时的原子价理论不能解释这类化合物,故称之为复杂化合物,即络合物。
19世纪末期,德国化学家发现一系列令人难以回答的问题,氯化钴跟氨结合,会生成颜色各异、化学性质不同的物质。
为了解释上述情况,化学家曾提出各种假说,但都未能成功。
直到1893年,瑞士化学家维尔纳(A.Werner)在总结前人研究的基础上,首次提出了配合物等概念,并成功解释了很多配合物的性质,维尔纳也被称为“配位化学之父”,并因此获得了1913年的诺贝尔化学奖。
应用:1、检验金属离子、分离物质、定量测定物质的组成2、应用于染色、电镀、硬水软化、金属冶炼等领域3、激光材料、超导材料、抗癌药物的研究4、催化剂的研制配合物的应用举例(1)如何解释配合物的颜色过渡金属离子的配合物大多具有特征颜色:[Cu(H2O)4]2+为蓝色,[Co(H2O)6]2+为粉红色,[V(H2 O)6]3+为绿色,[Ti(H2O)6]3+为紫红色等.原因:配离子的简并d轨道在配体的影响下会产生分裂成能量不等的dε和dr轨道,配离子的颜色是由于中心离子d轨道上电子没有充满(d1~d9),电子可以在获得光能后在dε和dr轨道之间发生跃迁,这种跃迁称为d-d跃迁.实现这种跃迁所需要的能量为分裂能,吸收的光波波长正处于可见光范围内.当配离子吸收一定波长的可见光发生d-d跃迁后,配离子就会显示与吸收光互补的透过光的颜色.不同的配离子产生d-d跃迁时吸收光的波长不同(分裂能不同),使配离子呈现不同的颜色,d0和d10由于d轨道电子全空和全满,不会产生d-d跃迁,故配合物无色.如[Zn(H2O)4]2+配离子无色.(2)在分析化学中的应用1. 离子的鉴定常利用配合物或配离子的特征颜色鉴别某些离子.例:K4[Fe(CN)6]与Fe3+离子生成特征的蓝色Fe4[Fe(CN)6]3溶液或KSCN与Fe3+生成特征血红色溶液鉴定Fe3+离子:4Fe3++3[Fe(CN)6]4-→ Fe4[Fe(CN)6]3(蓝色) Fe3++nSCN-→[Fe(SCN)n]3-n(血红色)大多数螯合物都有特征颜色.利用丁二酮肟与Ni2+在氨性溶液中生成鲜红色的螯合物沉淀来鉴定溶液中的Ni2+存在极为灵敏.2. 离子的分离生成配合物使物质溶解度改变达到离子分离的目的.在含有Zn2+和Fe2+,Fe3+,Al3+,Ti4+离子的混合溶液中加入NH3使Zn2+生成[Zn(NH3)4]2+配离子溶于水中,而其它离子均以氢氧化物的形式沉淀,通过过滤和洗涤,可使Zn2+与这些离子分离. Zn2++4NH3==[Zn(NH3)4]2+3. 掩蔽干扰离子当测定溶液中某种离子的浓度时,干扰离子的消除最有效、简便和常用的方法是掩蔽.通常是加入被称为掩蔽剂的某种试剂,使之与干扰元素形成稳定的配合物.例如Fe3+离子的存在会影响比色法测定Co2+,若在溶液中加入掩蔽剂NaF,使共存的Fe3+生成稳定的无色[FeF6]3 -,从而排除Fe3+的干扰.Fe3++6F-→[FeF6]3-(3)在工业生产的应用提取贵金属(湿法冶金):Au与NaCN在氧化气氛中生成[Au(CN)2]-配离子将金从难溶的矿石中溶解与其不溶物分离,再用Zn粉作还原剂置换得到单质金:4Au+8NaCN+2H2O+O2→ 4Na[Au(CN)2]+4NaOHZn+2[Au(CN)2]-→ [Zn(CN)4]2-+2Au高纯金属的制备:CO能与许多过渡金属形成羰基配合物,且这些金属羧基配合物易挥发,受热后易分解成金属和CO的性质来制备高纯金属.电镀:电镀工艺中,为获得牢固,致密,均匀,光亮的镀层,需要控制金属离子的浓度,使其在镀件上缓慢还原析出——无氰镀锌问题.制镜:银镜反应:Ag+与NH3生成[Ag(NH3)2]+离子,减少了Ag+浓度,使Ag缓慢地在玻璃上析出而得到光亮的镜面.2[Ag(NH3)2]++HCHO+3OH-→ HCOO-+2Ag+4NH3+2H2O(4)在生命科学中的应用生命体中存在着许多金属配合物,它们对生命的各种代谢活动,能量转换和传递,电荷转移, O2的输送等都起着重要的作用.氧气的输送和CO中毒:如铁的配合物血红素担负着人体血液中输送O2的任务;植物的叶绿素是镁的配合物;生物体中起特殊催化作用的酶,几乎都是以配合物形式存在的金属元素,如铁酶,铜酶,锌酶等,由于酶的生物催化活性高效专一,因此在生命过程中起着重要作用.医学上,常利用配合反应治疗疾病.例如EDTA(乙二胺四乙酸或其钠盐)能与Pb2+,Hg2+形成稳定的可溶于水,且不被人体吸收的螯合物随新陈代谢排除体外,达到缓解Hg2+,Pb2+中毒的目的.柠檬酸钠也是治疗职业性铅中毒的有效药物,它能与Pb2+形成稳定配合物并迅速排出体外.此外,许多金属配合物还具有杀菌,抗癌的作用.例如[Pt(NH3)2Cl2]具有明显的抗癌作用.总之,随着配合物化学研究的不断发展和深入,配合物将在人类的生产和生活中起到更加重要的作用.。
配位化学的创始人---维尔纳(Alfred.Werner)上官亦卿(西北大学化学系05级材料化学专业 西安 710069)摘要:本文主要介绍配位化学之父——维尔纳发现配位理论的过程、所获得的成就、与同时代科学家袁根生的争论以及简谈配位化学的发展。
关键词:维尔纳 配位化学理论 配位化学的发展1913年诺贝尔奖金获得者,配位化学的奠基人维尔纳(1866—1919,瑞士)是第一个认识到金属离子可以通过不只一种“原子价”同其他分子或离子相结合以生成相当稳定的复杂物类,同时给出与配位化合物性质相符的结构概念的伟大科学家。
一、实践与挑战配位化合物曾经是对无机化学家的一个挑战。
在早期的化学中,他们似乎是不寻常的和反抗通常原子规律的。
通常元素都有固定的原子价,如Na +、O 2-、Cu +2/+3、P -3/+3/+5。
然而,某些元素的化合物却难以用通常原子价图式去解释。
例如Cr 的原子价是+3,为什么原子价都已经满足CrCl 分子和NH 分子,却依然能够相互作用形成CrCl ·6NH 分子?同样,PtCl 可以继续同NH 作用生成PtCl ·4NH ?33332323对于CoCl 3·6H 2O 的有趣故事,人们知道的更早。
1799年的塔萨厄尔(Tassaert)往CoCl 2溶液中加入氨水,先生成Co(OH)2沉淀,继续加入氨水则Co(OH)2溶解,放置一天后便析出一种橙色晶体,经过分析得知是CoCl 3·6NH 3,Co(OH)2在过量氨的存在下被氧化成3价。
起初,人们把这种橙色晶体看成是稳定性较差的CoCl 3和6NH 3分子加合物;但事实却相反,当把它加热到150°C 时,却无法释放出氨;用稀硫酸溶解后,回流几个小时也不生成硫酸铵。
这一特征引起了人们的注意[1]。
1847年前后,根特(F.A.Genth)进一步研究了三价钴盐与氨生成的几种化合物,并分析了他们的组成。
结果表明:钴盐与氨的化合物不仅因氨分子的数量不同而有不同的颜色,而且钴氨盐中氯的行为也有所不同。
上述复杂的现象,显然不能用简单的原子价规律给予圆满说明,不少人在这方面常识,并未成功。
二、需要冲破旧理论的框子原子价的概念需要扩充,但是当时的一些化学家却抱着僵死的观念不放。
如大化学家开库勒,由于把P原子和N原子视为不变的3价,不惜把PCl5和NH4Cl 视为具有分子式为PCl3·Cl2和NH3·HCl的“分子化合物”但这些原子价都已满足的化合物,却又如何再能作用以形成“分子化合物”呢?开库勒没有办法解释。
另一些人,如霍夫曼(A.W.Hofman)则把氨盐中的N看成5价,把金属氨络合物看作是氨盐取代物。
NH4Cl中的H既可被金属取代,也可以被NH4取代。
但这无法解释AgNO3无法从这些氨盐取代出不同的Cl–的事实。
三、维尔纳的配位理论1893年,维尔纳根据大量实验事实,提出了配位化合物的配位理论。
他认为简单的原子价概念不能说明配位化合物的结构,应引进“副价”概念把原子价概念扩充。
维尔纳用过量AgNO3处理一系列配位化合物,同时称量所得沉淀的重量。
他得出结论,在配位化合物中存在两种原子价:(1)主价或者可电离价;(2)副价或者不可电离价。
维尔纳说,在CoCl3·6NH3中有3个Cl–作用于主价,6个NH3作用于副价,用现代的观点来说,这3个Cl–是可电离的,可被AgNO3沉淀的;6个NH3以配位价键作用于Co3+,形成稳定的络离子,是不可电离的。
也就是说,钴离子可以同时有氧化值(主价)+3和配位数(副价)6。
CoCl3·5NH3的结构和性质可以认为是“从CoCl3·5NH3共失去1分子NH3的同时,1个Cl–从可电离的主价变为不可电离的副价衍生而来的。
所以CoCl3·5NH3中只有两个Cl–是可电离的,其余5个NH3和1个Cl–作用于副价,是不可电离的。
同样,在CoCl3·4NH3中的1个Cl–作用于主价,是可电离的;而同时,两个Cl-和4NH3作用于副价,是不可电离的。
这样,随着Cl–从主价到副价的不同变化而形成不同的化合物。
这些化合物虽然性质有所不同,但其中心离子的配位数(6)和氧化值(+3)都是一样的。
根据维尔纳理论,这些配位原子或基团同中心原子或离子形成了稳定的核或称内界。
若以符号表示,把核的符号写入方括号里边。
这样,可以很方便的写出配位化合物的化学式:[Co(OH3)6]Cl3,[Co(OH3)5]Cl2,[Co(NH3)4]Cl2,[Co(NH3)5·H2O]Cl3,[Pt(NH3)4]Cl2等,其他化学性质可由此电离式表示:[Co(NH3)6]Cl3⇔Co(NH3)63++3Cl–四、维尔纳同袁根生之争丹麦化学家袁根生根据有机化学中碳链结构-CH2-CH2-CH2-提出了配位化合物的氨链结构理论。
根据这一理论,提出了橙色盐CoCl3·6NH3、红紫色盐CoCl3·5NH3、和绿色盐CoCl3·4NH3的不同的结构,他认为直接与钴结合的氯离子不能被AgNO3沉淀是由于结构上的差异造成的,这一定程度上解释了上述实验事实。
这两种针锋相对的理论,谁是谁非,只有通过实验去检验,导电率是试金石。
大家知道,摩尔导电率是与其所电离的阴、阳离子数目成正比的。
维尔纳在1893年到1896年测定了钴系列和铂系列配位化合物的导电率。
从导电率可以看出,[Co(NH3)6]Cl3、[Co(NH3)5NO2]Cl2、[Co(NH3)4(NO2)2]Cl的电离情况与两种学说一致,其余的[Co(NH3)3(NO2)3]、K[Co(NH3)2(NO2)4]、K2[CoNH3(NO2)5]、K3[Co(NO2)6]则有根本区别。
由于氨络合物M(NH3)6中的NH3逐步被阴离子(B)取代,所形成化合物的离子数应该逐渐减少,最后出现一个导电率为零的非电解质;而随着络离子变成阴离子,其导电率应该逐渐增加。
维尔纳在这一领域内的成功是袁根生望尘莫及的。
不幸的是,某些非电解质因水化反应,其导电率不常为零。
[Co(NH3)3Cl3]+H–OH⇔[Co(NH3)3Cl2·H2O]+Cl–袁根生立刻抓住这个把柄加以攻击,企图否定维尔纳学说的成功。
但由于维尔纳对配位化合物阴离子存在的解释,以及从金属氨络合物MA6得到复盐MB6中间存在着一个不断过度的系列,所有维尔纳在这一领域内的胜利,不是袁根生等人能够轻易抹杀的。
五、在几何异构方面的再次较量维尔纳的另一个重要贡献在于提出“复价”都指向围绕中心原子的一个固定空间位置。
根据他的学说:中心原子同一些原子或基团用所谓“复价”相连接。
这些原子或基团称为和中心原子配位,共同组成一个不易电离的核,如[Ag(MH3)2]Cl中的Ag(NH3)2+。
核中每一个原子或基团对应一个配位数,或者说占有一个“配位位置”。
但有些情况如乙二胺(H2N-CH2-CH2-NH2)却占有两个“配位位置”。
少数情况,配位数是8,常见的是4和6,其他数目的很少。
如果知道了配位数,根据对称的原则,可以估计到络离子的可能构型。
对于MA6型的空间对称排布,可能有正八面体,三棱柱和平面六角形三种,如同时测的一致,便可断定其为某种构型。
以取代物MA4B2为例:构型为平面六角形的可能有邻位、间位、对位三种异构体;三棱柱的为三种;正八面体的有两种。
这种异构现象是由于围绕中心原子的配位体在空间的配置不同而引起的,通常叫几何异构。
维尔纳通过估计几何异构体的数目并用实验证实,从而证明自己的配位提理论。
对于MA6型的实验结果如下表:分子式平面六角三棱柱正八面体实验值1 1 1 1 MA6BMA4B2 3 3 2 2 MA3B3 3 3 2 2 从而确定MA6的空间构型为正八面体。
尽管用异构体计数法(isomer counting)决定有机物的立体构型,自1874年以来已成为范霍夫和贝勒尔发展的很充分,但当维尔纳用已解决无机物的立体构型的问题时,却遭到人们的反对,袁根生就是其中之一。
袁根生发现对于分子式M(AA)2B2的钴盐中有绿色和紫色良种异构体,AA为二合配位体如乙二胺,袁根生把这种颜色的差别归结为结构异构,而维尔纳则认为是几何异构,如果承认这种颜色的差别是由于正八面体的几何结果,那么这种异构现象在MA4B2中也应该存在,遗憾的是,对于分子式为[Co(NH3)4Cl2]X的化合物,只知道有绿色盐一种。
袁根生立刻攻击维尔纳的学说是以一个未知物的存在为依据。
维尔纳为了对自己的理论积聚充分的证明,用了20年时间,终于在1907年合成了这高度不稳定的紫色化合物顺式—[Co(NH3)4Cl2]X,他的丹麦对手——袁根生,立刻承认自己失败了。
六、配位化学的发展在维氏时代,由于条件的限制,用于研究化合物配位构型的主要手段是化学分析、分子量的测定、电导、旋光,靠测定化合物异构体数目和性质等。
研究最多的是配位数为4和6 的化合物。
其配合物的配体大多数是无机和饱和的有机分子或离子,能与中心原子之间通过孤对电子生成配位键,比如NH3,H2O,OH–,F–,Cl–,(H2CNH2)2等,随着科学技术的发展,X-射线衍射和各种近代波谱用于结构分析,特别是本世纪五十年代后,高速大型计算机的出现,大多数复杂分子结构和化学键相继清楚。
五十年代初,Dewer和Chat解释了(维尔纳时代就制得的某些)不饱和烯烃作为配体(与金属)的成键性质,指出配体除了提供电子形成σ键外,还能进一步接受中心电子反馈的电子形成π键,紧接着(1951年铁茂[Fe(C5H5)2],1955年二苯合铬[Cr(C6H6)2]的制成)发展了一大类环状和链状不饱和配体化合物,这类配体的不定域共轭电子能和中心金属原子成键形成稳定的配合物。
生物无机化学的发展,进一步涉及到了生命过程中的生物活性物质作为配体,例如蛋白质,聚核苷酸和糖类等,这些配体的构型和曲绕性结构显著地影响着生物的功能,近年来迅速发展的主客体化学和超分子化学,使得含有氧氮的各种大环,某些抗菌素,环糊精等配体也成为大家研究的热点。
维尔纳时代研究的中心原子主要是氧化态已确定的简单金属阳离子,称为阳离子中心模型,中心原子都有接受孤对电子的轨道。
羰基金属化合物的发展,表明中性原子可作为中心原子如(V(CO)6)和阴离子作为中心原子(如[Fe(CO4)]2–);非金属中心原子是大家早就知道的。
主客体化学和超分子化学研究内容的伸展,将原先维尔纳建立的中心原子概念扩展到了无机、有机和生物中的各种阳离子、阴离子、中性分子。
一般认为配合物是由可以给出孤对电子或多个不定域电子的一定数目的离子或分子(称为配体)和具有接受孤对电子或多个不定域电子的空位的原子或离子(统称为中心原子),按一定的组成和空间构型所形成的化合物。