答案:宏观态如:左 0 右 4,左 1 右 3,左 2 右 2,左 3 右 1,左 4 右 0;对应 微观态数目:1、4、6、4、1。不同的宏观态包含着不同数量的微观态, 其中分子分布的最大一种可能情况是左 2 右 2,最小一种可能情况是左 0 右 4 或左 4 右 0。
2.试着从无序的角度谈谈上面问题中为什么“左 2 右 2”这种均匀分 布的可能性最大,能否由此得出热力学第二定律的微观意义?
3.两种表述是等价的 如果克劳修斯表述不成立,则开尔文表述也不成立。
二、对熵和熵增加原理的理解
活动与探究 2 1.如图所示,一个箱子被挡板分为左右两室,左室有 4 个气体分子, 右室为真空,撤去挡板后,气体自由扩散,以箱子内 4 个分子为模型,说明 具有哪些可能的宏观态和微观态,并用热力学第二定律说明,气体扩散 后 4 个分子分布的最大一种可能和最小一种可能的情形。
五、熵
1.熵的定义:熵和系统内能一样都是一个状态函数,仅由系统的状 态决定。玻耳兹曼提出了熵与微观态数目的关系,普朗克把它写成函 数:S=kln Ω,式中 k 叫做玻耳兹曼常数。从分子动理论来看,熵是分子热 运动无序性的量度。
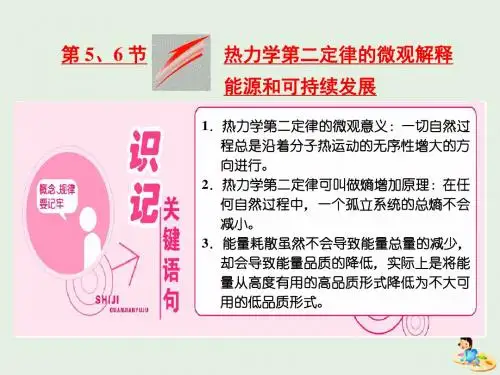
2.熵增加原理:一个系统的熵随着系统状态的变化而变化。在任何 自然过程中,一个孤立系统的熵不会减少。这是用熵表示的热力学第二 定律,为此又把热力学第二定律叫做熵增加原理。
3.开尔文表述:不可能从单一热库吸收热量,使之完全变成功,而不 产生其他影响。
三、有序和无序 宏观态和微观态
1.有序和无序:只要确定了某种规则,符合这个规则的就叫做有序, 不符合某种确定规则的称为无序。
无序意味着各处都一样,平均、没有差别,有序则相反。有序和无序 是相对的。
2.宏观态和微观态:在统计物理学中,符合某种规定、规则的状态, 叫做热力学系统的宏观态。在宏观状态下,符合另外的规定、规则的状 态叫做这个宏观态的微观态。