高一化学乐学学案(下)
- 格式:doc
- 大小:785.50 KB
- 文档页数:45

章末检测(一)(时间:90分钟满分:100分)一、选择题(本题包括15小题,每小题3分,共45分;每小题只有一个选项符合题意)1.某元素的原子最外层只有一个电子,它与卤素结合时,所形成的化学键()A.一定是离子键B.一定是共价键C.可能是离子键也可能是共价键D.以上说法都不正确答案 C解析该元素位于第ⅠA族,可以形成共价化合物如HCl,也可以形成离子化合物如NaCl、KCl 等。
2.对于A Z X和A+1Z X+两种粒子,下列叙述正确的是()A.质子数一定相同,质量数和中子数一定不同B.化学性质几乎相同C.一定都由质子、中子、电子构成D.核电荷数、核外电子数一定相同答案 A解析B项,一种是原子,另一种是离子,它们的化学性质不同;C项,A Z X若代表11H,则不含中子;D项,核电荷数相同,核外电子数不同。
3.有M、R两种主族元素,已知M2-与R+核外电子数之和为20,则下列说法不正确的是()A.M与R的质子数之和一定等于19B.M、R可能分别处于第二周期和第三周期C.M、R可能分别处于第三周期和第二周期D.M和R的质子数之差可能等于7答案 D解析可知M为氧、R为钠或M为硫、R为锂,则A、B、C均正确,D不正确。
4.下列变化不需要破坏化学键的是()A.加热氯化铵B.干冰升华C.水通电分解D.氯化氢溶于水答案 B解析化学变化肯定存在化学键的破坏,A、C两项发生的都是化学变化,加热NH4Cl破坏了NH4Cl内的离子键和共价键;水通电分解破坏了水分子内的共价键;D项,HCl溶于水,破坏了HCl 分子内的共价键;B 项,干冰升华没有化学键的破坏,只是破坏了分子间作用力。
5.下列说法正确的是( )A.235 g 核素235 92U 发生裂变反应:235 92U +10n ――→裂变9038Sr +136 54Xe +1010n,净产生的中子(10n)数为10N A B.3517Cl 与3717Cl 得电子能力相同C.中子数为146、质子数为92 的铀(U)原子:146 92UD.235 92U 和238 92U 是中子数不同、质子数相同的同种核素 答案 B解析 A 项,核素235 92U 发生裂变反应:235 92U +10n ――→裂变9038Sr +136 54Xe +1010n,净产生的中子(10n)数为10-1=9,235 g 核素235 92U 的物质的量为1 mol,则发生裂变时净产生的中子数为9N A ,错误;C项,表示铀原子为238 92U,错误;D 项,235 92U 和238 92U 是不同核素,错误。

第三节化学键第1课时离子键[学习目标定位] 1.通过NaCl的形成过程,理解离子键的形成过程与形成条件。
2.知道离子键、离子化合物的概念。
3.能用电子式表示离子化合物的形成过程。
一、离子键及离子化合物1.离子键的形成过程(以NaCl为例)Na原子和Cl原子最外层电子数分别为1和7,均不稳定。
即它们通过得失电子后达到8电子稳定结构,分别形成Na+和Cl-,两种带相反电荷的离子通过静电作用结合在一起,形成新物质NaCl。
2.离子键(1)离子键的概念是带相反电荷离子之间的相互作用。
构成离子键的粒子是阳离子和阴离子。
(2)离子键的实质是静电作用。
这种静电作用不只是静电引力,而是指阴、阳离子之间的静电引力与电子之间、原子核之间斥力处于平衡时的总效应。
(3)成键条件(4)成键微粒:阴、阳离子。
(5)离子键成键的原因是原子间相互得失电子达到稳定结构;体系的总能量降低。
3.离子化合物(1)离子化合物的概念是由离子键构成的化合物。
(2)请举例说明常见的离子化合物的类型:活泼金属氧化物(如Na2O、MgO等);绝大多数盐(如NaCl、K2SO4、CaCO3等);强碱[如NaOH、Ba(OH)2等]。
离子键的三个“一定”和两个“不一定”(1)三个“一定”①离子化合物中一定含有离子键;②含有离子键的物质一定是离子化合物;③离子化合物中一定含有阴离子和阳离子。
(2)两个“不一定”①离子化合物中不一定含有金属元素,如NH4Cl、NH4NO3等;②含有金属元素的化合物不一定是离子化合物,如AlCl3。
1.下列说法正确的是()A.离子键就是使阴、阳离子结合成化合物的静电引力B.所有金属与所有非金属原子之间都能形成离子键C.在化合物CaCl2中,两个氯离子之间也存在离子键D.含有离子键的化合物一定是离子化合物答案 D解析离子键是使阴、阳离子结合成化合物的静电作用,要注意区别静电作用和静电引力,A项错误;活泼金属与活泼非金属原子之间不一定形成离子键,B项错误;由CaCl2的电子式:可以看出,离子键存在于阴离子和阳离子之间,C项错误;含有离子键的化合物一定是离子化合物,D项正确。

高一化学教学设计高一化学教学设计5篇教学设计是根据课程标准的要求和教学对象的特点,将教学诸要素有序安排,确定合适的教学方案的设想和计划。
下面是小编为大家整理的高一化学教学设计,如果大家喜欢可以分享给身边的朋友。
高一化学教学设计(精选篇1)【教材版本】新课标人教版高中化学必修2第二章化学反应与能量第一节化学能与热能。
【课标分析】知道化学键的断裂和形成是化学反应中能量变化的主要原因,通过生产、生活中的实例了解化学能与热能的相互转化。
【教材分析】本节内容分为三部分。
第一部分教材从化学键入手,说明化学健与能量的密切联系,揭示了化学反应中能量变化的本质原因,然后分析了化学反应过程中反应物和生成物的能量储存与吸、放热的关系,为后面“质量守恒、能量守恒”奠定基础。
第二部分,教材通过三个实验说明化学反应中能量变化主要表现为热量的形式,引出吸热反应,放热反应的术语。
第三部分,教材为了开阔学生的科学视野,图文并茂的说明了生物体内生命活动过程中的`能量变化、能源与人类社会发展的密切关系,使学生在更广阔的背景下认识能源与人类生存和发展的关系,认识化学技术在其中的重大,甚至关键的作用。
通过化学能与热能的学习,学生将对化学在提高能源的利用率和开发新能源中的作用与贡献有初步认识初步树立起科学的能源观;这将增进学生对化学科学的兴趣与情感,体会化学学习的价值。
【学情分析】学习者是高中一年级学生,通过在初中的学习,他们对化学反应伴随能量变化这一现象已经有了感性的认识,建立了初步的概念。
在这堂课中他们要初步明确产生这一现象的本质原因什么,就是要求他们要从感性认识升级为较为理性的认识,这就要求他们要有化学键的概念,而在上一章他们刚刚学习过,所以接受本堂课的内容对他们来说就显得比较轻松。
【教学目标】知识与技能:1、了解化学键与化学反应中的能量变化之间的关系;2、在实验的基础上,通过吸放热反应的概念,理解化学反应中能量变化的主要原因。
过程与方法:具有较强的问题意识,能够发挥和提出有探究价值的化学问题,质疑、思考,逐步形成独立思考的能力,善于与人合作,具有团队精神。

第一节化学能与热能第1课时化学键与化学反应中能量变化的关系[学习目标定位] 1.运用微观的思想,从反应物分子和生成物分子中化学键变化的角度,在本质上认识物质变化与能量变化的关系。
2.知道化学键的断裂和形成是化学反应中能量变化的主要原因,知道化学反应中的能量变化和物质具有的能量之间的关系。
一、断开或形成1 mol某化学键的能量变化1.化学反应的本质是原子(或原子团)的重新组合,即反应物中旧化学键的断裂和生成物中新化学键的形成。
2.物质中的原子之间是通过化学键结合的。
断开反应物中的化学键要吸收能量,形成生成物中的化学键要放出能量。
3.断开或形成1 mol H2中化学键的能量变化(1)在1 mol氢分子中,含有2 mol氢原子,含有1 mol H—H键。
(2)已知在25 ℃和101 kPa的条件下,由2 mol H原子形成1 mol H—H键时,放出436 kJ的能量。
若要使1 mol氢分子变为2 mol氢原子时,需要断开1 mol H—H键,其能量变化是吸收436 kJ的能量。
4.断开或形成1 mol CH4中化学键的能量变化(1)CH4的电子式是,结构式是,1 mol CH4分子中含有4 mol C—H键。
(2)在CH4中,断开1 mol C—H键要吸收415 kJ的能量。
若要形成1 mol CH4中的C—H键,其能量变化是放出4 mol×415 kJ·mol-1=1 660 kJ的能量。
在25 ℃和101 kPa的条件下,由原子形成1 mol化学键时所放出的能量,与断开1 mol相同化学键所吸收的能量是相等的。
1.键能是指在25 ℃、101 kPa的条件下,将1 mol理想气体分子AB拆分为中性气态原子A和B时所需要的能量。
显然键能越大,化学键越牢固,含有该键的分子越稳定。
如H—H键的键能是436 kJ·mol-1,是指使1 mol H2分子变成2 mol H 原子需要吸收436 kJ的能量。
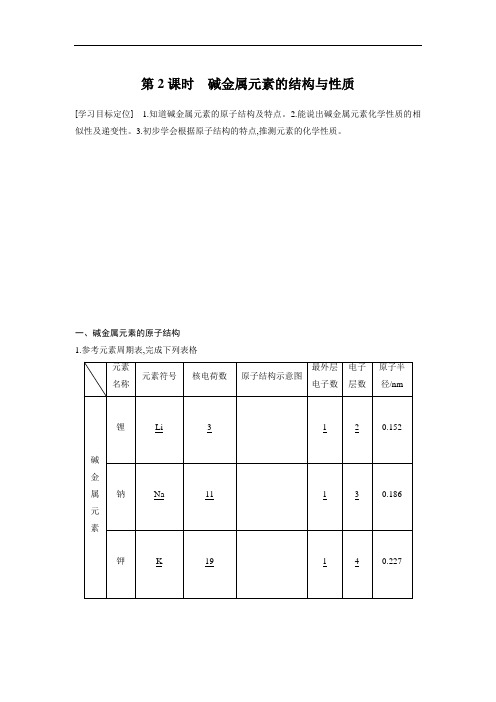
第2课时碱金属元素的结构与性质[学习目标定位] 1.知道碱金属元素的原子结构及特点。
2.能说出碱金属元素化学性质的相似性及递变性。
3.初步学会根据原子结构的特点,推测元素的化学性质。
一、碱金属元素的原子结构1.参考元素周期表,完成下列表格2.通过分析上表可知,碱金属元素原子结构的共同点是最外层电子数均为1,不同点是电子层数和原子半径不同。
碱金属元素的原子结构特点1.下列关于碱金属元素的叙述中正确的是()A.原子的最外层电子数都是1,次外层电子数都是8B.单质的化学性质活泼,易失电子发生还原反应C.除锂外均以化合态存在于自然界中D.化合物中碱金属元素的化合价都为+1价答案 D解析锂原子的次外层电子数为2,且锂在自然界中也不能以游离态存在,A、C项不正确;失去电子发生的是氧化反应,B选项错误。
2.锂(Li)是世界上最轻的金属,它属于碱金属的一种,下列说法正确的是()A.和Li同一主族的都是金属元素B.Na+比Li多一个电子层C.Li、Na、K+的最外层都只有一个电子D.Li是碱金属中原子半径最小的元素答案 D解析锂在第ⅠA族,该族中还有非金属元素氢,A选项错误;Li、Na+的粒子结构示意图分别为、,B选项错误;K+的离子结构示意图为,其最外层有8个电子,C选项错误。
二、碱金属元素的性质1.碱金属的物理性质碱金属单质具有硬度小、密度小、熔点低、沸点低的特点。
在碱金属内,随着元素原子核电荷数的增加,单质的熔点和沸点逐渐降低。
碱金属单质也有延展性,导电性、导热性也很好,液态钠可用作核反应堆的传热介质。
2.碱金属的化学性质 (1)碱金属与O 2反应①已知1.4 g 锂在空气中加热充分反应,可生成3.0 g 氧化物,该反应的化学方程式是 4Li +O 2=====△2Li 2O 。
②钠、钾与氧气的反应:将一小块Na 和K 分别投入热坩埚中,观察现象。
(2)碱金属与水反应按下列实验操作完成实验,并填写下表:1.碱金属单质物理性质变化规律随着原子序数的递增,碱金属单质的密度逐渐增大(钾反常),熔、沸点逐渐降低。

宇华教育集团高一年级化学新授课学案§1.3化学键第1课时离子键学习目标1、理解离子键的形成过程与形成条件;2、掌握离子键、离子化合物的概念;3、能熟练地用电子式表示离子化合物的形成过程。
重点难点理解离子键的形成过程、离子化合物的概念;能用电子式表示离子化合物的形成。
学习过程一、离子键【实验探究】实验:钠在氯气中燃烧(课本21页实验12)现象:。
化学方程式:。
请从电子转移的角度分析产物氯化钠的形成过程。
【思考交流】在氯化钠中Na+和Cl-间存在哪些作用力?1.离子键的定义:带相反电荷离子间的相互作用。
(1)成键微粒:。
(2)相互作用:(包括和)。
(3)成键过程:。
2.形成条件:(1)二元素化合物:和之间形成的化合物。
(2)多元素化合物:含氧酸根与、铵根与、氢氧根与等。
例如:。
二、离子化合物1.定义:由构成的化合物。
2.存在:。
三、电子式1.定义:在元素符号周围用小黑点(或×)表示原子的的式子。
2.写出下列原子的电子式:Na Mg C N O ClAl F Si S3.写出下列离子的电子式:H+Na+Mg2+Cl-S2-Br-H-K+O2-N3-4.写出下列离子化合物的电子式:NaCl Na2S K2O MgCl2MgO K2S CaF25.用电子式表示下列离子化合物的形成过程例:NaCl:K2S:MgBr2:MgO:CaF2:【思考】用电子式表示离子化合物的形成过程应注意的问题?随堂检测1.下列说法正确的是( )A.含有金属元素的化合物一定是离子化合物B.第ⅠA 族和第ⅦA 族原子化合时,一定生成离子键C.由非金属元素形成的化合物一定不是离子化合物D.活泼金属与非金属化合时,能形成离子键2.与Ne 的核外电子排布相同的离子跟与Ar 的核外电子排布相同的离子所形成的化合物是( )A.Na 2Sl 4C.KClD.NaF 3.下列说法中正确的是( )A.离子键就是阴、阳离子间的静电引力B.所有金属元素与所有非金属元素间都能形成离子键C.钠原子与氯原子结合形成离子键D.在离子化合物CaCl 2中,两个氯离子间也存在离子键4.下列各数值表示有关元素的原子序数,能形成AB 2型离子化合物的是( ) A.6与8 B.11与13 C.11与16 D.12与175.下列表示电子式的形成过程正确的是( )6.下列化合物不是离子化合物的是( ) A.H 2O B.CaI 2 C.KOH D.NaNO 37.AB 属于离子型化合物,其中A 离子和B 离子的电子层结构不同,从原子的最外层电子数看A 比B 少4,而次外层电子数A 比B 多6,则该离子化合物是( )A.MgOB.CaOC.KClD.MgS 8.下列电子式是否正确∶∶ [∶∶]+[∶∶]-2Ca 2+[∶-N [∶∶]2-9.用电子式表示氧化钠的形成过程。
第2课时发展中的化学电源[学习目标定位] 1.知道干电池、充电电池、燃料电池等发展中的化学电源的特点。
2.认识提高燃料的燃烧效率、开发高能清洁燃料和研制新型电池的重要性。
3.能正确书写简单化学电源的电极反应式。
一、常见的化学电源1.锌锰干电池(1)结构:锌锰干电池是以锌筒为负极,石墨棒为正极,在石墨棒周围填充糊状的MnO2和NH4Cl 作电解质。
(2)原理:锌锰电池是一次性电池,放电之后不能充电,内部的氧化还原反应是不可逆的。
负极发生的电极反应为Zn-2e-===Zn2+,正极发生的电极反应为2MnO2+2NH+4+2e-===Mn2O3+2NH3↑+H2O。
(3)缺陷:锌锰干电池电量小,而且在放电过程中容易发生气涨或漏液,会导致电器设备的腐蚀。
改进措施:①在外壳套上防腐金属筒或塑料筒制成防漏电池;②将电池内的电解质NH4Cl换成湿的KOH,并在构造上进行改进,制成碱性锌锰电池。
2.充电电池(1)充电电池又称二次电池。
充电电池在放电时所进行的氧化还原反应,在充电时又可以逆向进行,生成物重新转化为反应物,使充电、放电可在一定时期内循环进行。
充电电池中能量的转化电能。
关系是化学能放电充电(2)常见的充电电池①铅蓄电池常作汽车电瓶,电压稳定,使用方便安全。
负极材料是Pb,正极材料是PbO2,电解质溶液是硫酸溶液。
②镍镉电池以Cd为负极,NiO(OH)为正极,以KOH为电解质,寿命比铅蓄电池长,但镉是致癌物质,废弃镍镉电池如不回收,会严重污染环境。
③碱金属中的Li是最轻的金属,活动性极强,是制造电池的理想物质。
锂离子电池是新一代可充电的绿色电池。
3.燃料电池(1)燃料电池是通过燃料气体与氧气分别在两个电极上发生氧化还原反应,将化学能直接转化为电能的装置。
(2)燃料电池与火力发电相比,其燃料的利用率高、能量转化率高。
与干电池或者蓄电池的主要差别在于反应物不是储存在电池内部,而是由外设装备提供燃料和氧化剂等。
前言我们分析每年考上清华北大的北京考生的成绩,发现能够考上清北的学生化学的平均分都在95分以上,先开始我们认为,学习能力强的孩子化学一定学得好。
可是在分析没有考上清北的学生的成绩的时候发现,很多与清北失之交臂的学生,化学的平均分要略低,数学物理的分数却不相上下。
我们仔细讨论其中的缘由,通过对学生的调查研究发现一个令人惊讶的结论:化学学的好的学生更容易在理综上考得高分!这是因为化学学的好的学生,能够用更快的速度在理综考试中解决100分的分值,之后孩子可以用更多的时间去处理没有见过的物理难题。
物理的难题在充分的时间中得到更多考虑的空间,使得考生在理综总分上能够有所突破。
所以想上好大学,化学必须学好,化学的使命就是在高考当中帮助考生提速提分。
因此这份资料提供给大家使用,主要包含有一些课件和习题教案。
后序中有提到一些关于学习的建议。
第一章物质结构元素周期律第三节化学键教学过程【问题】一百多种元素的原子为什么能构成千万种分子?分子中的原子是如何结合的?原子能结合在一起形成分子,说明分子中的原子间一定存在着强烈的相互作用。
1.化学键【教师引导】以水为例(动画演示水的微观运动),水分子之间,相互作用力小。
冰只要吸收较少的能量,就能变成液态或气态。
而水分子中,氢氧原子间的距离小,相互作用力大。
因而要使水分解,就要提供很多能量。
【教师】给出化学键的定义。
“相邻原子间的强烈相互作用就是化学键”化学键可分为离子键、共价键、金属键等。
2.离子键、共价键【问题】在氧化还原反应“钠与氯气”、“氢气与氯气”的反应中,它们电子转移的微观本质有何不同。
【动画演示】NaCl的形成过程。
【教师与学生】在演示中交流NaCl的形成过程,强调得失电子后形成8电子稳定结构。
用电子式表示NaCl的形成过程。
Cl Na Cl+【问题】上式中小黑点的含义?为什么要把氯离子的电子式用括号括起来?【学生】归纳说出离子键的定义。
【动画演示】HCl、H2的形成过程。
高中一年级化学下册教案Unit: Chemical ReactionsLesson: Introduction to Chemical ReactionsObjective: By the end of this lesson, students will be able to:1. Define chemical reactions and identify the different types of reactions.2. Understand the difference between physical and chemical changes.3. Explain the law of conservation of mass in chemical reactions.Materials:- Textbook- Notebook- Pen/Pencil- Whiteboard and markersWarm-up:- Begin the lesson by asking students to brainstorm what they know about chemical reactions.- Discuss their ideas as a class and introduce the concept of chemical reactions. Instruction:1. Define chemical reactions and provide examples of common reactions (e.g. rusting of iron, burning of wood).2. Differentiate between physical changes (changes in shape, size, state) and chemical changes (changes in composition and properties).3. Introduce the different types of chemical reactions (synthesis, decomposition, single replacement, double replacement) and explain how to identify them.Activity:- Divide students into small groups and give each group a set of reaction cards.- Ask students to categorize the reactions on the cards into the different types of chemical reactions.- Have each group share their categorizations with the class and discuss any discrepancies.Assessment:- Have students complete a short quiz on the types of chemical reactions and the law of conservation of mass.- Review the quiz as a class and address any misconceptions.Homework:- Assign students to research and present a real-world example of a chemical reaction. Closure:- Review the key concepts covered in the lesson and clarify any remaining questions from students.- Encourage students to continue exploring chemical reactions in their daily lives. Note: This lesson plan is a basic framework and can be adapted and modified to suit the needs of individual classrooms and students.。
激情教学,快乐学习在新一轮课程改革中如何激励、唤醒、鼓舞学生,使学生乐于学习的观念已深入人心。
化学课如何使学生获得一种愉快的情感体验,达到“乐学、会学”的目的,已成为化学教学研究的重要课题。
我在今年使用江苏版的教材之后遇到了一些问题,也有一些想法,并做了一些反思。
在评价课堂教学时,有时会遇到这样的情形:既找不出执教者知识上的错误,也没发现理解上有什么不妥或表达上有什么明显失误。
但却又说不出有多么好,总觉得像是缺少点儿东西。
缺什么呢?或者有的时候,某教师课讲得头头是道,例题也分析得十分透彻,但教学效果就是不理想。
仔细品味,发现缺少的是激情与快乐——教师的激情和学生的快乐。
对于缺少激情的课堂,学生学习积极性不高,兴趣不浓,精神不饱满,听着不过瘾,看着不解渴,教学效果大打折扣,学生根本感觉不到学习的快乐。
于此,在新一轮课程改革之际,进一步反思如何提高课堂教学效率,就显得很有必要。
无论过去和将来,化学教师都应该提供给学生一个充满激情的化学课堂让学生感受学习的快乐下面就化学课堂教学过程中的情境教学谈几点粗浅的看法:一、重视师生的感情交流,建立民主、平等的新型师生关系当学生上课走神时不要批评,只用暗示,提醒或通过扼要提问使其注意力集中。
遇到学生对问题答不上来或答错时,应耐心启发,诱导并鼓励学生答对为止。
教师要坚持面向全体学生,创设成功的机会,促使学生知难而上,积极进取,在克服困难中体会成功的喜悦,增强学生学习的兴趣。
二、认识新课程是创设新课程课堂教学激情与快乐的基础“注意从学生已有的经验出发,让他们在熟悉的生活情景中学化学”,帮助学生“从科学、技术和社会相互联系的角度认识化学”,“从历史和现实的结合上学习化学”。
《化学课程标准》不仅提出“重视创设生动活泼的学习情景”的教学建议,还在内容标准的每一单元中列出若干可供选择的学习情景素材。
从课堂延伸到课外,每一个单元中列出的情景素材,都有助于教师落实“贴近生活,联系实际”的教学要求。
第五单元评说硫、氮的“功”与过5.1 从黑火药到酸雨一、学习目标1.硫的物理性质和化学性质。
2.硫化氢的毒性、气味、强还原性及水溶液的弱酸性。
3.二氧化硫的物理性质和化学性质。
4.二氧化硫与水反应及亚硫酸的弱酸性。
5.酸雨的成因及其危害与防治。
二、重点和难点硫和二氧化硫的性质。
三、知识探究A 硫思考:黑火药的发明和应用是中国古代四大科技发明之一,把木炭粉、硫磺粉和硝酸钾按一定比例混合,就可以制得黑火药。
试写出反应的方程式并指出该反应中的氧化剂和还原剂。
查阅课本:硫的物理性质有哪些?思考:请同学们从化合价与原子结构两个角度分析单质硫可能有哪些化学性质?化合价角度:原子结构角度:结论:思考:应与具有何种性质的物质反应才能体现单质硫的氧化性呢?实验:取4g铁粉和2.5g硫粉,在纸上充分混合,装入干燥的试管中,加热到混合物开始出现红热,立即移去热源。
观察现象。
现象:思考:如何可以证实铁与硫发生了化学反应?想一想:该反应是吸热还是放热反应,你是如何知道的?写一写:该反应的方程式并标出电子转移的方向和数目。
硫能与大多数金属反应,写出硫粉与铜粉、钠、铝、汞等反应的化学方程式。
思考:硫与金属反应体现硫的什么性质?当硫与变价金属如铁、铜反应时有何特点?思考:汞蒸气对人体有毒,实验室中可以用什么来处理温度计、血压计等破碎后散落的汞珠?拓展:写出氯气与铁反应的化学方程式,并对比硫与铁的反应,说明单质硫与氯气的性质有何不同?硫的氧化性不仅体现在硫与金属的反应上,还体现在与一些具有还原性的非金属反应。
写出硫与氢气反应的方程式。
思考:硫与什么样的物质反应可体现出还原性?硫在空气和纯氧中均可燃烧生成SO2,写出该反应的方程式,并标出电子转移的方向和数目。
小结:单质硫的化学性质阅读课本,归纳硫的用途。
B 硫化氢查阅课本,归纳硫化氢的物理性质。
思考:从H2S中S元素的价态分析,H2S应具有什么性质?资料:在空气中点燃纯的H2S气体,并在火焰上方罩一冷而干燥的洁净小烧杯。
现象:发出淡蓝色火焰,小烧杯内壁有水珠,且出现黄色固体。
请据此写出在氧气不充足的条件下H2S与O2反应的方程式。
思考:若O2充足,燃烧会有何现象?产生什么物质?写出该反应的方程式。
思考:硫化氢是否只有还原性没有氧化性?在较高温度时,硫化氢不稳定,发生分解,写出该反应方程式并标出电子转移的方向和数目。
硫化氢的水溶液称为,是一种酸。
思考:实验室配制的氢硫酸,时间稍久后有浑浊现象,为什么?查找资料:检验硫化氢气体的方法。
小结:硫化氢的化学性质。
C二氧化硫思考:人们用二氧化硫漂白纸张,为什么过了几年就会变黄?酸雨已成为人类的公害,它是怎样形成的?有哪些治理措施?这些问题都与硫的氧化物有关,硫的氧化物主要有哪些?查阅课本:归纳二氧化硫物理性质。
想一想:从物质类别的角度推测SO2是哪种氧化物?这类氧化物,具有哪些通性?写出SO2分别与水、氢氧化钠、氢氧化钙反应的方程式。
SO2的水溶液成为,是一种酸。
思考:将少量二氧化硫通入氯化钙溶液中能否生成白色沉淀?为什么?思考:从SO2中硫的化合价角度分析,推测SO2可能具有的化学性质。
实验:混合一瓶二氧化硫和一瓶硫化氢气体,观察瓶壁上有什么现象发生。
现象:写出该反应的化学方程式,并分析二氧化硫体现了什么性质?思考:SO2分别通入碘水和高锰酸钾溶液中,溶液颜色褪去,以及SO2在催化剂作用下可被空气中的氧气氧化成SO3(写出方程式),体现了SO2的什么性质?实验:在试管中加入0.1%的品红溶液,通入SO2,观察现象。
当试管中液体发生变化时,再给试管加热,观察现象。
现象:结论:思考:SO2、Cl2、活性炭均可使品红溶液褪色,其漂白原理是否相同?思考:氯气和二氧化硫气体作用于湿润的某些有色物质,均可使其褪色,若将等物质的量的两种气体同时通入,会褪色更快吗?想一想:能否用澄清的石灰水鉴别两种无色气体CO2和SO2?若想检验CO2中是否有SO2可以采用什么样的方法?若是SO2中是否有CO2呢?归纳:SO2的化学性质。
D 酸雨想一想:呈酸性的雨水就称酸雨吗?为什么酸雨的pH值定为<5.6?思考:造成大气污染的SO2的主要来源是什么?思考:SO2大量散发到大气中,被雨水吸收就会成为对自然界危害极大的酸雨。
二氧化硫转化成硫酸的途径有哪些?书写相关的化学方程式。
请根据二氧化硫的性质,讨论防止或减少二氧化硫排放的措施。
酸雨的防治:四、知识归纳1.硫的性质①硫既有氧化性又有还原性。
当遇到氧化能力强的物质,硫表现还原性;当遇到还原能力强的物质,硫表现氧化性。
②单质硫是一种弱氧化剂,它与变价金属反应时,一般只能将金属氧化为低价化合物。
2.二氧化硫转化成硫酸的途径:途径1:2SO 2+O22SO3SO3+H2O−→H2SO4途径2:SO 2+H2O H2SO32H2SO3+O2−→2H2SO4大量SO2是通过途径2转化成酸雨的,少量SO2是通过途径1转化成酸雨的,所以途径2为主要形成原因。
酸雨的形成实质上也是不同价态含硫物质在自然界中的转化。
3.酸雨的防治:控制空气中SO2气体的含量,原煤脱硫,使用低硫煤原料,燃烧脱硫或烟气脱硫等。
五、智能训练1.用下列方法测定空气中的污染物含量:将一定体积的空气通入吸收剂,并测定其电导的变化(导体的电阻越小,它的电导越大),如测定H2S的含量,若用CuSO4溶液吸收,可测定很大浓度范围内的H2S,但电导变化不大;若用浓溴水吸收,仅限于低浓度范围内的H2S,但有很高的灵敏度。
现要兼顾吸收容量与灵敏度,测定空气中氯气的含量,则应选用下列吸收剂中的()A.Na2SO3溶液B.KI溶液C.NaOH溶液D.H2O2.银饰物用久后,表面会变成黑色,原因是在硫化氢存在的条件下,银被氧化成硫化银。
有关反应的离子方程式是___________________________________________。
3.汽车尾气(含有烃类、CO、SO2与NO等物质)是城市空气的污染源。
冶理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂)。
它的特点是使CO 与NO反应,生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧及SO2的转化。
(1)写出一氧化碳与一氧化氮反应的化学方程式:(2)“催化转化器”的缺点是在一定程度上提高空气的酸度,其原因是4.在一密闭容器中通入SO2和H2S两种气体共1 mol,充分反应后,若氧化产物的质量比还原产物的质量多8 g,则通入容器中的SO2和H2S的物质的量之比可能是:①或②。
5.根据实验现象写出化学方程式:⑴ HIO3溶液中通入SO2后再滴入淀粉溶液时,立即呈现蓝色(提示:水参加反应):_________________________________________________________________。
⑵玻璃仪器上的硫迹可用热的石灰水洗去,这是由于反应后可生成多硫化钙(CaS x表示)、硫代硫酸钙和水:_________________________________________________________________。
5.2认识物质的量浓度一、学习目标1.物质的量浓度概念及有关物质的量浓度的计算2.学会配制物质的量浓度溶液的方法及容量瓶的使用方法3.理解PH的意义和简单的计算。
二、重点和难点物质的量浓度的概念和计算,配制一定物质的量浓度的溶液。
三、知识探究A、物质的量浓度思考:什么是溶液的浓度?什么是溶液的质量分数(质量百分比浓度)?查阅课本:什么是物质的量浓度?概念:符号:,单位是。
计算公式为:想一想:我们初中已学过溶液的质量分数,为何还要学物质的量浓度?思考:某溶液A中含溶质的物质的量比溶液B中含溶质的物质的量大,则A的浓度比B 大还是小?想一想:(1)将58.5g氯化钠溶于水后配成1L溶液,它的物质的量浓度为多少?(若改成“58.5 g氯化钠溶于1 L水中配成溶液”这句话与上文有何区别?)(2)在1 L 1 mol/L的蔗糖溶液中取出10 mL,则取出的溶液的浓度是多少?有关物质的量浓度的计算:(1)根据概念的换算例1:将23.4g氯化钠溶于水配成200ml溶液,求溶液的浓度?例2:配制500ml 0.1mol/L的NaCl溶液,需NaCl的质量为多少g?(2)有关溶液中物质微粒的计算例3:500ml 0.3mol/L的硫酸钾中,①所含钾离子浓度?②硫酸根离子浓度?③所含阴阳离子微粒总数?结论:溶液中离子的浓度与体积;溶质的物质的量与溶液体积;溶液中微粒的数目=(3)质量百分比浓度与物质的量浓度的换算例4:求36.5%的盐酸(密度为1.2g/ml)的物质的量浓度?结论:(4)化学反应中有关物质的量浓度的换算例4:取200 mL稀硫酸与300 mL 0.1mol/L氢氧化钠溶液混合,使之充分反应,该稀硫酸中溶有9.8g溶质。
求:①它的物质的量浓度?②原烧碱溶液中氢氧化钠的质量为多少克?③反应后生成多少克硫酸钠?④如果要使反应后溶液呈中性,还应加入哪种溶液?再加多少ml?(5)有关溶液稀释的计算思考:在溶液稀释前后,哪些量是不变的?溶液的质量可以相加吗?那溶液的体积可以相加吗?例5:配制100 mL 2 mol/L的盐酸,需2 mol/L HCl的体积为多少毫升?B、溶液酸碱性强弱的测定方法查阅课本:酸雨的pH小于5.6,我们可以用哪些方法测定雨水或溶液的pH?测定溶液pH的方法:思考:如何使用pH试纸和pH计?查阅课本:pH的含义是什么?其数学表达式如何?回忆:纯水电离方程式:思考:什么叫做水的离子积常数?用什么符号表示?在常温下的数值为多少?想一想:根据下列实验数据,你能得出什么结论?常温下溶液中c(H+)与c(OH-)的关系结论:想一想:溶液酸碱性的本质是什么?在室温下,符合什么条件的溶液呈中性?呈酸性?呈碱性?思考:常温下,溶液的酸碱性与溶液pH之间有何关系?结论:H+浓度与pH成关系(填正相或反相)溶液酸性越强,其pH越;溶液碱性越强,其pH越。
(填大或小)有关pH值的简单计算:小结:依据pH数学表达式,如何计算碱性溶液的pH?C、一定物质的量浓度溶液配制的步骤思考:如何配制一定物质的量浓度的溶液?其具体的操作步骤和仪器是什么?如何保证配制结果的准确性?以配制500 mL 1 mol/L的Na2CO3溶液为例来认识一定物质的量浓度溶液的配制。
配制一定浓度的溶液的第一步是需要算出溶质和溶液的量。
此题需要的原料是Na2CO3和水。
请计算出所用Na2CO3的质量。
想一想:什么仪器来称量Na2CO3?思考:所需溶质的质量有了,那么所需溶剂即水的量能否算出?可以用什么方法解决?想一想:能否用量筒等量器来固定溶液的体积呢?观察容量瓶:容量瓶上的刻度线和数字有什么含义?思考:溶解能够在容量瓶中进行吗?想一想:溶解后的Na2CO3溶液放置在哪里?思考:怎样将烧杯中的液体转移到500 mL容量瓶中?思考:此时溶质是否完全被转移到容量瓶中?应如何处理?洗涤之后,应向容量瓶中直接注入蒸馏水,距刻度处停止,改用___________滴加蒸馏水至刻度线。