2016高考复习-电解池 金属的电化学腐蚀与防护资料
- 格式:ppt
- 大小:690.00 KB
- 文档页数:28



【考情解读】1.了解电解池的工作原理,能写出电极反应和电池反应方程式。
2.理解金属发生电化学腐蚀的原因、金属腐蚀的危害、防止金属腐蚀的措施。
【重点知识梳理】 一、电解原理 1.电解在电流作用下,电解质在两个电极上分别发生氧化反应和还原反应的过程。
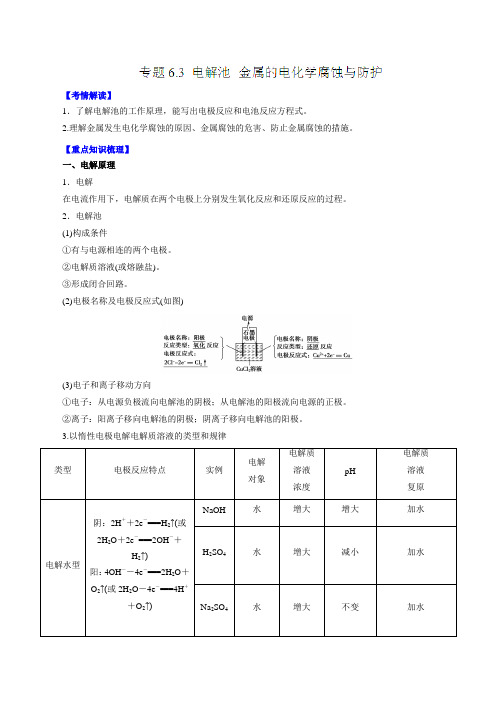
2.电解池 (1)构成条件①有与电源相连的两个电极。
②电解质溶液(或熔融盐)。
③形成闭合回路。
(2)电极名称及电极反应式(如图)(3)电子和离子移动方向①电子:从电源负极流向电解池的阴极;从电解池的阳极流向电源的正极。
②离子:阳离子移向电解池的阴极;阴离子移向电解池的阳极。
3.以惰性电极电解电解质溶液的类型和规律1.氯碱工业(1)概念:用电解饱和NaCl 溶液的方法来制取NaOH 、H 2和Cl 2,并以它们为原料生产一系列化工产品的工业,称为氯碱工业。
(2)原理⎩⎨⎧阳极:2Cl --2e -===Cl 2氧化反应阴极:2H ++2e -===H 2还原反应总反应:2NaCl +2H 2O=====通电2NaOH +H 2↑+Cl 2↑2.电镀与电解精炼铜利用电解熔融盐或氧化物的方法来冶炼活泼金属Na 、Ca 、Mg 、Al 等。
(1)冶炼钠:2NaCl(熔融)=====通电冰晶石2Na +Cl 2↑ 电极反应:阳极:2Cl --2e -===Cl 2↑;阴极:2Na ++2e -===2Na 。
(2)冶炼铝:2Al 2O 3(熔融)=====通电冰晶石4Al +3O 2↑ 电极反应:阳极:6O 2--12e -===3O 2↑;阴极:4Al 3++12e -===4Al 。
(3)冶炼镁:MgCl 2(熔融)=====通电Mg +Cl 2↑ 电极反应:阳极:2Cl -- 2e -===Cl 2↑,阴极:Mg 2++2e -===Mg 。
三、金属的腐蚀与防护 1.金属腐蚀的本质金属原子失去电子变为金属阳离子,金属发生氧化反应。
2.金属腐蚀的类型 (1)化学腐蚀与电化学腐蚀以钢铁的腐蚀为例进行分析:2223323223.金属的防护 (1)电化学防护①牺牲阳极的阴极保护法——原电池原理a.负极:比被保护金属活泼的金属;b.正极:被保护的金属设备。


2Cu+Cl2↑。
=====通电电解池中电子和离子的移动:①电子:从电源负极流出后,流向电解池阴极;从电解池的阳极流向电源的正极。
微提醒:活泼电极是指除金、铂等惰性金属外的其他金属电极。
1.因镍与盐酸反应缓慢,工业上以镍和盐酸为原料,利用离子膜电解技术制取氯化镍),其原理如图。
电解过程露不断往b极区补充盐酸。
下列说法正确的是2NiClA.a接外电源的负极B.离子交换膜为阳离子交换膜C.总反应为:2通电N i+2H C l N i C l+HD.电解过程可用溶液代替盐酸NaCl【答案】CA .a 处的试纸变红B .b 电极是正极C .a 处发生的电极反应:D .b 处发生的电极反应:2Fe 2e e=F -+-22Cl 2e Cl =---↑【答案】D【解析】由图可知,b 处与电源正极相连,b 为阳极,a 与电源负极相连,可知铁棒为阴极,电解饱和食盐水,阴极生成氢气,阳极生成氯气,以此来解答。
A .实验相当于电解饱和氯化钠溶液,a 作为阴极,氢离子放电后浓度降低,使氢氧根浓度增大,碱性增强,故使pH 试纸变蓝,故A 错误;B .b 处与电源正极相连,b 为阳极,故B 错误;C .a 与电源负极相连,可知铁棒为阴极,电解饱和食盐水,阴极生成氢气,发生的电极反应: ,故C 错误;222H O 2e =H 2OH --+↑+D .b 处与电源正极相连,b 为阳极,氯离子放电生成氯气,发生的电极反应:,故D 正确;22Cl 2e Cl =---↑故答案选:D 。
4.电解处理垃圾渗液是一项重要的环保课题,研究小组用图装置进行渗液(pH=6.5-8)处理,可以实现其中的和有机物COD 的转化,下列说法错误的是3NHA .a 为电源负极Al 3+、Mg 2+、Na +、Ca 2+、K +只有在熔融状态下才放电。
(6)阴极不管是什么材料,电极本身都不反应,一定是溶液(或熔融电解质)中的阳离子放电。
(7)最常用、最重要的放电顺序是阳极:Cl ->OH -;阴极:Ag +>Cu 2+>H +。