物质的分类及胶体
- 格式:doc
- 大小:723.00 KB
- 文档页数:7




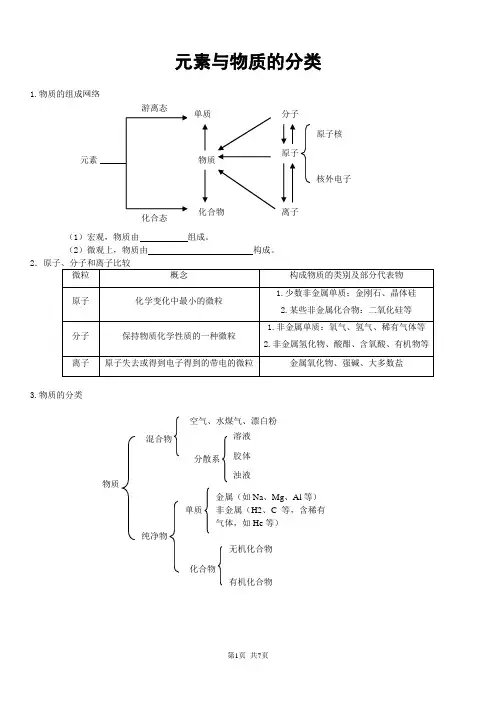
元素与物质的分类1.(1)宏观,物质由 组成。
(2)微观上,物质由 构成。
2.原子、分子和离子比较概念构成物质的类别及部分代表物化学变化中最小的微粒1.少数非金属单质:金刚石、晶体硅2.某些非金属化合物:二氧化硅等保持物质化学性质的一种微粒 1.非金属单质:氧气、氢气、稀有气体等2.非金属氢化物、酸酣、含氧酸、有机物等原子失去或得到电子得到的带电的微粒金属氧化物、强碱、大多数盐3.物质的分类溶液 胶体 浊液物质混合物纯净物空气、水煤气、漂白粉分散系单质金属(如Na 、Mg 、Al 等)非金属(H2、C 等,含稀有气体,如He 等)化合物无机化合物有机化合物4.分散系及胶体(1)分散系:化学上指由一种(或几种)物质分散到另一种物质里所形成的混合物。
依据分散质的离子大小不同,分散系可分为溶液、胶体、浊液。
(2)胶体定义:分散质的粒子直径介于1~100nm 之间的分散系。
(3)胶体性质:①丁达尔现象:可以区别溶液与胶体② 电泳:电泳现象证明胶粒带有电荷,因此电泳可以用来提纯胶体,如冶金厂的大量烟尘可以用高压电除去。
③聚沉:一定条件下,是胶体粒子凝固而产生沉淀 ④布朗运动:它并非胶粒专属,水中的花粉也有次现象。
(4)三种分散系的对比无氧酸:HCl 、H 2S 等含氧酸:HClO 4、H 2SO 4等无机化合物氢化物:HCl 、H 2S 、H 2O 等氧化物不成盐氧化物:CO 、CaO 等成盐氧化碱性氧化物:Na 2O 、CaO 等酸性氧化物:CO 2、P 2O 5等 两性氧化物:Al 2O 3等过氧化物:Na 2O 2、H 2O 2等酸按电离出的H +数一元酸:HCl 、HNO 3等 二元酸:H 2SO 4、H 2S 等 三元酸:H 3PO 4等 按酸根是否含氧按酸性强弱强酸:HCl 、H 2SO 4、HNO 3等 弱酸:CH 3COOH 、HF 等 按有无挥发性挥发性酸:HCl 、HNO 3等难挥发性酸:H 2SO 4、H 3PO 4等碱按水溶性可溶性碱:NaOH 、KOH 、Ba(OH)2等 难溶性碱:Mg(OH)2、Ca(OH)2等 按碱性强弱强碱:NaOH 、KOH 、Ba(OH)2等 弱碱:NH 3·H 2O 等盐正盐:BaSO 4、KNO 3、NaCl 等酸式盐:NaHCO 3、KHCO 3等 碱式盐:Cu(OH)2CO 3等 复盐:KAl(SO 4)2·12H 2O 等(5)胶体的制备如将饱和的FeCl 3溶液滴入沸腾的蒸馏水中,并继续煮沸至生成红褐色液体即得Fe(OH)3胶体,方程式: FeCl 3+3H 2O====Fe(OH)3胶体+3HCl 。


专题01 物质的聚集状态及物质分类、胶体考点1 物质的聚集状态1.常见的物质有三种聚集状态,固态、液态、气态。
不同聚集状态的特性主要由构成物质的微粒之间的平均距离_和作用力及运动方式有关。
2.物质的聚集状态变化:改变微粒间距离的远近与微粒间作用力的强弱,能改变物质的聚集聚集状态 宏观性质(共性)微观性质(共性)是否有固定的形状是否可以被压缩微粒间距离的远近微粒间作用力的强弱气态 无 可以 远 弱 液态 有 否 较近 较弱 固态 有否镜强(熔化) (凝固)(汽化 ) (液化 )(升华 ) (凝华)固态 液态 气态状态,即改变温度和压强等条件。
升高温度,微粒间距离变大,微粒间作用力变大。
增大压强,微粒间距离变小,微粒间作用力变大。
【典例1】下列关于物质聚集状态的说法错误的是()A.物质只有气、液、固三种聚集状态B.气态是高度无序的体系存在状态C.固态中的原子或者分子间结合较紧凑,相对运动较弱D.液态物质的微粒间距离和作用力的强弱介于固、气两态之间,表现出明显的流动性【答案】A【解析】物质除了气、液、固三种聚集状态之外,还存在等离子态及其他状态。
【典例2】下列关于物质聚集状态的说法正确的是()A.气体有固定的形状和体积B.固体、液体不易被压缩的原因是构成的微粒直径太大C.影响物质聚集状态的外界因素主要是温度D.不同聚集状态的物质其内部微粒之间的平均距离、作用力和运动方式各不相同【答案】D【解析】A中气体并没有固定的形状以及体积;B中固体、液体不易被压缩的原因是构成微粒之间距离较近,微粒间存在较大的斥力;C中影响物质聚集状态的外界因素主要温度和压强;【典例3】下列对生活中常见现象的正确解释是()A.汽化:舞台上常用干冰制作“云雾”效果B.液化:从冰箱里取出的鸡蛋过一会儿会“出汗”C.升华:冰雪消融D.凝固:冬日温暖的车内窗玻璃会变模糊【答案】B【解析】A干冰起雾是升华:C中冰雪消融是熔化;D中温暖的车窗变得模糊是窗外的水汽遇到温暖的车窗气体变化为液体。



专题1 物质的分类 胶体【名师预测】本专题内容为高考的高频考点,卷均分为3~4分;物质的分类主要是判断各选项的正误,考查角度是对概念的辨析;单质、氧化物、酸、碱、盐之间的转化会结合与社会热点相关的物质、材料、工业流程等进行考查;分散系的相关知识主要侧重胶体性质与应用的考查。
物质的分类、物质的性质与变化常与其他知识综合考查,一般以选择题形式出现;而分散系的知识考查频率不高,难度不大,一般出现在选择题的个别选项中。
【知识精讲】一、物质的组成与分类 1.原子、分子、离子概念比较 (1)原子、分子、离子的概念原子是化学变化中的最小微粒。
分子是保持物质化学性质的最小微粒,一般分子由原子通过共价键构成,但稀有气体是单原子分子。
离子是带电荷的原子或原子团。
(2)原子是怎样构成物质的?2.元素与物质的关系 (1)元素具有相同核电荷数的一类原子的总称。
在自然界的存在形式有游离态和化合态。
①游离态:元素以单质形式存在的状态。
②化合态:元素以化合物形式存在的状态。
(2)元素组成物质元素――→组成⎩⎪⎨⎪⎧单质:同种元素组成的纯净物化合物:不同种元素组成的纯净物(3)纯净物与混合物①纯净物:由同种单质或化合物组成的物质。
②混合物:由几种不同的单质或化合物组成的物质。
③纯净物和混合物的区别3.同素异形体(1)概念:同种元素形成的不同单质叫同素异形体。
(2)形成方式①原子个数不同,如O2和O3;②原子排列方式不同,如金刚石和石墨。
(3)性质差异物理性质差别较大,同素异形体之间的转化属于化学变化。
4.简单分类法——交叉分类法和树状分类法(1)交叉分类法的应用示例(2)明确分类标准是对物质正确树状分类的关键二、物质的性质与变化1.物理变化和化学变化的判断方法根据上述判断方法,回答下列问题:①石油的分馏②煤的干馏③钠的焰色反应④碘的升华⑤氯化铵分解⑥蛋白质的变性⑦蛋白质的颜色反应⑧电解食盐水⑨CaCl2的潮解⑩冰的熔化⑪FeCl3的水解⑫石油的裂化、裂解⑬蛋白质的盐析⑭食物的缓慢氧化⑮同素异形体间的转化其中属于物理变化的是;属于化学变化的是。
第二讲物质分类及胶体一.物质的分类1.分类原则:①每次分类必须按同一标准分类。
例如对物质分类可以按组成元素,性质,构成,分散系中分散质微粒大小等②分类的子项应不能相容③各子项之和必须等于母项。
2. 分类方法:常用交叉分类法和树状分类法(1)交叉分类法:按照不同的标准对同种物质进行多种分类的方法。
(2)树状分类法:对同类事物按照某种属性进行再分类的方法。
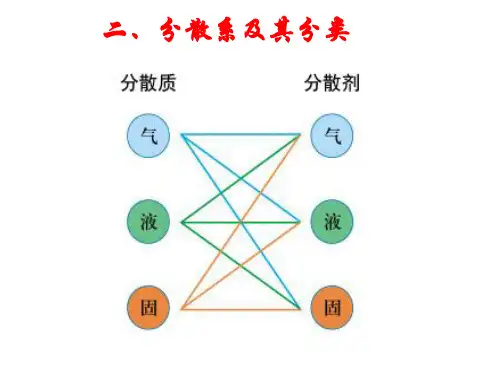
金属:Na、Mg、Al单质非金属:S、O2、N2 、P、C酸性氧化物:SO3、SO2、P2O5等氧化物碱性氧化物:Na2O、CaO、Fe2O3等金属氧化物:Al2O3等纯非金属氧化物:CO、NO等净含氧酸:HNO3、H2SO4等物按酸根分无氧酸:HCl、H2S 、HF强酸:HNO3、H2SO4、HCl酸按强弱分弱酸:H2CO3、HClO、CH3COOH化一元酸:HCl、HNO3合按电离出的H+数分二元酸:H2SO4、H2SO3物多元酸:H3PO4强碱:NaOH、Ba(OH)2 物按强弱分质弱碱:NH3·H2O、Fe(OH)3碱一元碱:NaOH按电离出的OH- 数分二元碱:Ba(OH)2多元碱:Fe(OH)3正盐:Na2CO3盐酸式盐:NaHCO3 、NaHSO4 、Na H2PO4碱式盐:Cu2(OH)2CO3溶液:NaCl溶液、稀H2SO4等混胶体:Fe (OH)3胶体、淀粉溶液、烟、雾、云、有色玻璃等合浊液悬:泥水混合物等物浊液乳浊液:油水混合物二、分散系相关概念1. 分散系:一种物质(或几种物质)以粒子形式分散到另一种物质里所形成的混合物,统称为分散系。
(按分散质和分散剂的状态可分为九种分散系)2. 分散质:分散系中分散成粒子的物质。
分散剂:分散质分散在其中的物质。
(分散质和分散剂是总的概念,只有溶液中才可称为溶质和溶剂)3、分散系的分类:当分散剂是水或其他液体时,如果按照分散质粒子的大小来分类,可以把分散系分为:溶液、胶体和浊液。
高中化学物质的分类与胶体性质必考知识点总结(一)元素与物质的关系1. 元素是物质的基本组成成分,物质都是由元素组成的。
2. 每种元素在一定的条件下均可自身组成单质也可与其它元素形成化合物。
3. 元素在物质中以两种形态存在:一种是游离态,另一种是化合态。
(二)物质的分类1. 常见的物质分类方法(1)交叉分类法:由于一种分类方法所依据的标准有较大的局限性,所能提供的信息也比较少,故人们在认识事物时,往往采用不同的分类方法,通过从不同的角度对物质进行分类,来弥补单一分类方法的不足。
交叉分类法即是对同一事物从多个角度分类的一种方法。
示例如下图:(2)树状分类法:对同类事物还可以再分类,进行层层深入。
由粗及细的分类。
示例见下图:2. 物质的基本分类方法(1)根据物质的成分分类:混合物。
纯净物(2)根据元素组成的种类分:单质化合物,而单质又可分为金属单质。
非金属单质;化合物可分为无机物和有机物。
无机物可分为氧化物、酸、碱、盐等;有机物可分为烃。
烃的衍生物。
(3)根据官能团进行分类:有机物可分为脂肪烃、芳香烃、烷、烯、炔;卤代烃、醇、醛、酮、羧酸等。
根据研究要求不同可采用不同的方法进行分类。
3. 分散系及其分类(1)分散系的概念及其分类法分散系:一种(或多种)物质分散到另一种(或多种)物质里所得到的体系。
分散系的组成:分散质------被分散成粒子的物质分散剂------粒子分散在其中的物质(2)分散系的分类与比较分散系的比较(三):胶体的性质1. 丁达尔现象:可见光束通过胶体时,在入射光侧面可观察到明亮的光束。
注意:①丁达尔效应是物理变化②丁达尔效应可用来鉴别胶体和溶液③液溶胶和气溶胶、固溶胶均能发生丁达尔效应④丁达尔效应能说明胶粒的大小范围⑤丁达尔现象是胶粒对光的散射作用而形成的。
2. 电泳:胶粒细小而具有较大的表面积,能选择性的吸附胶体中的某种离子而带有一定电荷。
一般金属氧化物、氢氧化物胶体的微粒带正电荷,非金属氧化物胶体、金属硫化物胶体、硅酸胶体、土壤胶体的微粒带负电荷。
物质的分类一、简单分类法及其应用1.交叉分类法Na2CO3钠盐Na2SO4钾盐K 2SO4硫酸盐K 2CO3碳酸盐2、树状分类法二、分散系( dispersion system)及其分类1、分散系(1) 分散系:将一种或几种物质以粒子形式分散到另一种物质里所形成的混合物,称为分散系。
(2) 分散质和分散剂:分散系中分散成粒子的物质叫做分散质,另一种物质叫做分散剂。
(3)分类:常见的分散系有溶液、悬浊液、乳浊液、胶体等。
一般地说,溶液分散质粒子小于1nm,浊液中离子通常大于100nm,介于1nm~100nm的为胶体。
常见的分散系及其特征分散质分散剂实例气气空气液气云、雾固气烟灰尘气液泡沫液液牛奶、酒精的水溶液固液糖水、油漆气固泡沫塑料液固珍珠(包藏着水的碳酸钙)固固有色玻璃、合金分散系溶液胶体粗分散系粒子大小<1 nm 1-100nm >100nm例子盐水硫酸铜溶液淀粉溶胶氢氧化铁胶体泥水油水能否透过半透膜能不能不能能否透过滤纸能能不能丁达尔效应没有没有有三、胶体( colloid )1、胶体的分类2、胶体的制备:FeCl3+3H2O Fe(OH)3(胶体) +3HCl四、胶体的性质1.丁达尔效应:光束通过胶体,形成光亮的“通路”的现象叫丁达尔效应。
2.布朗运动:胶体分散质粒子作不停的、无秩序的运动,这种现象叫做布朗运动。
3.电泳:在外加电场作用下,胶体粒子在分散剂里向电极作定向移动的现象4.胶体的聚沉:分散质粒子相互聚集而下沉的现象,称为胶体的聚沉。
方法:加电解质溶液;加带相反电荷的胶粒。
5、胶体的应用(1)工业除杂、除尘(2).土壤的保肥作用(5)豆腐的制作原理(4)江河入海口处形成三角洲(3)明矾的净水作用一、胶体的分类(1)、根据分散质微粒组成的状况分类:如:F e(O H)3胶体胶粒是由许多F e(O H)3等小分子聚集一起形成的微粒,其直径在1nm~100nm之间,这样的胶体叫粒子胶体。