物质的分类及胶体.ppt
- 格式:ppt
- 大小:286.50 KB
- 文档页数:12



第4讲物质的分类考点一物质的组成、性质及分类.理解混合物和纯净物、单质和化合物、.理解酸、碱、盐、氧化物的概念及其相.了解胶体是一种常见的分散系,了解溶1.2.胶体:概念、组成、性质及应用1.元素、微粒及物质间关系图2.同素异形体3. 元素在物质中的存在形态游离态:元素以单质形式存在的状态。
化合态:元素以化合物形式存在的状态。
4. 混合物和纯净物①纯净物:由同种单质或化合物组成的物质。
②混合物:由几种不同的单质或化合物组成的物质。
有下列物质:①氧气②二氧化碳③臭氧(O3) ④盐酸⑤铁⑥碳酸钠⑦空气⑧氢氧化钠⑨冰、水混合物其中由分子直接构成的纯净物有:①②③⑨;由原子直接构成的纯净物有:⑤;由离子直接构成的纯净物有:⑥⑧;互为同素异形体的是:①和③;属于单质的有:①③⑤;属于化合物的有:②⑥⑧⑨;属于混合物的有:④⑦。
提醒:由同种元素组成的物质不一定是纯净物,如O2和O3。
3.物质的分类(1)树状分类法——按不同层次对物质逐级分类无机化合物⎩⎪⎪⎪⎪⎪⎪⎪⎪⎨⎪⎪⎪⎪⎪⎪⎪⎪⎧氢化物:HCl 、H 2S 、H 2O 、NH 3等氧化物⎩⎪⎨⎪⎧不成盐氧化物:CO 、NO 等成盐氧化物⎩⎨⎧碱性氧化物:Na 2O 、CaO 等酸性氧化物:CO 2、P 2O 5等两性氧化物:Al 2O 3等过氧化物:Na 2O 2、H 2O 2等酸⎩⎪⎪⎪⎨⎪⎪⎪⎧按电离出的H +数⎩⎨⎧一元酸:HCl 、HNO 3等二元酸:H 2SO 4、H 2S 等三元酸:H 3PO 4等按酸根是否含氧⎩⎨⎧无氧酸:HCl 、H 2S 等含氧酸:HClO 4、H 2SO 4等按酸性强弱⎩⎨⎧强酸:HCl 、H 2SO 4、HNO 3等弱酸:CH 3COOH 、HF 等按有无挥发性⎩⎨⎧挥发性酸:HNO 3、HCl 等难挥发性酸:H 2SO 4、H 3PO 4等碱⎩⎨⎧按水溶性⎩⎨⎧可溶性碱:NaOH 、KOH 、Ba (OH )2等难溶性碱:Mg (OH )2、Cu (OH )2等按碱性强弱⎩⎨⎧强碱:NaOH 、Ba (OH )2、KOH 等弱碱:NH 3·H 2O 等盐⎩⎨⎧正盐:BaSO 4、KNO 3、NaCl 等酸式盐:NaHCO 3、KHSO 4等碱式盐:Cu 2(OH )2CO 3等复盐:KAl (SO 4)2·12H 2O 等提醒:(1)同一种物质,按不同的角度进行分类,可得到不同的分类结果,如Na 2CO 3属于钠盐、碳酸盐、含氧酸盐、正盐等。
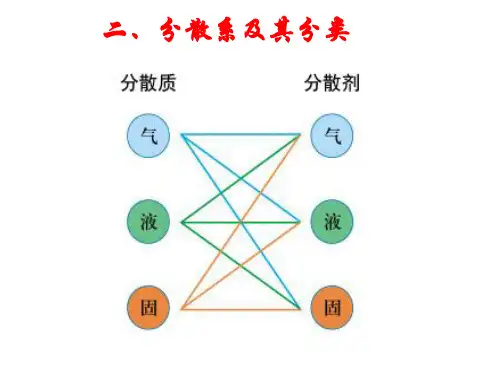

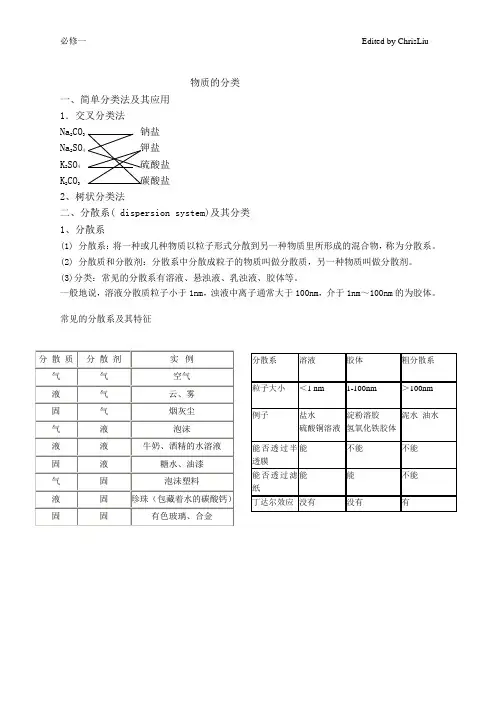
物质的分类一、简单分类法及其应用1.交叉分类法Na2CO3钠盐Na2SO4钾盐K 2SO4硫酸盐K 2CO3碳酸盐2、树状分类法二、分散系( dispersion system)及其分类1、分散系(1) 分散系:将一种或几种物质以粒子形式分散到另一种物质里所形成的混合物,称为分散系。
(2) 分散质和分散剂:分散系中分散成粒子的物质叫做分散质,另一种物质叫做分散剂。
(3)分类:常见的分散系有溶液、悬浊液、乳浊液、胶体等。
一般地说,溶液分散质粒子小于1nm,浊液中离子通常大于100nm,介于1nm~100nm的为胶体。
常见的分散系及其特征分散质分散剂实例气气空气液气云、雾固气烟灰尘气液泡沫液液牛奶、酒精的水溶液固液糖水、油漆气固泡沫塑料液固珍珠(包藏着水的碳酸钙)固固有色玻璃、合金分散系溶液胶体粗分散系粒子大小<1 nm 1-100nm >100nm例子盐水硫酸铜溶液淀粉溶胶氢氧化铁胶体泥水油水能否透过半透膜能不能不能能否透过滤纸能能不能丁达尔效应没有没有有三、胶体( colloid )1、胶体的分类2、胶体的制备:FeCl3+3H2O Fe(OH)3(胶体) +3HCl四、胶体的性质1.丁达尔效应:光束通过胶体,形成光亮的“通路”的现象叫丁达尔效应。
2.布朗运动:胶体分散质粒子作不停的、无秩序的运动,这种现象叫做布朗运动。
3.电泳:在外加电场作用下,胶体粒子在分散剂里向电极作定向移动的现象4.胶体的聚沉:分散质粒子相互聚集而下沉的现象,称为胶体的聚沉。
方法:加电解质溶液;加带相反电荷的胶粒。
5、胶体的应用(1)工业除杂、除尘(2).土壤的保肥作用(5)豆腐的制作原理(4)江河入海口处形成三角洲(3)明矾的净水作用一、胶体的分类(1)、根据分散质微粒组成的状况分类:如:F e(O H)3胶体胶粒是由许多F e(O H)3等小分子聚集一起形成的微粒,其直径在1nm~100nm之间,这样的胶体叫粒子胶体。
