溶液的酸碱性要点(1)
- 格式:doc
- 大小:39.00 KB
- 文档页数:2


溶液的酸碱性溶液的酸碱性是指溶液中的氢离子(H+)和羟离子(OH-)的相对浓度。
酸性溶液中,氢离子的浓度高于羟离子的浓度;碱性溶液中,羟离子的浓度高于氢离子的浓度;中性溶液中,氢离子和羟离子的浓度相等。
溶液的酸碱性对生物体的生理功能、工业生产和环境保护等领域都有着重要影响。
酸碱性的度量常利用pH值来表示。
pH的定义是pH=-log[H+],其中[H+]为溶液中氢离子的浓度。
pH值在0~14之间,数值越小表示酸性越强,0为最酸;数值越大表示碱性越强,14为最碱性。
中性溶液的pH值为7。
pH值的改变可能会造成化学反应、腐蚀、酶活性的改变等。
溶液酸碱性的调节与酸碱反应有关。
酸碱反应是发生在酸和碱之间的反应,其中酸和碱相互中和生成盐和水。
常见的酸碱反应有酸与碱反应、酸与金属反应、碱与金属反应等。
这些反应会导致令人感觉到的酸味、碱味和气味。
许多生物体利用酸碱反应进行生命活动。
比如,我们的胃酸能够帮助消化食物,维持胃内的酸性环境,抑制有害细菌的生长。
酸碱解离平衡是溶液酸碱性的重要因素。
酸和碱在水溶液中会发生解离,生成氢离子和羟离子。
酸的解离产生氢离子,而碱的解离产生羟离子。
强酸和弱酸的解离程度不同,会影响到溶液的酸碱性。
溶液中出现氢离子浓度的变化,会进一步影响pH值。
溶液酸碱性对生物体的影响很大。
细胞内的酸碱平衡对维持细胞的正常功能至关重要。
细胞内外的pH差异能够影响酶的活性,进而影响细胞的代谢功能。
酸碱平衡失调会导致酸中毒或碱中毒,严重时会危及生命。
在工业生产中,酸碱性也起到重要的作用。
许多化学反应需要在特定的酸碱条件下进行。
工业废水的酸碱性对环境保护也非常重要。
酸性废水对水体的生态环境会产生严重破坏,而碱性废水可能会引起水体的浑浊和大规模无菌。
为了调节溶液的酸碱性,人们常常采取一些方法。
最常用的方法是加入酸或碱物质来调节pH值。
例如,当溶液变得过酸性时,可以加入一些碱物质如氢氧化钠来中和溶液,提高pH值。

溶液的酸碱性与pH值溶液的酸碱性是指溶液中酸碱物质所占比例的多少,而pH值是衡量溶液酸碱性的指标。
在化学实验、生物学研究和日常生活中,了解溶液的酸碱性以及pH值的变化对我们有着重要意义。
1. pH值的定义和计算pH值是一种用于表示溶液酸碱程度的无量纲指标,其定义为负对数下10的氢离子(H+)浓度的活度。
pH值的计算公式为:pH = -log[H+]。
在纯水中,H+离子的浓度极小,约为10-7摩尔每升,因此pH值为7。
当溶液的pH小于7时,表示溶液为酸性溶液;当pH大于7时,表示溶液为碱性溶液。
2. 酸性溶液与碱性溶液酸性溶液指的是含有较多H+离子的溶液。
酸性溶液中的氢离子会与水分子中的氧离子(OH-)结合,生成水分子(H2O)。
典型的酸性溶液有盐酸溶液和硫酸溶液。
碱性溶液则是指含有较多OH-离子的溶液。
碱性溶液中的氢离子会与氢氧根离子结合,生成水分子。
典型的碱性溶液有氢氧化钠溶液和氢氧化钙溶液。
3. pH值的影响因素溶液的酸碱性和pH值受多种因素的影响。
(1) 酸碱物质的浓度:溶液中酸碱物质的浓度越高,其酸碱性也越强,因此pH值会相应下降或上升。
(2) 酸碱物质的强度:强酸和强碱的溶液具有较高或较低的pH值,而弱酸和弱碱的溶液则具有较接近中性的pH值。
(3) 温度:溶液的温度升高或降低都会对其pH值产生影响。
温度升高会导致少数酸性物质解离产生更多的H+离子,从而降低pH值;而温度降低则会减少H+离子的生成,使pH值升高。
4. 测定溶液的pH值测定溶液的pH值是一个常见的实验操作。
常用的测定方法包括:(1) 酸碱指示剂:酸碱指示剂可以根据其与溶液的颜色变化来判断溶液的酸碱性。
例如,酸性溶液中溴酚蓝指示剂呈黄色,而碱性溶液中呈蓝色。
(2) pH试纸:pH试纸是另一种常用的溶液酸碱性测定方法,它可以根据试纸颜色的变化来判断溶液的pH值范围。
(3) pH计:pH计是一种准确测定溶液pH值的仪器。
它使用玻璃电极来测量溶液中的氢离子浓度,并将其转换为pH值。

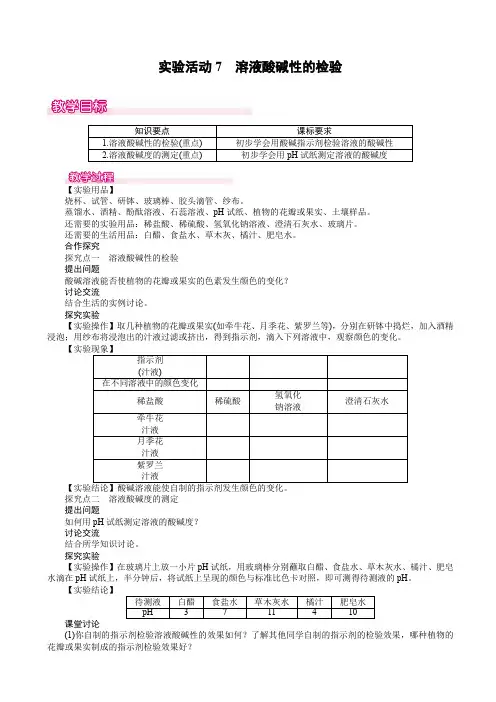
实验活动7溶液酸碱性的检验
【实验用品】
烧杯、试管、研钵、玻璃棒、胶头滴管、纱布。
蒸馏水、酒精、酚酞溶液、石蕊溶液、pH试纸、植物的花瓣或果实、土壤样品。
还需要的实验用品:稀盐酸、稀硫酸、氢氧化钠溶液、澄清石灰水、玻璃片。
还需要的生活用品:白醋、食盐水、草木灰、橘汁、肥皂水。
合作探究
探究点一溶液酸碱性的检验
提出问题
酸碱溶液能否使植物的花瓣或果实的色素发生颜色的变化?
讨论交流
结合生活的实例讨论。
探究实验
【实验操作】取几种植物的花瓣或果实(如牵牛花、月季花、紫罗兰等),分别在研钵中捣烂,加入酒精浸泡;用纱布将浸泡出的汁液过滤或挤出,得到指示剂,滴入下列溶液中,观察颜色的变化。
探究点二溶液酸碱度的测定
提出问题
如何用pH试纸测定溶液的酸碱度?
讨论交流
结合所学知识讨论。
探究实验
【实验操作】在玻璃片上放一小片pH试纸,用玻璃棒分别蘸取白醋、食盐水、草木灰水、橘汁、肥皂水滴在pH试纸上,半分钟后,将试纸上呈现的颜色与标准比色卡对照,即可测得待测液的pH。
【实验结论】
课堂讨论
(1)你自制的指示剂检验溶液酸碱性的效果如何?了解其他同学自制的指示剂的检验效果,哪种植物的花瓣或果实制成的指示剂检验效果好?
(紫罗兰或者牵牛花制成的指示剂效果好。
)
(2)归纳自制的指示剂在酸、碱溶液中的颜色变化情况,与同学交流。
(根据实验结果讨论,例如紫罗兰溶液在酸性溶液中变红。
)
板书设计
实验活动7溶液酸碱性的检验1.溶液酸碱性的检验
2.溶液酸碱度的测定
测定溶液酸碱度通常用pH试纸。
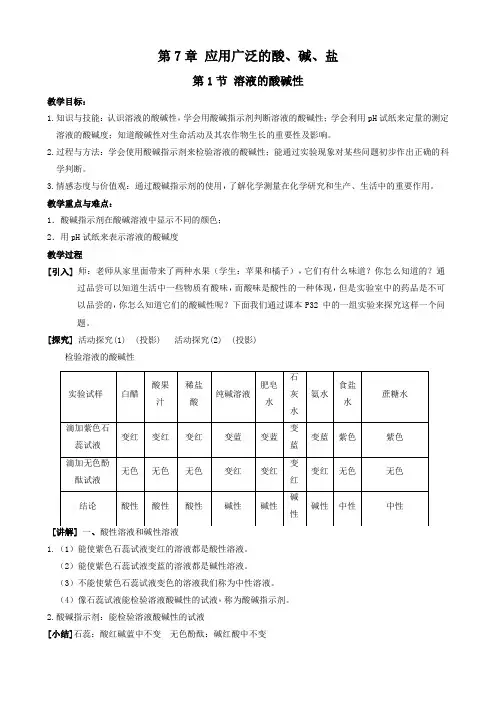

溶液的酸碱性和酸碱度(讲义)一、知识点睛1.溶液的酸碱性溶液的酸碱性是指溶液显________、________或________,可以利用酸碱指示剂进行检验。
指示剂在溶液中显示的颜色:溶液酸碱性酸性碱性中性指示剂紫色石蕊溶液无色酚酞溶液注:显酸性的溶液不一定是酸的溶液,如NH4NO3溶液;显碱性的溶液不一定是碱的溶液,如Na2CO3溶液。
2.溶液的酸碱度溶液的酸碱度是指溶液的酸碱性______________。
(1)表示方法常用_____来表示,范围通常为________。
(2)pH与溶液酸碱性的关系①中性溶液pH_____;②酸性溶液pH_____(pH越___,酸性越强);③碱性溶液pH_____(pH越___,碱性越强)。
(3)pH的测定方法①测定溶液pH最简便的方法是使用___________。
②具体操作a.在_______________上放一小片pH试纸;b.用__________蘸取溶液滴到__________上;c.把试纸显示的颜色与______________比较,读出该溶液的______。
③使用pH试纸的注意事项a.不能事先用水将pH试纸润湿,否则测定的是稀释后溶液的pH;b.不能把pH试纸浸入待测液中,以免引入杂质,污染待测液;c.用pH试纸测得的数值是整数。
(4)溶液稀释后pH的变化①酸溶液加水稀释(如图1)酸性减弱,pH增大,无限接近7。
②碱溶液加水稀释(如图2)碱性减弱,pH减小,无限接近7。
③中性溶液加水稀释pH不变,始终等于7。
(5)酸碱中和反应过程中pH的变化①向碱中滴加酸(如图1)滴加前,溶液呈碱性,pH___7;滴加过程中,pH逐渐减小;当pH___7时,酸和碱恰好完全反应;继续滴加酸,溶液呈酸性,pH___7。
②向酸中滴加碱(如图2)滴加前,溶液呈酸性,pH___7;滴加过程中,pH逐渐增大;当pH___7时,酸和碱恰好完全反应;继续滴加碱,溶液呈碱性,pH___7。

A、汽水B、自来水C、肥皂水D、食醋4、苯甲酸()可用做食品防腐剂,其酸性比醋酸强。
下列对苯甲酸性质的推测不合理的是()A.苯甲酸溶液的pH小于7B.苯甲酸溶液的pH大于 7C.苯甲酸溶液能使紫色石蕊试液变红色D.苯甲酸溶液不能使无色酚酞试液变色5、例1 一些食物的pH如下,其中碱性最强的是()A.苹果 2.9~3.3 B.牛奶 6.3~6.6C.鸡蛋清 7.6~8.0 D.番茄 4.0~4.46、不用其他试剂,可以鉴别石蕊、盐酸、氢氧化钙、氢氧化钠、碳酸钠五种溶液,第二个被鉴别出来的物质是()A.盐酸B.氢氧化钙C.氢氧化钠D.碳酸钠7、一些食物的近似PH如下表:食物苹果葡萄牛奶玉米粥pH 2.9~3.3 3.5~4.5 6.3~6.6 7.2~8.0人的胃液中含有盐酸,对于胃酸过多的人,空腹时最适宜使用上述食物中的A.苹果 B.葡萄 C.牛奶 D.玉米粥8、下列反应,要借助酸碱指示剂才能判断二者是否发生反应的是A.大理石和稀盐酸 B.石灰水和稀盐酸C.铁锈和稀硫酸D.镁和稀硫酸9、下图是一些物质的pH,酸碱性最接近中性的是A.苹果汁(2.9~3.3)B.番茄汁(4.04~4.4)C.玉米粥(6.88~7.1)D.肥皂水(9.8~10.2)10、下列物质中.pH最小的是;A.食盐水 B.纯净水C.食醋 D.石灰水11、下列数据是常见物质的pH范围,其中酸性最强的是A.瓶装饮用水 (6.5~7.5) B.番茄汁(4.0~4.4)C.柠檬汁(2.0~3.0) D.液体肥皂(9.5~10.5)12、用一种试剂一次就能将澄清石灰水、氢氧化钠溶液、稀盐酸三种无色溶液区分开来的是A.紫色石蕊试液 B.稀硫酸C.氢氧化钡溶液 D.碳酸钠溶液二、多项选择13、一些国家正在试用碳酸水浇灌某些植物,其作用是()A.调节土壤的pH,改良酸性土壤B.调节土壤的pH,改良碱性土壤C.促进植物的光合作用D.在植物上方形成温室三、简答题1.2003年6月某校环保小组监测到一个造纸厂仍在向淮河排放无色碱性污水。



一、溶液酸碱性的判断(一)、从题给的数据判断溶液的酸碱性1.从溶液中c(H+)和c(OH-)的大小关系比较来判断溶液的酸碱性当c(H+)>c(OH-)时,其水溶液呈酸性;当c(H+)=c(OH-)时,其水溶液呈中性;当c(H+)<c(OH-)时,其水溶液呈碱性。
2.从溶液中c(H+)的范围判断溶液的酸碱性没有明确指出溶液所处温度时,通常就认为是25℃,此时如果溶液中c(H+)>10-7mol/L表明溶液呈酸性;此时如果溶液中c(H+)=10-7mol/L表明溶液呈中性;此时溶液中c(H+)<10-7mol/L表明溶液呈碱性。
3.从溶液中c(OH-)的范围判断溶液的酸碱性没有明确指出溶液所处温度时,通常就认为是25℃,此时如果溶液中c(OH-)>10-7mol/L表明溶液呈碱性;此时如果溶液中c(OH-)=10-7mol/L表明溶液呈中性;此时溶液中c(OH-)<10-7mol/L表明溶液呈酸性。
4.从溶液的pH范围来判断溶液的酸碱性没有明确指出溶液所处温度时,通常就认为是25℃,此时如果溶液的pH>7表明溶液呈碱性;此时如果溶液的pH=7表明溶液呈中性;此时溶液的pH<7表明溶液呈酸性。
如果题中明确指出溶液所处温度是100℃,此时水的离子积常数为1*10-12,中性溶液的pH=6,此时如果溶液的pH>6表明溶液呈碱性;此时如果溶液的pH=6表明溶液呈中性;此时溶液的pH<6表明溶液呈酸性。
5.从正盐溶液中的阴阳离子浓度的倍数关系判断溶液酸碱性组成为M a Y b(该盐的电离方程式为M a Y b=a M b+ + bY a- )的盐溶液,当阴阳离子浓度的倍数关系为: b * c(M b+)= a *c(Y a-) ,溶液呈中性;当阴阳离子浓度的倍数关系为: b * c(M b+)> a *c(Y a-) ,溶液呈碱性;当阴阳离子浓度的倍数关系为: b * c(M b+)< a *c(Y a-) ,溶液呈酸性。
煌敦市安放阳光实验学校高二化学三第二单元溶液的酸碱性 4【本讲信息】一、教学内容专题三第二单元溶液的酸碱性二、考点清单1. 溶液酸碱性的本质2. 判断溶液酸碱性的方法3. 溶液的pH概念及计算公式4. pH计算方法5. 酸碱滴概念,原理6. 酸碱滴步骤7. 酸碱滴误差分析三、全面突破Ⅰ、溶液的酸碱性1. 溶液的酸碱性的实质任何水溶液中都存在水的电离,因此都含有H+和OH-. 一种溶液是显酸性、中性还是碱性,是由该溶液中的c(H+)与c(OH-)的相对大小来决的.酸性溶液:c(H+)>c(OH-)酸性越强,c(H+)越大,c(OH-)越小。
中性溶液:c(H+)=c(OH-)碱性溶液:c(H+)<c(OH-)碱性越强,c(OH-)越大,c(H+)越小。
2. 溶液的酸碱性与c(H+)、c(OH-)(1)25℃时,K W=1×10-14中性溶液:c(H+)=c(OH-)=1×10-7mol·L-1酸性溶液:c(H+)>1×10-7mol·L-1,c(OH-)<1×10-7mol·L-1碱性溶液:c(H+)<1×10-7mol·L-1,c(OH-)>1×10-7mol·L-1(2)100℃时,K W=1×10-12中性溶液:c(H+)=c(OH-)=1×10-6mol·L-1酸性溶液:c(H+)>1×10-6mol·L-1,c(OH-)<1×10-6mol·L-1碱性溶液:c(H+)<1×10-6mol·L-1,c(OH-)>1×10-6mol·L-13. 溶液的pH(1)溶液的pH的概念:在c(H+)≤1mol·L-1的水溶液中,采用c(H+)的负对数来表示溶液酸碱性的强弱.(2)数学表达式:pH=-1g[c(H+)]若c(H+)=10-n mol·L-1,则pH=n.若c(H+)=m×10-n mol·L-1,则pH=n-lgm.(3)溶液酸碱性的强弱与pH的关系.①常温25℃时:pH =7,溶液呈中性,c(H+)=c(OH-)=1×10-7mol·L-1.pH <7,溶液呈酸性,pH(H+强(弱).pH >7,溶液呈碱性,pH(OH-强(弱).②pH范围为0~14之间. pH=0的溶液中并非无H+,而是c(H+)=1mol·L -1;pH=14的溶液中并非没有OH-,而是c(OH-)=1 mol·L-1. pH减小(增大)n倍,则c(H+)增大为原来的10n倍(减小为原来的1/10n倍),相的c (OH-)减小为原来的1/10n倍(增大为原来的10n倍).③当溶液中的c(H+)>1mol·L-1时,pH<0;c(OH-)>1mol·L-1时,pH>14. 因此,当溶液中的c(H+)或c(OH-)大于1mol·L-1时,一般不用pH来表示溶液的酸碱性,而是直接用c(H+)或c(OH-)来表示. 所以,pH只适用于c(H+)或c(OH-)≤1mol·L-1的稀溶液.4. 溶液中pH的计算(1)基本关系式:①pH=-1g[c(H+)]②c(H+)=10-n mol·L-1③任何水溶液中,由水电离产生的c(H+)与c(OH-)总是相的,即:c水(H+)=c水(OH-).④常温25℃时,c(H+)·c(OH-)=1×10-14(2)强酸与弱酸、强碱与弱碱溶液加水稀释后pH的计算.①强酸与弱酸分别加水稀释相同倍数时,由于弱酸来未电离的弱酸分子进一步电离出离子,故弱酸的pH变化小. 设稀释10n倍,则:强酸:pH稀= pH原 + n弱酸:pH稀< pH原 + n当加水稀释至由溶质酸电离产生的c酸(H+)<10-6mol·L-1时,则必须考虑水的电离.如pH=5的盐酸稀释1000倍时,pH稀=6.98,而不是于8.②强碱与弱碱分别加水稀释相同倍数时,弱碱的pH变化小. 设均稀释10n 倍,则:强碱:pH稀= pH原- n弱碱:pH稀> pH原- n当加水稀释至由溶质碱电离产生的c(OH-)<10-6 mol · L-1时,则必须考虑水的电离. 如pH=9的NaOH溶液稀释1000倍时,pH稀≈7,而不是于6.(3)两强酸或两强碱溶液混合后pH的计算.①两强酸溶液混合. 先求出:212211VVV)H(cV)H(c)H(c++=+++混再求:pH混=-1g[c混(H+)]②两强碱溶液混合. 求算两强碱溶液混合后溶液的pH时,不能直接根据题中给出的碱的pH求算混合液的pH,而必须先分别求出两强碱溶液中的c(OH-),再依下式求算c混(OH-):212211VVVOHcVOHcOHc++=---)()()(混,然后求出c混(H+)、pH混.(4)强酸与强碱溶液混合后pH的计算.解题步骤:分别求出酸中的n(H+)、碱中的n(OH-)→依H++ OH-=H2O比较出n(H+)与n(OH-)的大小.①n(H+)=n(OH-)时,恰好,混合液显中性;pH=7. [若混合液的pH =7,则必有n(H+)=n(OH-)]②n(H+)>n(OH-)时,酸过量,则:碱酸余碱酸混VV)H(nVV)OH(n)H(n)H(c+=+-=+-++。
水的电离和溶液的酸碱性(1)一、水的电离1.水的电离水的电离方程式为25 ℃时,纯水中c(H+)=c(OH-)=任何水溶液中,由水电离出来的c(H+)与c(OH-)都2.水的离子积常数(1)水的离子积常数:K w=,100 ℃时,K w=1×10-12。
(2)影响因素:只与有关,升高温度,K w。
(3)适用范围:K w不仅适用于纯水,也适用于的稀溶液。
(4)K w揭示了在任何水溶液中均存在H+和OH-,只要不变,K w不变。
3.影响水电离平衡的因素(一)外界条件对水的电离平衡的影响1.水的离子积常数K w=c(H+)·c(OH-),其实质是水溶液中的H+和OH-浓度的乘积,不一定是水电离出的H+和OH-浓度的乘积,所以与其说K w是水的离子积常数,不如说是水溶液中的H+和OH-的离子积常数。
即K w不仅适用于水,还适用于酸性或碱性的稀溶液。
2.水的离子积常数显示了在任何水溶液中均存在水的电离平衡,都有H+和OH-共存,只是相对含量不同而已。
2A.向水中加入Na2SO4溶液 B.向水中加入Al2(SO4)3固体C.向水中加入NaHCO3溶液 D.向水中加入NaHSO4溶液2.一定温度下,水溶液中H+和OH-的浓度变化曲线如图所示,下列说法正确的是( ) A.升高温度,可能引起由c向b的变化B.该温度下,水的离子积常数为1.0×10-13C.该温度下,加入FeCl3可能引起由b向a的变化D.该温度下,稀释溶液可能引起由c向d的变化3.如图表示不同温度下的水中c(H+)和c(OH-)的关系,下列判断错误的是( )A.两条曲线间任意点均有c(H+)·c(OH-)=K wB.M区域内任意点均有c(H+)<c(OH-)C.图中T1<T2D.XZ线上任意点均有pH=7(二)水电离出的c(H+)或c(OH-)的计算理清溶液中H+或OH-的来源1.中性溶液中:H+或OH-均全部来自水的电离。
一、酸性溶液和碱性溶液
(1)凡是能使紫色石蕊试液变红的溶液都是酸性溶液,并且该溶液不能使无色酚酞试液变色;
(2)凡是能使紫色石蕊试液变蓝的溶液都是碱性溶液,并且该溶液能使无色酚酞试液变红;
(3)不能使紫色石蕊试液变色,也不能使无色酚酞试液变色的溶液,我们称为中性溶液。
(4)如紫色石蕊试液及无色酚酞等能检验溶液酸碱性的试液,称为酸碱指示剂注意:我们有时候还用蓝色或红色石蕊试纸来检验溶液的酸碱性酸性溶液能使蓝色石蕊试纸变红;碱性溶液能使红色石蕊试纸变蓝。
2.区分酸溶液和酸性溶液、碱溶液和碱性溶液
注意:酸溶液是指酸的水溶液,酸性溶液是指能使紫色石蕊试液变红的溶液,因此酸溶液一定是酸性溶液,而酸性溶液不一定是酸溶液;同样,碱性溶液不一定是碱溶液,碱溶液一定是碱性溶液。
二、溶液的酸碱性的强弱
1.酸碱度:用来表示溶液的酸性或碱性的强弱程度。
2.pH试纸用来定量的测定溶液的酸碱度。
pH值1 2 3 4 5 6 7 8 9 10 11 12 13 14
|
酸性增强中性碱性增强
溶液的pH值与酸碱性关系
pH=7,溶液呈中性;pH<7,溶液呈酸性,pH越小,酸性越强;pH>7,溶液呈碱性,pH越大,碱性越强
3.pH试纸的使用方法;
用胶头滴管(或玻璃棒)把待测试液滴(或涂)在pH试纸上,然后把试纸显示的颜色(半分钟内)与标准比色卡对照,标准比色卡上相同颜色的pH即为该溶液的pH。
注意:
(1)不能直接把pH试纸浸入待测溶液中,以免带入杂质,同时这种操作可能泡掉pH试纸上一部分指示剂,以致比色发生较大的误差;
(2)不能先用水将pH试纸润湿,再进行测试,因为水润湿后的pH试纸将测定的是稀释后溶液的pH。
(3)我们实验室一样使用的pH试纸是广泛pH试纸,测出的pH值是1-14的整数
(4)为了比较精确的测定溶液的pH,我们可以用精密pH试纸和酸度计(pH 计)来测量。
三、溶液酸碱性与生命活动的关系
1.人的体液有一定的酸碱度。
血液、组织间液和细胞内液的酸碱度都接近于中性,而且变化极小;
(胃液的pH在0.9~1.5之间,在这样的环境中铁屑都可被溶解,但胃本身却能安然无恙。
因为胃里有一层“粘液屏障”,它是由粘液细胞和上皮细胞分泌出的一种胶冻状粘液,在胃粘膜表面构成一个保护膜,用来保护胃,防止胃酸对其本身的腐蚀及胃蛋白酶对胃本身的消化,还能防止粗糙的食物对胃的机械性损伤。
)3.大多数的农作物适宜在接近中性(pH在6.5~7.5之间)的土壤中生长
在改良酸性土壤时,我们一般是使用熟石灰来调节其酸碱度。
4.雨水一般呈略酸性(由于空气中的二氧化碳溶解在雨水中),人们一般把pH 小于5.6 的雨水称为酸雨。