体外诊断试剂分析性能评估-线性范围
- 格式:pptx
- 大小:75.51 KB
- 文档页数:13



附件:《体外诊断试剂分析性能评估系列指导原则(征求意见稿)》目录1.体外诊断试剂分析性能评估指导原则――编制说明2.体外诊断试剂分析性能评估指导原则——检测限3.体外诊断试剂分析性能评估指导原则——线性范围4.体外诊断试剂分析性能评估指导原则——可报告范围5.体外诊断试剂分析性能评估指导原则——准确度(回收实验)6.体外诊断试剂分析性能评估指导原则——准确度(方法学比对)7.体外诊断试剂分析性能评估指导原则——精密度8.体外诊断试剂分析性能评估指导原则——干扰实验9.体外诊断试剂分析性能评估指导原则——稳定性10.体外诊断试剂分析性能评估指导原则——参考值(参考区间)附件1:体外诊断试剂分析性能评估指导原则编制说明《体外诊断试剂注册管理办法(试行)》颁布后,体外诊断试剂产品的注册过程中要求提供申报产品的分析性能评估资料,产品性能评估是产品研发、制定产品标准等过程的重要技术支持研究过程,并可能对产品的质量造成一定的影响。
目前国际上对体外诊断试剂的性能评估通常是以美国临床实验室标准化组织(Clinical and Laboratory Standards Institude以下称为CLSI)的相关标准为依据,也是美国FDA推荐采用的评价标准,但我国还没有相关的标准及指导原则的要求。
为进一步明确体外诊断试剂分析性能评估的技术要求,我中心组织有关专家起草产品分析性能评估指导原则,以明确体外诊断试剂产品性能评估的技术要求。
体外诊断试剂产品性能评估包括检测限、线性范围、可报告范围、准确度(回收实验)、准确度(方法学比较)、精密度、干扰实验、稳定性、参考区间共九个项目。
起草的主要依据CLSI发布的以下标准:1. C28-A2: How to define and determine reference intervals in the clinical laboratory; ApprovedGuideline-Second Edition.2. EP5-A: Evaluation of precision performance of clinical chemistry devices; Approved Guideline.3. EP6-A: Evaluation of the linearity of quantitative measurement procedures; A Statistical Approach; Approved Guideline.4. EP7-A: Interference testing in clinical chemistry; Approved Guideline.5. EP9-A2: Method comparison and bias estimation using patient samples; Approved Guideline-Second Edition.每项性能的主要研究方法均采用以上标准和国内实际采用的评价方法相结合的方法。

附件:《体外诊断试剂分析性能评估系列指导原则(征求意见稿)》目录1.体外诊断试剂分析性能评估指导原则――编制说明2.体外诊断试剂分析性能评估指导原则——检测限3.体外诊断试剂分析性能评估指导原则——线性范围4.体外诊断试剂分析性能评估指导原则——可报告范围5.体外诊断试剂分析性能评估指导原则——准确度(回收实验)6.体外诊断试剂分析性能评估指导原则——准确度(方法学比对)7.体外诊断试剂分析性能评估指导原则——精密度8.体外诊断试剂分析性能评估指导原则——干扰实验9.体外诊断试剂分析性能评估指导原则——稳定性10.体外诊断试剂分析性能评估指导原则——参考值(参考区间)附件1:体外诊断试剂分析性能评估指导原则编制说明《体外诊断试剂注册管理办法(试行)》颁布后,体外诊断试剂产品的注册过程中要求提供申报产品的分析性能评估资料,产品性能评估是产品研发、制定产品标准等过程的重要技术支持研究过程,并可能对产品的质量造成一定的影响。
目前国际上对体外诊断试剂的性能评估通常是以美国临床实验室标准化组织(Clinical and Laboratory Standards Institude以下称为CLSI)的相关标准为依据,也是美国FDA推荐采用的评价标准,但我国还没有相关的标准及指导原则的要求。
为进一步明确体外诊断试剂分析性能评估的技术要求,我中心组织有关专家起草产品分析性能评估指导原则,以明确体外诊断试剂产品性能评估的技术要求。
体外诊断试剂产品性能评估包括检测限、线性范围、可报告范围、准确度(回收实验)、准确度(方法学比较)、精密度、干扰实验、稳定性、参考区间共九个项目。
起草的主要依据CLSI发布的以下标准:1. C28-A2: How to define and determine reference intervals in the clinical laboratory; Approved Guideline-Second Edition.2. EP5-A: Evaluation of precision performance of clinical chemistry devices; Approved Guideline.3. EP6-A: Evaluation of the linearity of quantitativemeasurement procedures; A Statistical Approach; Approved Guideline.4. EP7-A: Interference testing in clinical chemistry; Approved Guideline.5. EP9-A2: Method comparison and bias estimation using patient samples; Approved Guideline-Second Edition. 每项性能的主要研究方法均采用以上标准和国内实际采用的评价方法相结合的方法。


(整理)体外诊断试剂分析性能评估系列指导原则.附件:《体外诊断试剂分析性能评估系列指导原则(征求意见稿)》目录1.体外诊断试剂分析性能评估指导原则――编制说明2.体外诊断试剂分析性能评估指导原则——检测限3.体外诊断试剂分析性能评估指导原则——线性范围4.体外诊断试剂分析性能评估指导原则——可报告范围5.体外诊断试剂分析性能评估指导原则——准确度(回收实验)6.体外诊断试剂分析性能评估指导原则——准确度(方法学比对)7.体外诊断试剂分析性能评估指导原则——精密度8.体外诊断试剂分析性能评估指导原则——干扰实验9.体外诊断试剂分析性能评估指导原则——稳定性10.体外诊断试剂分析性能评估指导原则——参考值(参考区间)附件1:体外诊断试剂分析性能评估指导原则编制说明《体外诊断试剂注册管理办法(试行)》颁布后,体外诊断试剂产品的注册过程中要求提供申报产品的分析性能评估资料,产品性能评估是产品研发、制定产品标准等过程的重要技术支持研究过程,并可能对产品的质量造成一定的影响。
目前国际上对体外诊断试剂的性能评估通常是以美国临床实验室标准化组织(Clinical and Laboratory Standards Institude以下称为CLSI)的相关标准为依据,也是美国FDA 推荐采用的评价标准,但我国还没有相关的标准及指导原则的要求。
为进一步明确体外诊断试剂分析性能评估的技术要求,我中心组织有关专家起草产品分析性能评估指导原则,以明确体外诊断试剂产品性能评估的技术要求。
体外诊断试剂产品性能评估包括检测限、线性范围、可报告范围、准确度(回收实验)、准确度(方法学比较)、精密度、干扰实验、稳定性、参考区间共九个项目。
起草的主要依据CLSI发布的以下标准:1. C28-A2: How to define and determine reference intervals in the clinical laboratory; Approved Guideline-Second Edition.2. EP5-A: Evaluation of precision performance of clinical chemistry devices; Approved Guideline.3. EP6-A: Evaluation of the linearity of quantitative measurement procedures; A Statistical Approach; Approved Guideline.4. EP7-A: Interference testing in clinical chemistry; Approved Guideline.5. EP9-A2: Method comparison and bias estimation using patient samples; Approved Guideline-Second Edition.每项性能的主要研究方法均采用以上标准和国内实际采用的评价方法相结合的方法。

附件5:体外诊断试剂分析性能评估(准确度-方法学比对)技术审查指导原则一、前言准确度评估资料是评价拟上市产品有效性的重要依据,也是产品注册所需的重要申报资料之一。
定量检测方法的方法学比对试验是评估准确度的方法之一,可以与参考方法或临床公认质量较好的已上市产品进行比对。
本指导原则基于国家食品药品监督管理局《体外诊断试剂注册管理方法(试行)》的有关要求,参考CLSI有关标准,对采用方法学比对进行准确度评估的实验方法和数据处理方法进行了原则性要求。
其目的是为生产企业采用方法学比对进行准确度评估并准备准确度评估资料提供原则性指导,也为注册管理部门审核该部分分析性能评估资料提供技术参考。
由于体外诊断试剂产品发展速度快、专业跨度大,国家食品药品监督管理局将根据体外诊断试剂发展的需要,适时对本指导原则进行修订。
二、适用围本指导原则适用于首次申请注册、申请许可事项变更的用于定量检测的体外诊断产品。
因体外诊断产品评价是将仪器、试剂、质控品、校准品等作为一个系统进行评价,因此方法学比对的评价采用系统的概念进行描述。
如特殊产品不适用于本指导原则,可进行详细说明并采用适当的方法进行准确度评价。
三、基本要求(一)方法学比对实验的基本要求1.操作者应熟悉待评价系统和比对系统的操作。
2.编写系统标准操作规程,其中包括校准程序和室质控程序,采用适宜的校准品、质控品并保持仪器处于正常状态。
3.比对系统的选择比对系统应具有以下条件:(1)具有比待评价系统更好的精密度;(2)同待评价系统检测结果具有相同的单位;(3)如有参考方法应具有与参考方法已知的偏差。
比对系统应该选择正确性经过验证的系统,根据实际条件,选择的顺序如下:参考方法、原装系统、配套系统、经过验证的非配套系统。
4.待评价系统的处理进行方法学对比实验前,应该对待评价系统进行初步评价,并且对待评价系统进行精密度与线性的评价(参考相关标准),只有在以上评价完成并且符合相关标准要求后,才可进行方法学对比实验。

附件:《体外诊断试剂分析性能评估系列指导原则(征求意见稿)》目录1. 体外诊断试剂分析性能评估指导原则——编制说明2. 体外诊断试剂分析性能评估指导原则——检测限3. 体外诊断试剂分析性能评估指导原则——线性范围4. 体外诊断试剂分析性能评估指导原则一一可报告范围5. 体外诊断试剂分析性能评估指导原则——准确度(回收实验)6. 体外诊断试剂分析性能评估指导原则——准确度(方法学比对)7. 体外诊断试剂分析性能评估指导原则---- 精密度8. 体外诊断试剂分析性能评估指导原则——干扰实验9. 体外诊断试剂分析性能评估指导原则——稳定性10. 体外诊断试剂分析性能评估指导原则——参考值(参考区间)附件1 :体外诊断试剂分析性能评估指导原则编制说明《体外诊断试剂注册管理办法(试行)》颁布后,体外诊断试剂产品的注册过程中要求提供申报产品的分析性能评估资料,产品性能评估是产品研发、制定产品标准等过程的重要技术支持研究过程,并可能对产品的质量造成一定的影响。
目前国际上对体外诊断试剂的性能评估通常是以美国临床实验室标准化组织(Clinical and Laboratory Standards Institude 以下称为CLSI)的相关标准为依据,也是美国FDA推荐采用的评价标准,但我国还没有相关的标准及指导原则的要求。
为进一步明确体外诊断试剂分析性能评估的技术要求,我中心组织有关专家起草产品分析性能评估指导原则,以明确体外诊断试剂产品性能评估的技术要求。
体外诊断试剂产品性能评估包括检测限、线性范围、可报告范围、准确度(回收实验)、准确度(方法学比较)、精密度、干扰实验、稳定性、参考区间共九个项目。
起草的主要依据CLSI发布的以下标准:1. C28-A2: How to define and determine reference intervals in the clinical laboratory; Approved Guideline-Second Edition.2. EP5-A: Evaluation of precision performance of clinicalchemistry devices; Approved Guideline.3. EP6-A: Evaluation of the linearity of quantitative measurement procedures; A Statistical Approach; Approved Guideline.4. EP7-A: Interference testing in clinical chemistry; Approved Guideline.5. EP9-A2: Method comparison and bias estimation using patient samples; Approved Guideline-Second Edition.每项性能的主要研究方法均采用以上标准和国内实际采用的评价方法相结合的方法。
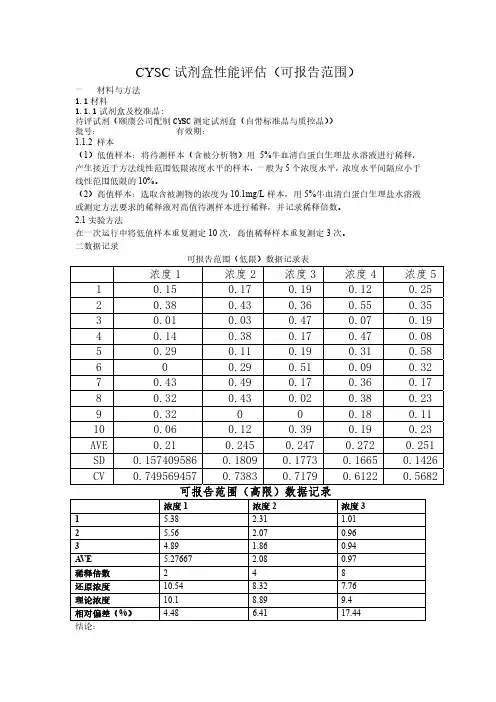
CYSC试剂盒性能评估(可报告范围)一 材料与方法1.1材料1.1.1试剂盒及校准品:待评试剂(颐康公司配制CYSC测定试剂盒(自带标准品与质控品))批号: 有效期:1.1.2 样本(1)低值样本:将待测样本(含被分析物)用5%牛血清白蛋白生理盐水溶液进行稀释,产生接近于方法线性范围低限浓度水平的样本,一般为5个浓度水平,浓度水平间隔应小于线性范围低限的10%。
(2)高值样本:选取含被测物的浓度为10.1mg/L样本,用5%牛血清白蛋白生理盐水溶液或测定方法要求的稀释液对高值待测样本进行稀释,并记录稀释倍数。
2.1实验方法在一次运行中将低值样本重复测定10次,高值稀释样本重复测定3次。
二数据记录可报告范围(低限)数据记录表浓度1 浓度2浓度3浓度4 浓度51 0.15 0.17 0.19 0.12 0.252 0.38 0.43 0.36 0.55 0.353 0.01 0.03 0.47 0.07 0.194 0.14 0.38 0.17 0.47 0.085 0.29 0.11 0.19 0.31 0.586 0 0.29 0.51 0.09 0.327 0.43 0.49 0.17 0.36 0.178 0.32 0.43 0.02 0.38 0.239 0.32 0 0 0.18 0.1110 0.06 0.12 0.39 0.19 0.23AVE 0.21 0.245 0.247 0.272 0.251 SD 0.157409586 0.18090.17730.1665 0.1426 CV 0.749569457 0.73830.71790.6122 0.5682可报告范围(高限)数据记录浓度1 浓度2 浓度31 5.38 2.31 1.012 5.56 2.07 0.963 4.89 1.86 0.94A VE 5.27667 2.08 0.97稀释倍数 2 4 8还原浓度10.54 8.32 7.76理论浓度10.1 8.89 9.4相对偏差(%) 4.48 6.41 17.44结论:本试剂盒可报告范围低限为0.251mg/L,可最大的稀释倍数为4倍,结合试剂盒的线性上限为8mg/L,可测定的最大范围为32mg/L。

体外诊断试剂性能分析评估体外诊断试剂性能评估指标体外诊断试剂是疾病诊断与治疗的重要辅助手段。
一个新开发的试剂能否真正面市,除了进行反应模式和体系等优化外,合理的性能分析与评估,是必经的程序,也是质量保障的基础。
通常,体外诊断试剂产品性能评估包括检测限、线性范围、可报告范围,准确度,精密度,干扰实验,稳定性,参考区间。
1.检测限检测限是指检测方法可检测出的最低被检测量浓度,也称为分析灵敏度。
分析灵敏度:一般用95%可信限计算:重复测定空白样本20次,计算20次反应测得的均值(X)和标准差(SD),以X+2SD(夹心法)或X-2SD(竞争法)计算出相应的浓度,即为体外诊断试剂的分析灵敏度,也是注册资料所需提供的内容。
功能灵敏度:将低值样本倍比稀释后重复测定10次以上,计算每个低值样本检测信号的均值、标准差和变异系数(CV),选择CV大于20%时所对应的低值样本平均浓度,这就是体外诊断试剂的功能灵敏度。
2.线性范围线性范围是指检测系统最终输出值(浓度或活性)与被分析物的浓度成正比的范围。
建立一种定量测定方法的线性范围,需在预期测定范围内选择7-11个浓度水平。
准备足量的高值(H)样本和低值(L)样本,经不同比例混合配制成中间浓度样本,比例关系可按等间距或其他确定的比例。
其中,有几个重要的浓度水平需要考虑:1)最低分析浓度或线性范围下限;2)不同的医学决定水平值;3)最高分析浓度或线性范围上限。
3.可报告范围可报告范围是指对检测有意义的待测物浓度范围。
可报告范围低限:以方法性能指示的CV值为可接受界值,由数据中选取CV值等于或小于可接受界值的最低浓度水平作为可报告范围低限。
可报告范围高限:当测定值超出线性范围上限时,此测定值应视为不准确值,需要对标本进行稀释。
由于基质效应的影响,任何标本并非可以做无止境的稀释。
也就是说,每一个实验项目有其最大稀释倍数。
这个最大稀释倍数与线性范围上限的乘积即为可报告范围高限。

如何评估体外诊断试剂盒线性范围线性范围评估资料是评价拟上市试剂盒有效性的重要依据,也是诊断试剂盒注册所需的重要申报资料之一。
目前我国定量体外诊断试剂盒注册检验包括线性范围、准确度、特异性、最低检出限、精密度等指标。
本文根据《体外诊断试剂分析性能评估系列指导原则》(征求意见稿)对体外诊断试剂盒线性范围评估进行分析。
要求:体外诊断试剂盒校准品的浓度应覆盖整个厂家声明的线性范围的系列浓度。
绘制散点图及离群值的发现和处理:散点图的绘制对于线性范围评价非常重要,其作用包括:①初步获得数据的线性关系(直线、抛物线或S型曲线等),以初步核实企业标准中声明的线性回归方程的正确性。
②观察数据的精密性,当与其他浓度相比某个浓度水平精密度较低时,特别是发生在声明的线性范围的两端,应注意线性范围是否过宽的情况;发现离群值,明显的离群值可以通过观察散点图被容易的发现。
若只有一个离群值,则可剔除,不必重复实验,但当离群值多于一个时,应仔细分析,找出问题所在并重复实验,然后使用新数据进行分析。
线性回归分析:使用企业声明的方程,通过适当的软件,对数据进行回归分析,置信水平一般为双侧0.05,计算方程的相关系数r或确定系数R2,应符合企业注册标准中的规定。
根据行业标准,相关系数r的绝对值一般应不小于0.98。
当散点图明显提示拟合的曲线可能过原点时,或数据计算是已扣除零点样本读数时,应注意检验回归方程中的截距项。
利用样本对体外诊断试剂盒线性范围评价要求:定量体外诊断试剂产品注册检验线性评价涉及的样本通常是临床样本、企业内部校准品、国家参考品或国际标准品等。
样本应不少于5个、能覆盖整个厂家声明的线性范围,每个浓度水平样本测定应不少于2次。
各样本可以是绝对浓度或相对值来标识。
理想的情况下,应使用高值和低值临床样本按比例混合得到系列浓度的样本,这主要考虑的是基质效应对检测结果的影响。
绘制散点图及离群值的发现和处理:同校准品的线性范围评价。