2014届高三化学一轮复习 第6讲 钠及其化合物(含详解)
- 格式:doc
- 大小:81.00 KB
- 文档页数:7



第6讲 钠及其化合物【学科核心素养】1.宏观辨识与微观探析:认识钠及其化合物的性质和应用。
能从钠的原子结构及其重要化合物的微观结构理解其性质,领悟结构决定性质。
2.科学探究与创新意识:了解钠及其化合物的性质探究方案,并积极参与实验探究过程,得出相关结论。
【核心素养发展目标】1.能从钠原子的结构(微观)分析认识钠是一种非常活泼的金属,具有很强的还原性(宏观)。
2.设计实验探究钠与氯气、水的反应,会分析钠与酸、碱溶液的反应,促进“证据推理与模型认知”化学核心素养的发展。
1.从物质类别、元素化合价的角度认识氧化钠与过氧化钠的性质,熟知过氧化钠与水和二氧化碳反应的应用。
2.会设计实验探究过氧化钠与水的反应,探究并比较碳酸钠与碳酸氢钠的性质,学会焰色试验操作,增强科学探究与创新意识。
【知识点解读】 知识点一 钠与碱金属 一、钠的性质及应用 1.钠的物理性质2.从钠原子的原子结构认识钠的化学性质——还原性Na―――――――――→O 2、Cl 2、H 2O 、H +等失去e-Na +(1)与非金属单质(如O 2、Cl 2)的反应O 2⎩⎪⎨⎪⎧常温:4Na +O 2===2Na 2O加热:2Na +O 2=====△Na 2O 2Cl 2:2Na +Cl 2=====点燃2NaCl (2)与水反应△离子方程式:2Na+2H2O===2Na++2OH-+H2↑。
△钠与水(含酚酞)反应的实验现象及解释(3)与盐酸反应离子方程式:2Na+2H+===2Na++H2↑。
【特别提醒】Na先与酸反应,再与水反应——先酸后水。
(4)与盐的反应△Na与盐反应的原理△钠与盐溶液反应的分析方法第一步:钠与水反应生成NaOH和H2;第二步:生成的NaOH如果能与溶质反应,则发生的是NaOH与溶质的复分解反应。
(5)与羟基化合物的反应2Na+2C2H5OH―→2C2H5ONa+H2↑(6)钠在空气中的变化过程因此,钠久置在空气中,最终变成Na 2CO 3粉末。


2014高考化学考点复习讲析考点23 钠及其化合物1.了解金属钠及其重要化合物的物理性质,。
2.了解钠的化学性质3.了解钠的氧化物和过氧化物的重要性质4.知道碳酸钠和碳酸氢钠的区别,掌握其鉴别方法5.了解钠和钾的焰色反应6. 了解碱金属的物理性质和化学性质,运用原子结构的知识分析碱金属在性质上的差异及递变规律。
一、钠元素的原子结构与在自然界的存在钠元素位于周期表__周期__族,自然界中钠只能以的形态存在,主要以的形式存在。
二、钠1.钠的物理性质钠是色有的体,硬度较,低,密度比水。
2.钠的化学性质Na - e- → Na+化学反应中表现为性(1)与非金属单质的反应(写出下列方程式)a.与氯气反应:b.与硫反应:c.与氧气反应①常温下,现象:化学方程式:②加热时,现象:化学方程式:(2)与水的反应、与醇、酚、羧酸等含-OH的有机物反应。
a.与水反应现象:化学方程式:思考:钠与水反应的现象说明钠具有哪些性质?b.与乙醇反应现象:化学方程式:。
c.与乙酸反应:。
(3)与稀酸溶液的反应与盐酸反应。
(4)与某些盐的反应a.与熔融盐 Na+TiCl4。
b.与盐溶液(CuSO4溶液)。
思考:钠在空气中放置一段时间,将发生哪些变化?最终产物是什么?如何保存?三、钠的化合物1.氧化钠和过氧化钠的比较2.氢氧化钠(俗称:、、)(1)电子式: ,所含化学键为、(2)物理性质:有很强的性,易(用作剂),溶于水时会。
(3)化学性质:具有碱性。
(4)制法(工业制法):(5)保存:溶液;固体。
3.Na2CO3与NaHCO3比较与鉴别(1)Na2CO3与NaHCO3比较思考:Na2CO3溶液与盐酸作用时,滴加顺序不同,现象一样吗?(2)根据上叙性质用多种方法区别Na2CO3与NaHCO3四、碱金属元素(一)碱金属元素的原子结构共同点:原子的最外层均为个电子,都易 1个电子而表现性;不同点:核电荷数逐渐;电子层数逐渐;原子半径依次,得电子能力逐渐;单质还原性逐渐。
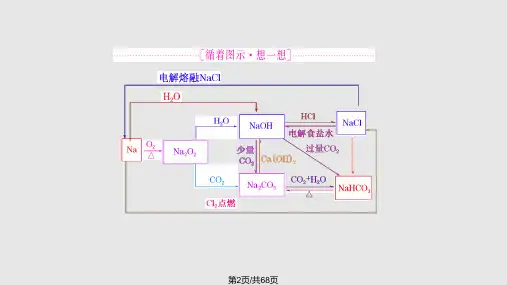





2014高考化学必备专题——钠及其化合物 【高考预测】纵观近几年的高考试题除在选择题中对本部分知识经常考察外,还利用元素推断题、工业流程题、实验题等考察钠的结构、过氧化钠的电子式、化学键类型、以及与钠、过氧化钠、碳酸钠、碳酸氢钠等相关知识和实验。
在今后的复习中多关注钠及其化合物的简单知识点和实验创新点,注意关系式法、极值法以及守恒思想的运用。
一、知识网络 (1)注意钠及其化合物溶于水所得溶液浓度的计算中,Na及Na2O2溶于水均会产生气态物质,所得溶液的质量应是原混合物质的质量总和减去产生气体的质量。
NaOH。
(2)注意Na2O2跟CO2和水蒸气组成的混合气体反应时的先后顺序。
即应先考虑Na2O2跟CO2的反应 (3)正确理解“焰色反应”: ①它是元素的一种物质性质。
无论是金属离子或金属原子均能发生焰色反应。
它属物理变化过程。
②不是所有元素都有特征的焰色。
只有碱金属元素以及钙、锶、钡、铜等少数金属元素才能呈现焰色反应 ③焰色反应的显色过程与气体物质燃烧时产生各色火焰的过程有着本质的区别。
焰色反应并非金属及其化合物自身发生燃烧反应而产生各种颜色火焰的过程,而是它们的原子或离子的外围电子被激发而产生的各种颜色的光的过程。
二、基础知识 与氯气在氯气中燃烧,产生白烟与硫钠与硫混合研磨可发生爆炸与化合物反应与水(加酚酞)现象:浮、熔、游、气、响、红与酸(HCl)反应极为剧烈,可能发生爆炸与盐溶液(CuSO4溶液)浮、熔、游、气、响、蓝色沉淀与有机物(醇、酚、羧酸)与乙醇反应,钠沉于底部,反应缓慢例1:(2013·广东理综·23)下列实验的现象与对应结论均正确的是 选项操作现象结论A将浓硫酸滴到蔗糖表面固体变黑膨胀浓硫酸有脱水性和强氧化性B常温下将Al片放入浓硝酸中无明显变化Al与浓硝酸不反应C将一小块Na放入无水乙醇中产生气泡Na能置换出醇羟基中的氢D将水蒸气通过灼热的铁粉粉末变红铁与水在高温下发生反应 2、比较钠的化合物的性质 (1)氧化钠和过氧化钠的比较 化学式Na2ONa2O2色态白色固体淡黄色粉末氧元素的化合价-2-1电子式属类碱性氧化物过氧化物(非碱性氧化物)化学性质 (与不同 物质反应)H2ONa2O+H2O=2NaOH2Na2O2+2H2O=4NaOH+O2↑CO2Na2O+CO2=Na2CO32Na2O2+2CO2=2Na2CO3+O2SO2Na2O+SO2=Na2SO3Na2O2 +SO2=Na2SO4HClNa2O+2HCl=2NaCl+H2O2Na2O2+4HCl=4NaCl+2H2O+O2↑用途——氧化剂、供氧剂、漂白剂、杀菌剂由钠的生成条件常温下缓慢氧化燃烧或加热 相互转化例2:把4.48LCO2通过一定质量的固体Na2O2后,收集到3.36L(S.P.T.)气体,则这3.36L气体的质量是( )。
第6讲钠及其化合物基础热身1.钠与水反应时的现象与钠的下列性质无关的是( )A.钠的熔点低B.钠的密度小C.钠的硬度小 D.钠有强还原性2.在庆祝中华人民共和国成立60周年的晚会上,焰火贯穿了晚会的始终,成为最吸引“眼球”的晚会印象。
焰火与高中化学中“焰色反应”知识相关,下列说法中正确的是( ) A.非金属单质燃烧时火焰均为无色B.所有金属及其化合物灼烧时火焰均有颜色C.焰色反应均应透过蓝色钴玻璃观察D.NaCl与Na2CO3灼烧时火焰颜色相同3.潜艇上的核反应堆内使用了液体铝钠合金作载热介质,大大提高了热能的传递和转化效率。
下列有关说法不正确的是( )A.原子半径:Na>AlB.将铝钠合金投入一定量的水中若无固体残留,则n(Al)≤n(Na)C.铝钠合金投入足量氯化铜溶液中,肯定有氢氧化铜沉淀生成,也可能有铜析出D.m g不同组成的铝钠合金投入足量盐酸中,放出的H2越多,则铝的质量分数越小4.可用于判断碳酸氢钠粉末中混有碳酸钠的实验方法是( )A.加热时无气体放出B.滴加盐酸时有气泡放出C.溶于水后滴加稀BaCl2溶液有白色沉淀生成D.溶于水后滴加澄清石灰水有白色沉淀生成5.某溶液中含有HCO-3、SO2-3、CO2-3、CH3COO-四种阴离子,向其中加入足量的Na2O2固体后,假设溶液体积无变化,溶液中离子浓度基本保持不变的是( )A.CO2-3B.HCO-3C.CH3COO-D.SO2-3能力提升6.16.8 g NaHCO3和7.8 g Na2O2在密闭容器中灼烧,充分反应后,将密闭容器保持温度为500 ℃。
最后容器内的物质是( )A.Na2CO3、Na2O2和O2B.Na2CO3、O2和H2O(g)C.Na2CO3、CO2、O2和H2O(g)D.NaHCO3、Na2CO3和O27.①将0.100 L 1.00 mol·L-1的纯碱溶液逐滴滴入0.100 L 1.25 mol·L-1的盐酸中;②将0.100 L 1.25 mol·L-1的盐酸逐滴滴入0.100 L 1.00 mol·L-1的纯碱溶液中,两种操作产生CO2的体积比为( )A.5∶2 B.2∶5C.2∶1D.1∶18.[2012·南昌调研] Na3N和NaH都是离子化合物,与水反应都有气体生成,下列说法中正确的是( )A.两种物质的阴离子半径都比阳离子半径小B.与水反应时,水都做氧化剂C.与盐酸反应都只生成一种盐D.溶于水,所得溶液都能使无色酚酞变红9.[2012·南昌调研] 下列各组物质混合后,不能同时产生无色气体和白色沉淀的是( )A .少量过氧化钠投入AlCl 3溶液B .Ba(OH)2溶液与(NH 4)2SO 4C .FeCl 3溶液与NaHCO 3溶液混合加热D .明矾溶液与小苏打溶液混合10.[2012·济宁期末] 已知A 、B 为单质,C 为化合物。
能实现下述转化关系的是( )A +B ――→点燃C ――→溶于水C 溶液――→惰性电极电解A +B①若C 溶于水后得到强碱溶液,则A 可能是Na②若C 溶液遇Na 2CO 3放出CO 2气体,则A 可能是H 2③若C 溶液中滴加KSCN 溶液显红色,则B 可能为Fe④若C 溶液中滴加NaOH 溶液有蓝色沉淀生成,则B 可能为CuA .①②B .②④C .①③D .③④11.[2012·安徽名校联考] 取一定量的NaOH 溶液通入CO 2后,再继续向该溶液中逐滴加入0.1 mol·L -1的盐酸,标准状况下产生的CO 2的体积与所加盐酸体积之间的关系如图K6-1所示,下列有关说法正确的是( )图K6-1A .原溶液中NaOH 的物质的量为0.75 molB .通入CO 2后所得的溶液溶质成分为NaOH 和Na 2CO 3C .通入CO 2后所得的溶液中含有2.5×10-3 mol NaHCO 3D .纵坐标中a 的数值为22412.[2012·黄冈期末] 25 ℃、101 kPa 下:①2Na(s)+12O 2(g)===Na 2O(s) ΔH 1=-414 kJ/mol ;②2Na(s)+O 2(g)===Na 2O 2(s)ΔH 2=-511 kJ/mol 。
下列说法正确的是( )A .①和②生成等物质的量的产物,转移的电子数相同B .Na 与足量O 2反应生成Na 2O ,随温度升高生成Na 2O 的速率逐渐加快C .25 ℃、101 kPa 下,Na 2O 2(s)+2Na(s)===2Na 2O(s) ΔH =+317 kJ/molD .①和②产物中的阴阳离子个数比均为1∶113.有X 、Y 、Z 三种物质,它们之间存在如下转化关系:图K6-2(1)若X、Y、Z三种物质的焰色反应均为黄色,三个反应均为化合反应,则Y的化学式为________________________________________________________________________,Z的电子式为________________;Y、Z两种物质相比,相同的化学键类型为________________,当由X制取Z的上述两种途径生成Z的量相等时,转移电子数目比为__________。
(2)若X、Y、Z均为常见化合物且三种物质中均含有相同的两种短周期元素,0.1 mol/L 的三种物质的溶液pH:Y>X>Z>7,则①的化学方程式为________________________________________________________________________ ________________________________________________________________________,③的离子方程式为________________________________________________________________________。
(3)若X、Y、Z三种物质均含有同一种金属元素,X是单质,Y是日常生活中最重要的盐,②的反应条件为电解,则②的化学方程式为________________________________________________________________________ ________________________________________________________________________,③的离子方程式为________________________________________________________________________。
14.某校化学研究性学习小组设计如下实验方案,测定放置已久的小苏打样品中纯碱的质量分数。
(1)方案一:称取一定质量的样品,置于坩埚中加热至恒重后,冷却,称量剩余固体质量,计算。
实验中加热至恒重的目的是________________________________________________________________________。
(2)方案二:按如图K6-3所示装置进行实验。
并回答以下问题:图K6-3①实验前应先________________________________________________________________________。
分液漏斗中应该装________(填“盐酸”或“稀硫酸”)。
D装置的作用是________________________________________________________________________ ________________;②实验中除称量样品质量外,还需称________装置(用字母表示)前后质量的变化;③根据此实验得到的数据,测定结果有较大误差。
因为实验装置还存在一个明显缺陷,该缺陷是________________________________________________________________________ ________________________________________________________________________。
(3)方案三:称取一定量样品,置于小烧杯中,加适量水溶解,向小烧杯中加入足量氯化钡溶液,过滤洗涤,干燥沉淀,称量固体质量,计算:①过滤操作中,除了烧杯、漏斗外还用到的玻璃仪器有________;②试验中判断沉淀是否完全的方法是________________________________________________________________________ ________________________________________________________________________;③若加入试剂改为氢氧化钡,已知称得样品9.5 g,干燥的沉淀质量为19.7 g,则样品中碳酸钠的质量分数为________(保留一位小数)。
挑战自我15.汽车安全气囊是行车安全的重要保障。
当车辆发生碰撞的瞬间,安全装置通电点火使其中的固体粉末分解释放出大量的氮气形成气囊,从而保护司机及乘客免受伤害。
为研究安全气囊工作的化学原理,取安全装置中的固体粉末进行实验。
经组成分析,确定该粉末仅含Na、Fe、N、O四种元素。
水溶性实验表明,固体粉末部分溶解。
经检测,可溶物为化合物甲;不溶物为红棕色固体,可溶于盐酸。
取13.0 g化合物甲,加热使其完全分解,生成氮气和单质乙,生成的氮气折合成标准状况下的体积为6.72 L。
单质乙在高温隔绝空气的条件下与不溶物红棕色粉末反应生成化合物丙和另一种单质。
化合物丙与空气接触可转化为可溶性盐。
请回答下列问题:(1)甲的化学式为________,丙的电子式为________________________________________________________________________。
(2)若丙在空气中转化为碳酸氢盐,则反应的化学方程式为________________________________________________________________________。
(3)单质乙与红棕色粉末发生反应的化学方程式为________________________________________________________________________________,安全气囊中红棕色粉末的作用是________________________________________________________________________ ________________________________________________________________________。