化学动力学习题课_14章_
- 格式:ppt
- 大小:988.00 KB
- 文档页数:37



化学教案–《化学动力学》教案化学教案–《化学动力学》一、教学目标1. 知识与技能:理解化学反应速率的概念,掌握影响化学反应速率的因素,能够运用化学动力学原理分析实际问题。
2. 过程与方法:通过实验探究、讨论交流等教学方法,培养学生的观察能力、实验操作能力和合作能力。
3. 情感态度与价值观:激发学生对化学学科的兴趣,培养严谨求实的科学态度。
二、教学重点与难点1. 教学重点:化学反应速率的概念,影响化学反应速率的因素。
2. 教学难点:实验探究过程中的数据分析与处理,化学反应速率公式的推导与应用。
三、教学准备1. 教师准备:多媒体课件、实验器材、实验药品。
2. 学生准备:实验报告本、笔。
四、教学过程(一)导入新课1. 通过提问引导学生思考化学反应速率的概念,激发学生的学习兴趣。
2. 引入课题:化学动力学。
(二)新课讲解1. 讲解化学反应速率的概念,强调反应速率与反应物的浓度、温度、催化剂等因素的关系。
2. 通过实例分析,让学生理解化学反应速率的实际意义。
(三)实验探究1. 实验目的:探究不同因素对化学反应速率的影响。
2. 实验步骤:a. 准备实验器材和药品,包括试管、滴管、酒精灯、铁架台、氢氧化钠溶液、硫酸铜溶液等。
b. 实验一:探究浓度对反应速率的影响。
分别配制不同浓度的氢氧化钠溶液,加入相同体积的硫酸铜溶液,观察反应速率的变化。
c. 实验二:探究温度对反应速率的影响。
将氢氧化钠溶液加热,观察反应速率的变化。
d. 实验三:探究催化剂对反应速率的影响。
加入不同催化剂,观察反应速率的变化。
3. 数据记录与处理:让学生记录实验数据,并进行比较分析,得出结论。
(四)讨论交流1. 分组讨论:让学生分享实验结果,分析影响化学反应速率的因素。
2. 教师点评:总结讨论结果,强调化学反应速率与实际应用的关系。
(五)巩固练习1. 课堂练习:完成课后习题,巩固所学知识。
2. 课后作业:查阅资料,了解化学反应速率在实际生产生活中的应用。

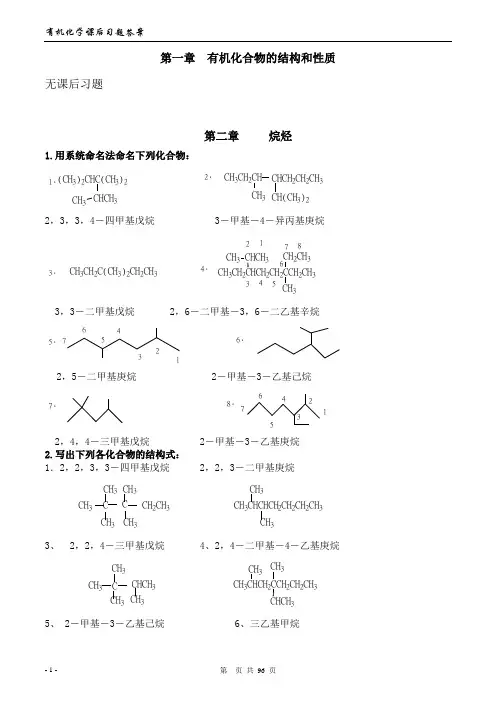
有机化学(第二版)课后习题参考答案第一章绪论1-1 扼要解释下列术语.(1)有机化合物(2) 键能、键的离解能(3) 键长(4) 极性键(5) σ键(6)π键(7) 活性中间体(8) 亲电试剂(9) 亲核试剂(10)Lewis碱(11)溶剂化作用(12) 诱导效应(13)动力学控制反应(14) 热力学控制反应答:(1)有机化合物-碳氢化合物及其衍生物(2) 键能:由原子形成共价键所放出的能量,或共价键断裂成两个原子所吸收的能量称为键能。
)键的离解能:共价键断裂成两个原子所吸收的能量称为键能。
以双原子分子AB为例,将1mol 气态的AB拆开成气态的A和B原子所需的能量,叫做A—B键的离解能。
应注意的是,对于多原子分子,键能与键的离解能是不同的。
分子中多个同类型的键的离解能之平均值为键能E。
(3) 键长:形成共价键的两个原子核之间距离称为键长。
(4) 极性键: 两个不同原子组成的共价键,由于两原子的电负性不同, 成键电子云非对称地分布在两原子核周围,在电负性大的原子一端电子云密度较大,具有部分负电荷性质,另一端电子云密度较小具有部分正电荷性质,这种键具有极性,称为极性共价键。
(5) σ键:原子轨道沿着轨道的对称轴的方向互相交叠时产生σ分子轨道, 所形成的键叫σ键。
(6) π键:由原子轨道侧面交叠时而产生π分子轨道,所形成的键叫π键。
(7) 活性中间体:通常是指高活泼性的物质,在反应中只以一种”短寿命”的中间物种存在,很难分离出来,,如碳正离子, 碳负离子等。
(8) 亲电试剂:在反应过程中,如果试剂从有机化合物中与它反应的那个原子获得电子对并与之共有形成化学键,这种试剂叫亲电试剂。
、(9) 亲核试剂:在反应过程中,如果试剂把电子对给予有机化合物与它反应的那个原子并与之共有形成化学键,这种试剂叫亲核试剂。
(10) Lewis碱:能提供电子对的物种称为Lewis碱。
(11)溶剂化作用:在溶液中,溶质被溶剂分子所包围的现象称为溶剂化作用。

《物理化学》习题课 (电化学、动力学部分)(中科院2009硕士入学考试)1. 某药物分解反应为一级反应,298K 时,反应速率常数k 为0.46h -1,若服用该药物0.16g ,则体内停留多长时间分解90%?A) 3h B) 5h C) 4.6h D) 6h2. 升高温度可以增加反应速率,主要原因是A) 增加分子总 B) 增加活化分子总数C) 降低反应的活化能 D) 使反应向吸热方向进行3. 浓度为0.001 mol/L 的硫酸钠溶液的电导率为0.026 S.cm 2,当该溶液饱和了硫酸钙以后,电导率上升为0.070 S.cm 2,求硫酸钙的活度积(已知Na +与1/2Ca 2+的摩尔电导率分别为5.0×10-3和6.0×10-3 S.m 2.mol -1)4. 某气相反应12()()()k k A g B g C g −−→+←−−,在298K 时,K 1=0.2s -1,K 2=5×10-6 pa ∙s -1,当温度升高到310K 时,K 1和K 2均增加1倍,求:(1)298K 的平衡常数; (2)正逆反应的表观活化能; (3)反应的r m H ∆; (4)在298K 时,A 的起始压力为101.325kpa ,总压力到151.99kpa 时,需时间多少?(中科院2007硕士入学考试)5. 某反应的速率常数与各基元反应的速率常数的关系为124()2k k k k =,则该反应的表观活化能E a 与各基元反应活化能的关系为: (A) 21412a E E E E =+- (B) 2141()2a E E E E =+- (C) 1/2214(2)a E E E E =+- (D) 214a E E E E =+-6. 在化学反应动力学中,反应级数是个宏观的概念,其值 。
(A )只能是正整数; (B )可正、可负、可为零,可以是整数,也可以是分数;(C )只能是0,1,2,3,· ; (D )无法确定。



大学化学教材1、大学化学/普通高等教育“十一五”国家级规划教材2、大学化学教程——高等学校教材3、新大学化学(第二版)4、大学化学——面向21世纪课程教材5、化学功能材料概论——高等学校教材6、新编普通化学/21世纪高等院校教材7、大学基础化学/高等学校教材8、大学化学9、大学化学10、大学普通化学(第六版)11、大学化学教程——21世纪高等院校教材12、大学化学13、化学实验教程——高等学校教材14、大学化学(高等学校教学用书)15、大学化学原理及应用(上下)/高等学校教材16、大学化学教程/高等学校教材17、大学基础化学/新世纪高职高专教材18、新大学化学19、大学化学原理及应用·上下册20、普通化学(英文版)21、近代高分子科学22、绿色化学与环境23、普通化学简明教程24、大学化学(第二版)——高等学校教材1、大学化学/普通高等教育“十一五”国家级规划教材•作者:金继红主编•丛书名:•出版社:化学工业出版社•ISBN:9787502597221•出版时间:2007-1-1•版次:1•印次:1•页数:403•字数:679000•纸张:胶版纸•包装:平装•开本:16开•定价:39 元当当价:30.6 元折扣:78折节省:8.40元钻石vip价:30.60 元••共有顾客评论0条内容提要本书为普通高等教育“十一五”国家级规划教材。
本书在编写过程中注意与中学化学的衔接,力求理论联系实际,概念阐述准确,深入浅出,循序渐进,便于教师教学和学生自学。
本书包括物质的聚集状态、热力学第一定律、热力学第二定律、相平衡、化学平衡、水溶液中的离子平衡(含酸碱滴定、重量分析)、氧化还原和电化学基础(含氧化—还原滴定)、原子结构、分子结构、晶体结构、配位化合物(含配位滴定)、单质和无机化合物、表面与胶体、环境化学及材料化学等内容。
本书可供高等学校非化学化工类专业对化学要求较多的材料、地质、能源、环境、冶金、海洋等专业的基础化学教学使用。

第一部分:1.对元反应A+2B→C,若将其反应速率方程写为下列形式, 则k A 、k B 、k C 间的关系应为:( )A k A = kB = kC B k A =2 k B = k C C k A =1/2 k B = k C [解]C ,反应速率之比r A :r B :r C =1:2:1,k A :k B :k C=1:2:12.某反应,无论反应物初始浓度为多少, 在相同时间和温度时, 反应物消耗的浓度为定值,此反应是A 负级数反应B 一级反应C 零级反应D 二级反应 [解]C ,一级反应积分速率方程C A ,0-C A =kt ,反应物浓度的消耗C A ,0-C A 就是与k 和t 有关,k 和温度有关,当温度和时间相同时,反应物浓度的消耗是定值。
3.关于反应级数的各种说法中正确的是 A 只有基元反应的级数是正整数 B 反应级数不会小于零C 反应总级数一定大于对任一反应物级数D 反应级数都可通过实验来确定 [解]D ,4.某反应,A→Y,其速率系数k A =6.93min -1,则该反应物A 的浓度从1.0mol ×dm -3变到0.5 mol ×dm -3所需时间是( )A 0.2minB 0.1minC 1min[解]B ,从速率系数的单位判断是一级反应,代入积分速率方程,0lnA AC kt C =,1ln6.930.5t =,t=0.1min 。
5.某反应,A→Y,如果反应物A 的浓度减少一半,它的半衰期也缩短一半,则该反应的级数为( )A 零级B 一级C 二级[解]A ,半衰期与浓度成正比,所以是零级反应。
6.某化学反应的速率常数为2.0mol ·l -1·s -1,该化学反应的级数为 A.1 B.2 C.0 D.-1 [解]C ,从速率常数的单位判断是零级反应。
7.放射性Pb 201的半衰期为8小时,1克放射性Pb 201经24小时衰变后还剩 A.1/3g B.1/4g C.1/8g D.0gBA B B d d c c k t c =-B A C C d d c c k t c =B A A A d d c c k t c =-[解]C ,放射性元素的衰变是一级反应,通过半衰期公式12ln 2t k =,ln 28k =,再代入一级反应积分速率方程,,0lnA AC ktC =,起始浓度为1g ,1ln 2n*248A C =,18A C g =。

给水工程14-21章课后思考题与习题答案-整合版答:CMB和CSTR反应器内的混合是两种不同的混合。
前者是同时进入反应器又同时流出反应器的相同物料之间的混合,所有物料在反应器内停留时间相同;后者是在不同时间进入反应器又在不同时间流出反应器的物料之间的混合,物料在反应器内停留时间各不相同,理论上,反应器内物料的停留时间由0至无穷大。
这种停留时间不同的物料之间混合,在化学反应工程上称之为“返混”。
显然,在PF反应器内,是不存在返混现象的。
造成返混的原因,主要是环流、对流、短流、流速不均匀、设备中存在死角以及物质扩散等等。
返混:广义地说,泛指不同时间进入系统的物料之间的混合,狭义地说,返混专指物料逆流动方向的流动和混合。
8、PF型和CMB型反应器为什么效果相同?两者优缺点比较。
答:在推流型反应器的起端(或开始阶段),物料是在C0的高浓度下进行反应,反应速度很快。
沿着液流方向,随着流程增加(或反应时间的延续),物料浓度逐渐降低,反应速度也随之逐渐减小。
这与间歇式反应器的反应过程是完全一样的。
介它优于间歇式反应器的在于:间歇式反应器除了反应时间以外,还需考滤投料和卸料时间,而推流型反应器为连续操作。
9.为什么CSTR型反应器生产能力低于PF型?在PF反应器内,液流以相同流速平行流动,物料浓度在垂直于流动方向完全混合均匀,但沿流动反向绝无混合现象,物料浓度在流动方向形成浓度梯度。
而在CSTR型反应器内,物料完全均匀混合,无论进口端还是出口端,浓度都相同。
PF型反应器在进口端是在高浓度C0下进行反应,反应速率高,只是在出口端才在低浓度Ce下进行反应。
而CSTR型始终在低浓度Ce下进行反应,故反应器始终处于低反应速率下操作,这就是CSTR型反应器生产能力低于PF型的原因。
10、何谓“纵向分散模型”(PFD)?纵向分散模型对水处理设备的分析研究有何作用?(7’)答:实际反应器总是介于推流型和完全混合连续流型之间。
第十一章化学动力学基础(一)练习题一、选择题1. 某化学反应的方程式为2A →P,则在动力学研究表明该反应为:( )(A) 二级反应(B) 基元反应(C) 双分子反应(D) 以上都无法确定2. 对下面反应来说,当用-(d[N2]/dt)表示其反应速率时,与此速率相当的表示是:( )3H2(g)+ N2(g)= 2NH3(g)(A) 2(d[NH3]/dt)(B) 1/3(d[H2]/dt(C) -1/2(d[NH3]/dt)(D) 1/2(d[NH3]/dt)3. 某化学反应为2A + B →P,实验测定其速率常数为k = 0.25 (mol • dm-3)-1• s-1, 则该反应的级数为:( )(A) 零级反应(B) 一级反应(C) 二级反应(D) 三级反应4. 某一基元反应为mA →P,动力学方程为r = k[A]m,[A]的单位是mol • dm-3,时间的单位是s,则k的单位是:( )(A) mol(1 - m)• dm3(m - 1)• s-1(B) mol- m• dm3m• s-1(C) mol(m - 1)• dm3(1 - m)• s-1(D) mol m• dm-3m• s-15. 某气相反应在400 K时的k p = 10-3 kPa-1• s-1,若用k c表示应等于:( )(A) 3326 (mol • dm-3)-1• s-1(B) 3.326 (mol • dm-3)-1• s-1(C) 3.01 × 10-4(mol • dm-3)-1• s-1(D) 3.01 × 10-7(mol • dm-3)-1• s-16. 某反应,当反应物反应掉5/9所需时间是它反应掉1/3所需时间的2倍,则该反应时:( )(A) 3/2级反应(B) 二级反应(C) 一级反应(D) 零级反应7. 有两个都是一级反应的平行反应:下列说法错误的是:( ) (A) k总= k1 +k2(B) E总= E1 +E2(C) k1/k2 = [B]/[C] (D) t1/2 = ln2/(k1 + k2)8. 某一分解反应,当反应物浓度为0.2 mol•L-1,反应速率为0.3 mol•L-1•s-1。
物理化学第十三、十四章习题课内容-CAL-FENGHAI-(2020YEAR-YICAI)_JINGBIAN第十三章表面现象习题课内容一、单选题:2.在液面上,某一小面积S周围表面对S有表面张力,下列叙述不正确的是:(A) 表面张力与液面垂直;(B) 表面张力与S的周边垂直;(C) 表面张力沿周边与表面相切;(D) 表面张力的合力在凸液面指向液体内部(曲面球心),在凹液面指向液体外部。
4.一个玻璃毛细管分别插入25℃和75℃的水中,则毛细管中的水在两不同温度水中上升的高度:(A) 相同; (B) 无法确定;(C) 25℃水中高于75℃水中;(D) 75℃水中高于25℃水中。
8.已知20℃时水~空气的界面张力为7.27 × 10-2N·m-1,当在20℃和p下可逆地增加水的表面积4cm2,则系统的ΔG为:(A) 2.91 × 10-5 J ; (B) 2.91 × 10-1 J ;(C) -2.91 × 10-5 J ; (D) -2.91 ×10-1 J 。
12.在一个密闭的容器中,有大小不同的两个水珠,长期放置后,会发生:(A) 大水珠变大,小水珠变小;(B) 大水珠变大,小水珠变大;(C) 大水珠变小,小水珠变大;(D) 大水珠,小水珠均变小。
22.25℃时,乙醇水溶液的表面张力与浓度的关系为:σ(N·m-1) = 0.072 - 5 ×10-4c(mol·dm-3) + 2 ×10-4c2(mol·dm-3)。
若要使表面吸附为正吸附,则要求浓度c(mol·dm-3)应该:(A) > 0.5 ;(B) < 0.5 ;(C) > 1.25 ;(D) <1.25 。
28.矿石浮选法的原理是根据表面活性剂的:(A) 乳化作用;(B) 增溶作用;(C) 去污作用;(D) 润湿作用。