D7172%20cDNA第二链合成试剂盒pdf
- 格式:pdf
- 大小:187.16 KB
- 文档页数:2

cDNA第二链的合成
1)离心沉淀cDNA第一链,并重悬在50μl水中,加50μl 2×第二链缓冲液(0.2mol/L Hepes,pH6.9,20m mol/L MgCl2,5 m mol/L DTT,0.14 mol/L KCl,1 m mol/L 4种Dntp),混合均匀。
2)每微克底物加大肠杆菌DNA聚合酶K1enow片段20~50单位,15℃反应20小时,此酶能识别cDNA 3’末端发卡环,并以其为引物,cDNA第一链为模板,开始第二链的合成。
3)加0.5 mol/L EDTA 2μl终止反应。
取样电泳,以提取第一链同样的方法分离沉淀dsDNA。
对于这样合成的dsDNA不是全长的DNA分子,所以,需要进一步用逆转录酶合成。
4)溶解上述dsDNA在20μl水中,再加入:1mol/L Tris.HCl pH8.3)5μl,1 mol/L KCl 7μl,250m mol/L MgCl2 2μl,20m mol/L 4种‘dNTP各2.5μl,700m mol/L β-MCE 2μl,加重煎水到48μl,加逆转录酶2μl (40单位)、42℃保温反应1小时。
5)加0.5 mol/L EDTA 2μl终止反应,取样电泳,以同样方法抽提,分离沉淀dsDNA。
6)用两次合成的双链cDNA和单链cDNA在1.4%碱性琼脂糖凝胶上电泳,放射自显影后观察,如果dsDNA片段的长度是第一链cDNA的两倍,那么,合成便是成功的。
7)用核酸酶S1消化dsDNA,除去连接两条链的发卡环。

不同发育期油菜种子cDNA-AFLP实验流程Ver 2.0一、总RNA提取1. 采集花后不同日期的油菜种子2. 用具RNase灭活处理(玻璃器皿:160℃烘烤2h;塑料制品:DEPC水浸泡过夜,高压灭菌)3. 液氮下研磨样品,分装100mg/管,-80℃保存4. 每100mg样品加入1ml Trizol,混匀,室温温育5min5. 加入200μl氯仿,剧烈震荡6. 4℃,12000rpm离心15min,上层水相转移至新管7. 加入0.5倍体积异丙醇,室温静置10min8. 4℃,12000rpm离心15min,弃上清,加入200μl 75%乙醇,重悬洗涤沉淀2次9. 4℃,12000rpm离心15min,弃上清,吸尽乙醇,超净台内吹干(不要干透)10. 加入50μl水溶解,-80℃保存。
1%琼脂糖凝胶电泳检测提取结果注:若Trizol对种子RNA提取效果不佳,考虑改用CTAB提取二、RNA结合磁珠1.取20ul总RNA(约2ug),65℃温育10min2.加入1ul 生物素化oligo(dT)引物(700ug/ul),1.1ul 20×SSC,轻轻混匀至完全冷却至室温3.重悬磁珠,磁力架收集,弃上清。
4.用300ul 0.5×SSC重悬磁珠,磁力架收集,弃上清。
洗三次5.将清洗后的磁珠重悬于100ul 0.5×SSC中6.取10ul磁珠,置于管中,加入结合oligo(dT)引物的RNA,室温温育10min,保持磁珠悬浮7.磁力架收集磁珠,100ul 0.1×SSC清洗四次三、cDNA合成1. cDNA第一链合成:按下表加样,42℃温育2h磁珠--- biotinylated oligo(dT) primer (700μg/μl)1μl H2O 24μl 5× First Strand Buffer 8μl0.1M DTT 4μleach 10mM dNTP mix 2μl 2.5mM Superscript II (200U/μl) 1μl M-MLV RTase, RNase H-Final V olume 40μl 或20ulT10E0.1重悬磁珠,H2O 4ul5× First Strand Buffer:(-20℃)250mM Tris-HCl (pH 8.3)15mM MgCl2375mM KCl2. 磁力架收集磁珠,仔细吸弃上清,用5×第二链buffer平衡磁珠,磁力架收集,弃上清3. cDNA第二链合成:按下表加样,12℃温育1h,22℃温育1h磁珠--- 5× Second Strand Buffer 20μl 10×buffer:10μl10mM dNTP mix 2μl0.1M DTT 4μlE.Coli DNA ligase (10U/μl) 1μl 10UDNA Polymerase I (10U/μl) 3μl 30U RNase H (5U/μl) 1μl 5U H2O 69μl Final V olume 100μl或20ulT10E0.1重悬磁珠,H2O 49ul5× Second Strand Buffer: (-20℃)7.0)(pH100mMTris-HCl20mM MgCl2450mMKCl750μM NAD+50mM (NH4)2SO44. 磁力架收集磁珠,仔细吸弃上清,用1×RL-Buffer清洗磁珠,磁力架收集(或20ulT10E0.1清洗)四、Bst YI 酶切1. 向磁珠加入10U BstYI (1μl,10U/μl),4μl 10×RL-Buffer,35μl H2O,共40μl,混匀。

cDNA文库构建cDNA文库[原理]:cDNA文库不同于基因组文库,被克隆DNA是从mRNA反转录来源的DNA。
CDNA 组成特点是其中不含有内含子和其他调控序列。
从而做cDNA克隆时应是先从获得mRNA 开始,在此基础上,通过反转录酶作用产生一条与mRNA相互补的DNA链,然后除掉mRNA,以第一条DNA链为模板复制出第二条DNA链(双链);再进一步把此双链插入原核或真核载体。
cDNA文库的构建分为六个阶段:阶段1:反转录酶催化合成cDNA第一链阶段2:cDNA第二链的合成阶段3:cDNA的甲基化阶段4:接头或衔接子的连接阶段5:Sepharose CL-4B凝胶过滤法分离cDNA阶段6:cDNA与λ噬菌体臂的连接[阶段1:反转录酶催化合成cDNA第一链]1.在置于冰上的无菌微量离心管内混合下列试剂进行cDNA第一链的合成:poly(A)+RNA (1μg/μl) 10μl寡核苷酸引物(1μg/μl) 1μl1mol/L KCl 3.5μl250 mmol/L MgCl22μldNTP溶液(含4种dNTP,每种5mmol/L)10μl0.1 mol/L DTT 2μlRNase抑制剂(选用)25单位加H2O至48μl2.当所有反应组在0℃混合后,取出2.5μl反应液转移到另一个0.5ml微量离心管内。
在这个小规模反应管中加入0.1μl [α-32P] dCTP(400 Ci/mmol, 10mCi/ml)。
3.大规模和小规模反应管都在37℃温育1h。
4.温育接近结束时,在含有同位素的小规模反应管中加入1μl 0.25mol/L EDTA,然后将反应管转移到冰上。
大规模反应管则在70℃温育10 min,然后转移至冰上。
5.参考《分子克隆实验指南》第三版附录8所述方法,测定0.5μl小规模反应物中放射性总活度和可被三氯乙酸(TCA)沉淀的放射性活度。
此外,用合适的DNA分子质量参照物通过碱性琼脂糖凝胶电泳对小规模反应产物进行分析是值得的。

3.1 cDNA第一链的合成1)在0.5ml经DEPC处理过的离心管中分别加入tester和driver的mRNA各2ug(2-4ul),然后加入1ul(10uM) 随机引物(9mer),70℃温浴2min,然后迅速置于冰上放置2min,然后在每管中加入如下混合物:5×First-strand Buffer 2uldNTPs Mix(10mM) 1ulsterile H2O 1ulAMV Reverse Transcriptase(20U/ul) 1ul2)42℃反应1.5hr.,然后将离心管置于冰上,终止cDNA第一链的合成,然后马上进行第二链的合成。
3.2cDNA第二链的合成1)在已经合成好cDNA第一链的离心管中每管加入如下反应物,16℃反应2hr:sterile H2O 48.4-50.4 ul5×Second-strand Buffer 16.0uldNTPs Mix(10mM) 1.6ul20×Second-strand Enzyme Cocktail 4.0ul2) 混匀, 16℃反应2hr3)加入2ul(6U)T4 DNA Polymerase,16℃反应30min。
4)加入20×EDTA/Glycogen Mix 4ul,以终止反应。
5)加入100ul 苯酚:氯仿:异戊醇(25:24:1)抽提,离心14000rpm/10min,吸取上清到一新的1.5ml的离心管中,加入100ul氯仿:异戊醇(24:1)离心 14000rpm/10min,吸取上清到一新的1.5ml的离心管中,加入40ul4MNH4Oac和300ul95%的乙醇离心14000rpm/20min倒去上清,向离心管中加入500ul的乙醇, 离心 14000rpm/10min 倒去上清,放置10min,使剩余的乙醇挥发调,溶解于50ul双蒸水中。
3.3cDNA质量检测根据目的基因Ccl1(GI:1694628)的cDNA序列设计特异性引物(CF:5′-…………………-3′ CR:5′-…………………….-3′),目标片段大小为nbp。
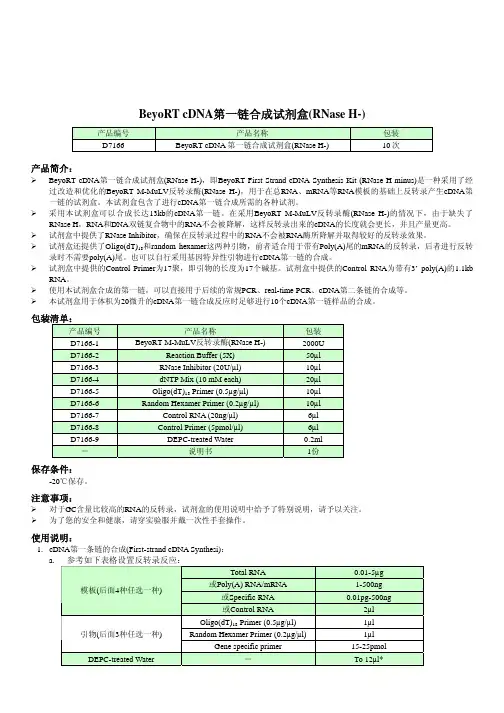
BeyoRT cDNA第一链合成试剂盒(RNase H-)产品编号产品名称包装cDNA第一链合成试剂盒(RNase H-) 10次D7166 BeyoRT产品简介:¾BeyoRT cDNA第一链合成试剂盒(RNase H-),即BeyoRT First Strand cDNA Synthesis Kit (RNase H minus)是一种采用了经过改造和优化的BeyoRT M-MuLV反转录酶(RNase H-),用于在总RNA、mRNA等RNA模板的基础上反转录产生cDNA第一链的试剂盒。
本试剂盒包含了进行cDNA第一链合成所需的各种试剂。
¾采用本试剂盒可以合成长达13kb的cDNA第一链。
在采用BeyoRT M-MuLV反转录酶(RNase H-)的情况下,由于缺失了RNase H,RNA和DNA双链复合物中的RNA不会被降解,这样反转录出来的cDNA的长度就会更长,并且产量更高。
¾试剂盒中提供了RNase Inhibitor,确保在反转录过程中的RNA不会被RNA酶所降解并取得较好的反转录效果。
¾试剂盒还提供了Oligo(dT)18和random hexamer这两种引物,前者适合用于带有Poly(A)尾的mRNA的反转录,后者进行反转录时不需要poly(A)尾。
也可以自行采用基因特异性引物进行cDNA第一链的合成。
¾试剂盒中提供的Control Primer为17聚,即引物的长度为17个碱基。
试剂盒中提供的Control RNA为带有3’ poly(A)的1.1kb RNA。
¾使用本试剂盒合成的第一链,可以直接用于后续的常规PCR、real-time PCR、cDNA第二条链的合成等。
¾本试剂盒用于体积为20微升的cDNA第一链合成反应时足够进行10个cDNA第一链样品的合成。
包装清单:产品编号产品名称包装D7166-1 BeyoRT M-MuLV反转录酶(RNase H-) 2000UD7166-2 Reaction Buffer (5X) 50µlD7166-3 RNase Inhibitor (20U/µl) 10µlD7166-4 dNTP Mix (10 mM each) 20µlD7166-5 Oligo(dT)18 Primer (0.5µg/µl) 10µlD7166-6 Random Hexamer Primer (0.2µg/µl) 10µlD7166-7 Control RNA (20ng/µl) 6µlD7166-8 Control Primer (5pmol/µl) 6µlD7166-9 DEPC-treated Water 0.2ml-说明书1份保存条件:-20℃保存。

cdna第二条链的合成方法一、引言。
cDNA第二条链的合成可是分子生物学研究中的一个重要环节呢。
这就像是搭建一座大厦,第一条链是基础,第二条链则是让这个大厦更加稳固完整的关键部分。
1.1 重要性。
如果把cDNA比作是生命密码的一种特殊记录形式,那第二条链的合成就是让这个记录完整呈现的必要步骤。
没有它,我们对基因表达等众多研究就像是看一本缺页的书,总是不完整的。
二、合成方法。
2.1 自身引导法。
这是一种比较经典的方法。
首先呢,第一条cDNA链合成之后,它会形成一个特殊的发夹结构。
这个发夹结构就像是一个小挂钩,为第二条链的合成提供了一个起始的“把手”。
然后呢,在DNA聚合酶的作用下,就像建筑工人按照图纸施工一样,以第一条链为模板开始合成第二条链。
不过呢,这个方法也有点小麻烦,就像走一条有点崎岖的路,它的效率有时候不是很高,而且后续还得把那个发夹结构去掉,就像解开一个小疙瘩一样。
2.2 置换合成法。
这个方法就有点巧妙啦。
它是利用RNA酶H来对杂交分子中的RNA进行切割,就像一把小剪刀,把RNA剪成一段一段的。
然后呢,这些被剪开的RNA片段就可以作为引物,在DNA聚合酶的作用下合成第二条链。
这就好比是给了DNA聚合酶一些小路标,告诉它从哪里开始合成。
这种方法相对自身引导法来说,就像是开了一条捷径,效率会更高一些。
2.3 引物衔接头法。
这是一种比较现代、比较灵活的方法。
我们先把特定的引物或者衔接头连接到第一条cDNA链上,就像给它戴上了一个特殊的帽子或者挂上了一个特殊的牌子。
然后呢,再利用这个引物或者衔接头来启动第二条链的合成。
这个方法就像是给了我们一把万能钥匙,可以根据不同的研究需求来设计引物或者衔接头,灵活性很强。
不过呢,这也需要我们更加小心谨慎,就像走钢丝一样,因为引物或者衔接头的设计要是出了问题,那整个合成可就乱套了。
三、总结。
3.1 各方法的选择。
在实际的研究中,选择哪种方法就像是在菜市场买菜一样,得根据自己的需求和实际情况来决定。

cDNA 第二链的合成
即将上一步形成的mRNA-cDNA 杂合双链变成互补双链cDNA 的过程。
cDNA 第二链合成的方法有四种,自身引导合成法,置换合成法,引导合成法和引物-衔接头合成法。
1.自身引导法:
首先用氢氧化钠消化杂合双链中的mRNA 链,解离的第一链cDNA 的3'-末端就会形成一个发夹环(发夹环的产生是第一链cDNA 合成时的特性,原因至今未知,据推测可能是由帽子的特殊结构相关),并引导DNA 聚合酶复制出第二链,此时形成的双链之间是连接在一起的,再利用S1 核酸酶将连接处(仅该位点处为单链结构)切断形成平端结构可以进行连接。
2.置换合成法:
它是由一组酶共同控制,包括RNA 酶H 、大肠杆菌DNA 聚合酶Ⅰ和DNA 连接酶。
mRNA-cDNA 杂合双链中的mRNA 链在RNA 酶H 作用下先形成很多切口,mRNA 链就被切割成很多的小片段,这些小片段为大肠杆菌DNA 聚合酶Ⅰ提供了合成第二链的引物。
大肠杆菌DNA 聚合酶Ⅰ以第一链cDNA 为模板合成一段段互补的cDNA 片段。
这些cDNA 片段进而在DNA 连接酶的作用下连接成一条链,即cDNA 的第二链。
遗留在5'-末端的一段很小的mRNA 也被大肠杆菌DNA 聚合酶Ⅰ的5'--3' 核酸外切酶和RNA 酶H 降解,暴露出与第一链cDNA 对应的3'-端部分序列。
同时,大肠杆菌DNA 聚合酶Ⅰ的3'--5' 核酸外切酶的活性可将暴露出的第一链cDNA 的3'-端部分消化掉,形成平端或差不多的平端。
这种方法合成的cDNA 在5'-端存在几个核苷酸缺失,但一般不影响编码区的完整。


实验四cDNA的合成1.目的与要求:掌握cDNA的合成方法。
2.实验原理cDNA的合成是进行逆转录-聚合酶链反应(RT-PCR)的基础。
RT-PCR的原理是利用组织或细胞中的总RNA, 以其中的mRNA作为模板, 采用Oligo (dT)或随机引物, 利用逆转录酶反转录成cDNA。
再以cDNA为模板进行PCR扩增,从而获得目的基因或检测基因表达。
该技术主要用于分析基因的转录产物、获取目的基因、合成cDNA探针、构建RNA高效转录系统。
对于cDNA第一链的合成, 目前试剂公司有多种cDNA第一链的试剂盒出售, 其基本原理相同, 但操作步骤不一。
3. 仪器设备:高压灭菌锅、烘箱、恒温水箱、制冰机、蜗旋震荡器、台式微量离心机、移液枪等。
4. 实验材料:1.5ml、2ml、200ul离心管、一次性枪头等。
5. 试剂:5.1 TIANScript M-MLV。
5.2 Frist-Strand buffer(含有DTT)。
5.3 RNasin。
5.4 2.5mmol/L dNTP Mix。
5.5 0.1mol/L DTT。
5.6 RNase-free ddH2O。
5.7 Oligo(dT)15。
5.8 RNase H。
6. 实验步骤6.1 在冰浴的0.2ml微量离心管中, 加入总RNA 1∼5μg(实验二)、2μl Oligo(dT)、2ul dNTP,补充适量的DEPC水使总体积达14.5μl,轻轻混匀。
156.2 将混合液置于70 o C水浴中加热5min, 立即将微量离心管插入冰浴中2min。
简短的离心收集反应液后加入以下各组分:4ul 5x Frist-Strand buffer(含有DTT),0.5ul RNasin。
6.3 加1ul(200U)TIANScript M-MLV,轻轻用移液器混匀。
如果用随机引物,请将离心管置25o C温浴10分钟。
6.5 在42 o C孵育50min。
6.6 置95 o C加热5min 终止反应。
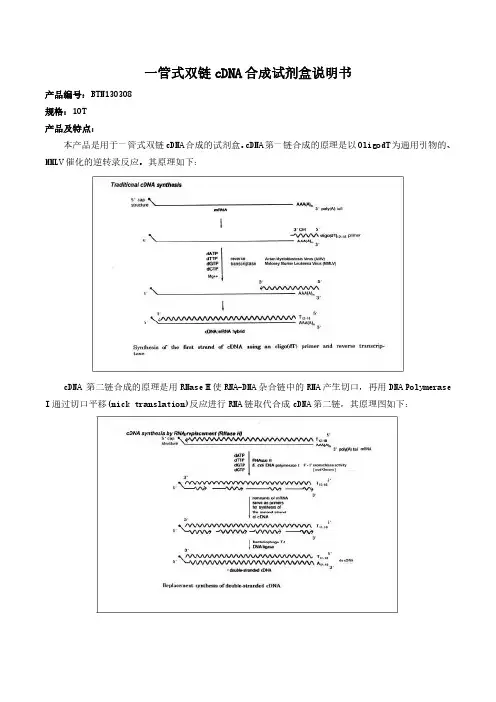
一管式双链cDNA合成试剂盒说明书产品编号:BTN130308规格:10T产品及特点:本产品是用于一管式双链cDNA合成的试剂盒。
cDNA第一链合成的原理是以OligodT为通用引物的、MMLV催化的逆转录反应。
其原理如下:cDNA第二链合成的原理是用RNase H使RNA-DNA杂合链中的RNA产生切口,再用DNA Polymerase I通过切口平移(nick translation)反应进行RNA链取代合成cDNA第二链,其原理图如下:本产品具有下列特点:1.即开即用,含有合成两条cDNA链的所有试剂。
2.适用于含poly rA的RNA,对不含poly rA的RNA(如细菌RNA),不能使用本试剂盒制备ds cDNA。
3.一管式进行,第一链cDNA合成后不需要任何处理,直接进入第二链的合成。
4.所得双链cDNA可以直接用于后续的常规PCR、real-time PCR、cDNA文库构建、抑制性差减杂交等。
5.本试剂盒足够10次80μL体系的双链cDNA合成反应。
6.如果需要合成全长cDNA,最好选用SMART全长cDNA双链合成试剂盒。
规格及成分:成分规格Oligo dT引物10μlcDNA第一链合成缓冲液40μlMMLV逆转录酶(200U/μL)10μl5×cDNA第二链合成缓冲液160μl20×cDNA第二链合成酶混合液40μlT4DNA聚合酶20μl0.2M EDTA溶液40μl超纯水1ml说明书1份保存条件:低温运输,-20℃保存,有效期一年。
自备试剂:mRNA提取试剂盒使用方法:一:mRNA的制备本试剂盒不提供mRNA提取试剂,用户需自备相关试剂。
二:双链cDNA的合成1.在一个干净的塑料离心管中,按下表设置cDNA合成反应:成分用量自备mRNA样品4μL(0.5-2μg)Oligo dT引物1μL70℃2分钟后室温放置2分钟,短暂离心cDNA第一链合成缓冲液4μLMMLV逆转录酶1μL轻柔吹打混匀后42℃保温90分钟合成第一链cDNA超纯水48μLcDNA第二链合成缓冲液16μLcDNA第二链合成酶混合液4μL轻柔吹打混匀后,短暂离心,16℃保温2小时自备的T4DNA聚合酶2μL轻柔吹打混匀后,16℃继续保温30分钟0.2M EDTA溶液4μL注:如果不需要将双链cDNA平末端化,则可以跳过T4DNA聚合酶处理步骤。
cDNA合成技术Promega公司的RibocloneR M-MLV(H- ) cDNA合成系统采用M-MLV反转录酶的R Nase H缺失突变株取代AMV反转录酶,使合成的cDNA更长。
该系统的第一链合成使用M-MLV反转录酶,cDNA第二链合成采用置换合成法,采用RNaseH和DNA聚合酶Ⅰ进行置换合成,最后用T4 DNA聚合酶切去单链末端,方法简便易行。
该系统试剂包括:20μg 特异性引物200μl M-MLV第一链缓冲液(5×),配方如下: 250mmol/L Tris·Cl pH8.3(37℃时); 375mm ol/l KCl; 15mmol/L MgCl2; 50mmol/L DTT; 10mmol/L dATP,dCTP,dGTP,dT TP混合物(各2.5mmol/L)2×625μ rRNasinR RNA酶抑制剂10,000μ M-MLV反转录酶,RNase H-5μg 对照RNA400μl M-MLV第二链缓冲液(10×),配方如下:400mmol/L Tris·Cl ,pH7.2; 850mmol/L KCl; 44mmol/L MgCl2;30mmol/L DTT; 0.5mg/ml BSA。
500μ RNase H500μ DNA聚合酶Ⅰ100μ T4 DNA聚合酶Ⅰ2×1.25ml 不含核酸酶的水以上所有试剂除对照RNA需在-70℃保存外,其余均可保存于-20℃,可以合成40μg mRN A。
(一)第一链合成1. 试剂[α-32 P] dCTP (>400Ci/mmol),EDTA(50mM和200mM),TE-饱和酚:氯仿(1:1),7. 5M NH4Ac,乙醇(100%和70%),TE缓冲液。
2. 操作步骤(1) 取一灭菌的无RNA酶的eppendorf管,加入RNA模板和适当引物,每μg RNA使用0. 5μg引物(如使用NotⅠ引物接头,使用0.3μg),用H2 O调整体积至15μl,70℃处理5分钟,冷却至室温,离心使溶液集中在管底,再依次加入。
cDNA文库组标准流程一. Total RNA的提取 (2)二. mRNA的分离 (5)三.cDNA双链合成 (8)四.载体制备 (11)五. cDNA双链和载体的连接 (13)六.电转化流程 (14)七.快速鉴定、菌落PCR (16)八.pBlueScript cDNA库扩增 (18)一.Total RNA的提取1.试剂配制准备工作:1、研钵、5ml/10ml/ 25ml移液管、100ml/250ml量筒、250ml/100ml容量瓶、药匙、试剂瓶等玻璃制品均用锡纸包裹口部,置于烤箱内,180℃,烤6小时。
2、50ml/1.5ml离心管、枪头等塑料制品用0.1‰DEPC水浸泡过夜后,121℃20mins 高压灭菌。
3、电泳槽及电泳托、梳子用3%双氧水处理。
4、常用试剂及其配方:▲DEPC水:在1000ml去离子水中加入100ul DEPC, 静置过夜后高压灭菌。
▲0.78M柠檬酸纳:PH=4~5三水合柠檬酸纳22.94g加DEPC水定容至100ml,室温放置备用。
▲10%肌氨酸钠:肌氨酸钠10g加DEPC水定容至100ml,室温放置备用。
▲变性裂解液:0.78M柠檬酸钠8.25ml10%肌氨酸钠12.375ml异硫氰酸胍118.05g加DEPC水定容至250ml,室温放置备用临用前加β-巯基乙醇使其终浓度为1%(v/v)▲2M 醋酸钠PH=4.5NaAc·3H2O 13.6g加DEPC水定容至50ml,高压灭菌,室温放置备用▲3M醋酸钠PH=5NaAc·3H2O 20.4g加DEPC水定容至50ml,高压灭菌,室温放置备用▲4M LiCL:LiCL 24.164g加DEPC水定容至100ml,高压灭菌,室温放置备用▲0.5M EDTA PH=8.0EDTA 18.61g用NaOH调PH值至8.0,定容到100ml,高压灭菌,室温放置备用▲10X MOPS (3-(N-吗啉代)丙磺酸):MOPS 41.86gNaAC·3H2O 4.10g0.5MEDTA(PH 8.0)20ml用NaOH调PH值 6.5 , DEPC水定容到1L,室温避光放置备用。
双链cdna合成过程引言:双链cdna合成是一种常用的分子生物学技术,用于将RNA转录本转化为双链DNA分子。
该技术广泛应用于基因克隆、基因表达调控等研究领域。
本文将详细介绍双链cdna合成的过程及相关注意事项。
一、材料准备:1. RNA模板:可以是从细胞中提取的总RNA、mRNA或特定RNA片段。
2. 反转录酶:选择逆转录酶根据需要合成的DNA类型,如M-MLV逆转录酶用于合成全长cdna,AMV逆转录酶用于合成短片段cdna。
3. 引物:选择适当的引物,如随机引物、寡聚dT引物或特定引物,根据实验需要选择。
4. dNTPs:包括dATP、dCTP、dGTP和dTTP。
5. 缓冲液:适当的逆转录缓冲液,提供逆转录反应所需的正确离子浓度和pH值。
6. 辅助酶:如RNase抑制剂,用于防止RNA的降解。
二、双链cdna合成步骤:1. 反转录反应:a. 将RNA模板与适当浓度的引物混合,加入逆转录缓冲液、dNTPs和逆转录酶。
b. 将反应混合物加入逆转录仪中,根据反转录酶的最佳温度进行反应,通常在42-55摄氏度下进行。
c. 反转录反应时间根据RNA模板的长度而定,一般为30分钟至2小时。
d. 完成反转录反应后,加热杀死逆转录酶,一般在70-75摄氏度下反应10分钟。
2. 二次反应:a. 在反转录反应体系中加入适量的dNTPs、DNA聚合酶和引物,形成二次反应混合物。
b. 进行PCR扩增,用于合成双链cdna,反应条件根据引物和DNA聚合酶的要求进行调节。
三、注意事项:1. RNA模板的质量对反转录反应和cdna合成的效果有重要影响,应选择高质量的RNA样本。
2. 引物的选择要根据实验需求确定,确保能够特异性地合成目标cdna。
3. 在反转录和PCR反应过程中,应避免RNA的降解,可以添加RNase抑制剂。
4. 反转录反应的温度和时间要根据反转录酶的要求进行优化,以获得最佳的反应效果。
5. PCR反应条件的设置要根据引物和DNA聚合酶的要求进行调整,以确保扩增产物的特异性和产量。
cDNA合成1. cDNA第一链的合成1.1 取一个0.2 ml 薄壁管,于冰浴上加入:混匀,短暂离心收集液滴至管底。
1.2 72°C温育2分钟后,冰浴2分钟并短暂离心收集液滴至管底。
1.3 在管中冰浴按下列顺序加入:混合后离心5 秒钟,置冰上备用。
1.4 GeneAmp 2400 PCR仪上42°C温育1小时。
注:若使用水浴进行温育,应在反应混合物上覆盖一滴石蜡油以防止水分蒸发。
1.5 取出管子置于冰浴上中止反应。
若不进行下一步,则将产物冻存于-20°C。
2. LD PCR扩增cDNA双链2.1于冰浴上在0.2ml薄壁管中加入:混匀后,短暂离心收集液滴至管底。
根据表1的数据确定PCR循环数。
2.2 GeneAmp 2400 PCR仪上进行PCR反应,参数为:· 95°C 1min· 22次循环:95°C 15sec68°C 5min3. 双链cDNA补平反应3.1 每50μl扩增好的双链cDNA加2μl浓度为20μg/μl的蛋白酶K,混匀后45°C温育1小时,短暂离心后置于90°C,10分钟以灭活蛋白酶K。
3.2 将离心管冰浴2分钟,加入3μl(15 units)T4 DNA聚合酶,16°C反应30分钟。
3.3 72°C,10分钟灭活酶,加入27.5μl,4 mol/L醋酸铵,再加入210 μl 95%的乙醇,颠倒管子数次混匀溶液。
3.4 立即于室温,14,000 rpm条件下离心20分钟(离心前不要将管子置于冰浴,否则会有杂质的共沉淀)。
小心弃上清,用80%乙醇洗涤沉淀一次。
3.5 室温干燥沉淀,用19μl水重溶。
4. 接头与cDNA的连接4.1 在3中第5步得到的重悬液中加入:混匀后,短暂离心收集液滴至管底。
16°C连接过夜。
4.2 加入3μl,0.2mol/L EDTA中止反应。
1. Superscipt II―RT合成第一链:1. 在一RNase-free的0.2ml PCR管中,加入xul mRNA(大约500ng)1ul Xho I Primer(1.4ug/ul)(5’GAGAGAGAGAGAGAGAGAGAACTAGT CTCGAG TTTTTTTTTTTTTTTTTT…3’)11-x ul RNase-free water(大于500ng mRNA 分n管(500ng/tube)合成第一链, 第一链合成完毕后将n管合成一管进行第二链合成.)2. 混匀后,70℃反应10分钟;3. 反应完成后,立刻将反应体系置于冰上5min;4. 稍微离心一下,顺序加入以下试剂:4ul 5×first strand buffer2ul 0.1M DTT1ul 10mM dNTP(自己配制)5. 混匀,稍微离心反应物之后,42℃放置2分钟;6. 反应完成,趁热加入1 ul S uperscipt II―RT,混匀;7. 42℃反应50分钟,然后70℃,15分钟灭活反转录酶.2. cDNA第二链的合成 :1. 第一链反应完成后,取2ul一链产物-20℃冰箱中保存,待电泳检测。
其余的产物合并,混匀,然后顺序加入下列试剂(promega):20ul 10×DNA Polymerase I buffer6ul 10mM dNTP(自己配制)xul dd H2 O1ul RNase H(2U/ul)10ul DNA Polymerase I(10U/ul)总体系为200ul;2. 混匀后,16℃反应2.5小时;3. 70℃灭活10分钟;4. 反应完成后,得到200ul cDNA第二链反应体系,将此体系置于冰上;5.取2ul二链产物,同保存的一链产物一起电泳鉴定。
同时上1kb ladder,确定双链的大小范围。
注:一链,二链的电泳图是smear,且二链稍比一链大一些。
3. 双链cDNA末端补平 :1. 在第二链反应体系中,顺序加入下列试剂(promega):6ul 10mM dNTP2ul T4 DNA Polymerase(8.7U/ul)2ul BSA(10mg/ml)2. 稍微离心混匀反应物, 37℃反应至少30分钟,然后75℃灭活10分钟;3. 加入等体积酚/氯仿/异戊醇,剧烈振荡后,常温下13000g离心5分钟;4. 离心后,吸取上清于另一1.5ml eppendof管中,加入等体积氯仿,上下颠倒几次混匀后,常温下13000g离心5分钟;5. 吸取上清至另一eppendof管,加入1/10V3M NaAc(PH5.2)和2.5V预冷的无水乙醇,混匀,-20℃放置过夜以沉淀双链cDNA;6. 第二日,将昨日沉淀物在4℃,13000g离心60分钟以充分沉淀双链cDNA;7.离心完毕,弃上清,加入1ml 70%乙醇洗涤沉淀,常温下13000g离心5分钟;8.离心完毕,弃上清,干燥沉淀至无乙醇气味.注:第3,第4步可以用PCR 纯化试剂盒代替。
常用于合成cdna第二链的酶摘要:1.概述2.合成cDNA 第二链的酶的作用3.常用酶的种类4.酶的应用实例5.结论正文:1.概述在分子生物学研究中,合成cDNA(互补DNA)技术被广泛应用于基因表达分析、基因克隆和基因组学研究等领域。
合成cDNA 的过程需要通过反转录酶(Reverse Transcriptase, RT)将RNA 模板转化为cDNA 第一链,然后通过酶催化合成cDNA 第二链。
本文将介绍常用于合成cDNA 第二链的酶。
2.合成cDNA 第二链的酶的作用合成cDNA 第二链的酶通常是DNA 聚合酶(DNA Polymerase, DNA-pol),其作用是在已生成的cDNA 第一链的指导下,催化dNTPs(去氧核苷酸三磷酸盐)的聚合,合成互补的cDNA 第二链。
3.常用酶的种类常用的合成cDNA 第二链的酶有以下几种:(1) Titanium Taq DNA 聚合酶:来源于Thermus aquaticus,具有较高的热稳定性和扩增效率,适用于常规的PCR 反应。
(2) Fast Advanced Master PCR 酶:来源于Thermus thermophilus,扩增效率较高,适用于快速扩增cDNA。
(3) Platinum Taq DNA 聚合酶:来源于Thermus aquaticus,具有较高的扩增效率和稳定性,适用于对扩增效果有较高要求的实验。
4.酶的应用实例以Titanium Taq DNA 聚合酶为例,其应用步骤如下:(1) 准备反应体系:包括模板RNA、引物、dNTPs、缓冲液和Titanium Taq DNA 聚合酶。
(2) 反转录:将RNA 模板与引物混合,加入缓冲液和Titanium Taq DNA 聚合酶,进行反转录反应,生成cDNA 第一链。
(3) 合成cDNA 第二链:将反转录后的产物进行PCR 扩增,合成cDNA 第二链。
(4) 纯化cDNA:对合成的cDNA 进行纯化,获得所需的目标cDNA 片段。
cDNA第二链合成试剂盒
产品简介:
cDNA第二链合成试剂盒,Second Strand cDNA Synthesis Kit是一种在合成了cDNA第一链的基础上去除RNA-DNA杂合链中的RNA链并合成cDNA第二链,最终形成双链cDNA的试剂盒。
本试剂盒包含了进行cDNA第二链合成所需的各种试剂。
本试剂盒采用RNase H使RNA-DNA杂合链中的RNA产生切口,此时DNA Polymerase I可以通过切口平移(nick translation)反应催化形成cDNA第二链。
使用本试剂盒合成的双链cDNA,可以直接用于后续的常规PCR、real-time PCR、cDNA文库的构建等。
本试剂盒用于体积为20微升的cDNA第一链合成反应的后续反应时,足够进行20个cDNA第二链样品的合成。
保存条件:
-20℃保存。
注意事项:
进行第二链合成时,dNTP比较适当的最终浓度约为0.2mM。
如果最终浓度过低,在反应体系中需要适当补充dNTP。
如果希望获得平末端的双链cDNA,可以用T4 DNA Polymerase (D7051)或DNA末端平滑试剂盒 (D7012)处理。
酶使用时宜存放在冰盒内或冰浴上,使用完毕后宜立即放置于-20℃保存。
本产品仅限于专业人员的科学研究用,不得用于临床诊断或治疗,不得用于食品或药品,不得存放于普通住宅内。
为了您的安全和健康,请穿实验服并戴一次性手套操作。
使用说明:
1.用反转录酶,例如BeyoRT TM II M-MLV反转录酶(RNase H-) (D7160/D7161/D7162)或BeyoRT TM II cDNA第一链合成试剂盒
(RNase H-) (D7167/D7168)合成cDNA第一条链,70℃孵育10分钟终止反应。
2.
3.按上述体系配好之后,轻轻混匀(可以用移液器吹打混匀或用 V ortex在最低速度轻轻混匀),随后离心沉淀液体。
4.15℃孵育2小时。
(注意:反应温度不能超过15℃)
5.加入5μl 0.5M EDTA(pH8.0)混匀,以终止反应。
6.后续可以使用酚氯仿抽提、乙醇沉淀等方法纯化合成的双链cDNA,也可以使用适当的DNA纯化试剂盒进行纯化。
DNA纯
化试剂盒(D0033)可以向碧云天订购。
使用本产品的文献:
1. Yu K, Zhang T.
Metagenomic and metatranscriptomic analysis of microbial community structure and geneexpression of activated sludge.
PLoS One. 2012;7(5):e38183.
2. Ren H, Zhu F, Zheng C, Sun X, Wang W, Shu H.
Transcriptome analysis reveals genes related to floral development in chrysanthemum responsive tophotoperiods.
Biochem Genet. 2013 Feb;51(1-2):20-32. doi: 10.1007/s10528-012-9541-1. Epub 2012 Sep 30.
3. Cai L, Yu K, Yang Y, Chen BW, Li XD, Zhang T.
Metagenomic exploration reveals high levels of microbial arsenic metabolism genes in activated sludge andcoastal sediments.
Appl Microbiol Biotechnol. 2013 Jan 23. [Epub ahead of print].
Version 2016.03.19。