硫和氮的氧化物 -PPT课件
- 格式:ppt
- 大小:2.09 MB
- 文档页数:41


高一化学必修1第四章第三节硫和氮的氧化物〔第1课时 二氧化硫和三氧化硫〕编写人: 谢肇明审核人:许丰娟高一_____班第____组编号_____姓名_________小组评价______教师评价_______ 【学习目标】1、了解单质硫和二氧化硫的物理性质;了解可逆反响的概念。
2、掌握二氧化硫的主要化学性质;了解三氧化硫的化学性质。
【学习重点】二氧化硫的主要化学性质。
【使用说明】本学案需1课时完成。
课前请阅读教材89-91页并完成【预习自学】一、单质硫: 1、硫〔俗称〕:色固体〔晶体〕, 溶于水, 溶于酒精,溶于二硫化碳〔CS 2〕。
硫在自然界以态和态存在。
2、硫的原子构造,硫是比拟活泼的非金属单质,常见化合价为,你能说出其代表物吗?。
硫在反响中即表现氧化性又表现复原性。
3、硫的化学性质:〔1〕氧化性 S+Fe =FeS 2Cu+S =Cu 2S 结合氯气与铁、铜的反响比拟氯和硫的氧化性〔2〕复原性;S+O 2====二、二氧化硫和三氧化硫 1、二氧化硫 〔1〕物理性质SO 2是色、有的有气体,容易,易于水〔1体积水可溶解40体积〕。
密度比空气,收集SO 2用方法。
〔2〕二氧化硫的化学性质:写出以下反响的化学方程式。
SO 2 与 H 2O 的反响 (酸性氧化物)SO 2 与 O 2 的反响SO 2 与 NaOH 的反响(酸性氧化物) 2、三氧化硫〔1〕物理性质:标准状况下.....为无色、易挥发的晶体..℃℃。
〔2〕化学性质:属于酸性氧化物 SO 3 + H 2O ——SO 3 + CaO ——SO 3 + C a (O H )2 ——3、二氧化硫的主要来源; 含还硫物质的燃烧在煤、石油和某些金属矿物中含硫或硫的化合物在燃烧或冶炼时,会生成SO 2,这是大气中SO 2的主要来源[思考]怎样闻SO 2气体?[合作探究]〖实验探究1〗完成课本P90“实验4-7〞,思考交流课本P91“学与问〞。

第三节硫和氮的氧化物第1课时二氧化硫和三氧化硫1.硫在自然界的存在硫广泛存在于自然界:(1)游离态:火山喷口附近或地壳的岩石中.火山喷出物中含H2S、SO2和SO3等。
错误!2.硫单质的性质(1)物理性质①色态:黄色晶体,质脆。
②溶解性:不溶于水,微溶于酒精,易溶于二硫化碳.(2)化学性质:H2错误!、Fe错误!错误!错误!错误!错误!O2、错误!O错误!①氧化性。
a.与金属反应:硫在一定条件下可与大多数金属反应生成相应的硫化物,当与变价金属反应时一般生成低价态金属硫化物。
如与Na、Fe、Cu反应为2Na+S=====,△Na2S,S+Fe错误!FeS,S+2Cu错误!Cu2S。
b.硫蒸气与H2反应:化学方程式为S+H2错误!H2S.②还原性:硫在空气中燃烧,产生淡蓝色火焰,在纯氧气中燃烧,产生蓝紫色火焰,燃烧产物为SO2,化学方程式为S+O2错误!SO2.③硫与碱反应:硫与热碱液反应生成金属硫化物和亚硫酸盐.如3S+6NaOH 错误!2Na2S+Na2SO3+3H2O。
3.二氧化硫(1)物理性质。
颜色状态气味密度溶解性毒性无色气体刺激性气体比空气大易溶于水有毒(2)化学性质。
有关反应方程式或反应现象:①漂白性a.作用原理:能与某些有色物质反应生成不稳定的无色物质,这种无色物质加热容易分解而使有色物质恢复原来的颜色。
食用用二氧化硫增白的食品对人的肝、肾脏有严重损害,并有致癌的作用。
b.SO2和氯水漂白性比较②与O2反应:2SO2+O2错误!2SO3。
③与H2O反应:SO2+H2O H2SO3。
④与NaOH反应:SO2+2NaOH===Na2SO3+H2O。
(3)SO2的用途①漂白纸浆、毛、丝、草帽辫等;②用于杀菌消毒。
4.三氧化硫三氧化硫具有酸性氧化物的性质,主要表现如下:(1)与H2O反应:SO3+H2O===H2SO4。
(2)与碱性氧化物(CaO)反应:SO3+CaO===CaSO4。
(3)与碱Ca(OH)2]反应:SO3+Ca(OH)2===CaSO4+H2O。
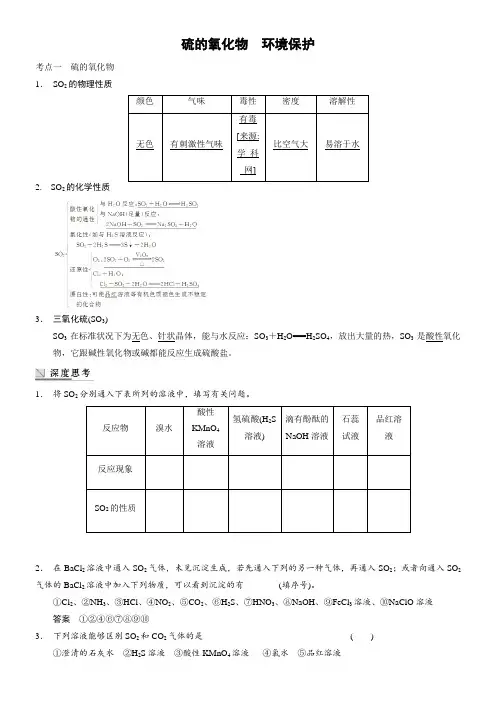
硫的氧化物 环境保护考点一 硫的氧化物 1. SO 2的物理性质颜色气味毒性 密度溶解性无色有刺激性气味有毒[来源:学_科_网]比空气大易溶于水2. SO 2的化学性质3. 三氧化硫(SO 3)SO 3在标准状况下为无色、针状晶体,能与水反应:SO 3+H 2O===H 2SO 4,放出大量的热,SO 3是酸性氧化物,它跟碱性氧化物或碱都能反应生成硫酸盐。
1. 将SO 2分别通入下表所列的溶液中,填写有关问题。
反应物溴水酸性KMnO 4溶液氢硫酸(H 2S 溶液)滴有酚酞的NaOH 溶液石蕊试液品红溶液反应现象SO 2的性质2. 在BaCl 2溶液中通入SO 2气体,未见沉淀生成,若先通入下列的另一种气体,再通入SO 2;或者向通入SO 2气体的BaCl 2溶液中加入下列物质,可以看到沉淀的有________(填序号)。
①Cl 2、②NH 3、③HCl 、④NO 2、⑤CO 2、⑥H 2S 、⑦HNO 3、⑧NaOH 、⑨FeCl 3溶液、⑩NaClO 溶液 答案 ①②④⑥⑦⑧⑨⑩3.下列溶液能够区别SO2和CO2气体的是()①澄清的石灰水②H2S溶液③酸性KMnO4溶液④氯水⑤品红溶液A.①②③B.②③④C.除①以外D.全部4. 下图是检验某无色气体A是SO2和CO2的混合气体的装置图,按要求回答下列问题。
(1)B中加入的试剂是__________,作用是________________________________________________________________________。
(2)C中加入的试剂是__________,作用是________________________________________________________________________。
(3)D中加入的试剂是__________,作用是________________________________________________________________________。

第一章二氧化硫和氮氧化物控制政策和法规标准我国的s02和NO。
的排放量高居世界各国前列,由此带来的大气污染和酸雨问题十分严重,经济损失巨大,已成为制约我国经济社会可持续发展的主要因素,因此,控制S02和NO。
污染已势在必行。
我国政府十分重视SOz和NO。
的污染问题,制定了许多相关的控制政策、法规及标准。
本章主要从我国SO?和NO。
的排放特征人手,阐述了我国控制802和NO.的政策、法规及标准。
第一节我国二氧化硫和氮氧化物的排放特征一、二氧化硫和氮氧化物的特征和危害(一)二氧化硫的特征和危害S02是目前大气污染物中含量较大、影响面较广的一种气态污染物。
大气中s02的来源很广,几乎所有的工业企业都可能产生。
它主要来自化石燃料(煤炭,石油和天然气)的燃烧过程,以及硫化物矿石的焙烧、冶炼等过程,火力发屯厂、有色金属冶炼厂、硫酸厂、炼油厂以及燃煤燃油的工业锅炉、炉窑等都排放SOz烟气。
在排放sO:的各种过程中,约90%来自燃料燃烧过程,具中火电厂排放量最大。
sO2为无色,有强烈刺激气味气体,对人体呼吸器官有很强的毒害作用,还可通过皮肤经毛孔侵入人体或通过食物和饮水经消化道进人人体而造成危害。
空气中S02的浓度只有lXlo”时,人就会感到胸部有一种被压迫的不适感;当浓度达到8X10—’时,人就会感到呼吸困难;当浓度达到10XlO6时,咽喉纤毛就会排出黏液。
人体主要经呼吸道吸收大气中的sO:,引起不同程度的呼吸道及眼黏膜的刺激症状。
急性中毒者表现出眼结膜和呼吸道黏膜强烈刺激症状,如流泪,畏光,鼻、咽、喉烧灼感及疼痛,咳嗽,胸闷,胸骨后疼痛,心悸,气短,恶心,呕吐等。
长期接触低浓度SO:可引起慢性损害,以慢性鼻炎、咽炎、气管炎、支气管炎、肺气肿、肺间质纤维化等病理改变为常见。
轻度中毒者可有眼灼痛、畏光、流泪、流涕、咳嗽,常为阵发性干咳,鼻、咽、喉部有烧灼样痛,声音嘶哑,甚至有呼吸短促、胸痛、胸闷。
有时还出现消化道症状如恶心、呕吐、上腹痛和消化不良,以及全身症状如头痛、头昏、失眠、全身无力等。
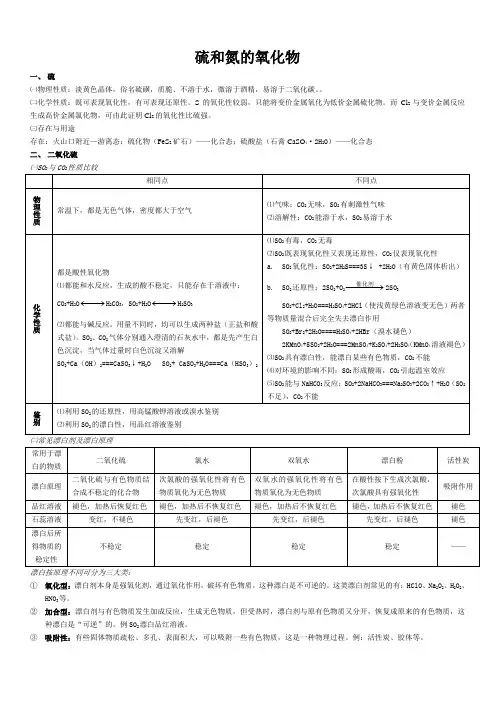
硫和氮的氧化物一、硫㈠物理性质:淡黄色晶体,俗名硫磺,质脆、不溶于水,微溶于酒精,易溶于二氧化碳。
㈡化学性质:既可表现氧化性,有可表现还原性。
S的氧化性较弱,只能将变价金属氧化为低价金属硫化物。
而Cl2与变价金属反应生成高价金属氯化物,可由此证明Cl2的氧化性比硫强。
㈢存在与用途存在:火山口附近—游离态;硫化物(FeS2矿石)——化合态;硫酸盐(石膏CaSO4·2H2O)——化合态二、二氧化硫㈠SO2与CO2性质比较①氧化型:漂白剂本身是强氧化剂,通过氧化作用,破坏有色物质,这种漂白是不可逆的。
这类漂白剂常见的有:HClO、Na2O2、H2O2、HNO3等。
②加合型:漂白剂与有色物质发生加成反应,生成无色物质,但受热时,漂白剂与原有色物质又分开,恢复成原来的有色物质,这种漂白是“可逆”的。
例SO2漂白品红溶液。
③吸附性:有些固体物质疏松、多孔、表面积大,可以吸附一些有色物质,这是一种物理过程。
例:活性炭、胶体等。
㈢SO 2的制法原理:Na 2SO 3+H 2SO 4=== Na 2SO 4+SO 2↑ + H 2O ★注意:①不能用澄清石灰水鉴别CO 2和SO 2。
②CO 2和SO 2通入BaCl 2溶液中均无沉淀产生。
③除去CO 2中的SO 2可选用酸性KMnO 4溶液、溴水、饱和NaHCO 3试剂。
例:检验SO 2气体中是否混有CO 2气体,可采用的方法是( )A.通过品红溶液B.通过澄清石灰水C.先通过NaOH 溶液,再通过澄清石灰水D.先通过酸性KmnO 4溶液,再通过澄清石灰水㈣SO 2的污染1、 二氧化硫的来源① 化石燃料(煤、石油)的燃烧(主要来源) ② 含硫矿石的冶炼③ 硫酸厂、造纸厂等产生的废气 2、 SO 2的危害① 引起人体呼吸道疾病,严重时会使人中毒死亡。
② 形成酸雨:SO 2、O 2、 H 2O 酸雾(H 2SO 4、H 2SO 3).空气中硫的氧化物、氮的氧化物随与水降下,形成酸雨。

SO 2 + H 2O H 2SO 3可逆反应:在相同条件下,既能向正反应方向进行、又能向逆反应方向进行的反应。
SO 2 + 2NaOH = Na 2SO 3 + H 2O【小组讨论】:请你判断以下几组反应有哪些属于可逆反应? A .2H 2+O 2 2H 2O 和2H 2O2H 2↑+O 2↑B 和C .H 2+I 2 2HI 和2HI H 2+I 2D .2Na+Cl 22NaCl 和2NaCl (熔融)2Na+Cl 2↑【思考】根据SO 2中S 的化合价推断它具有怎样的性质?【讲解】:SO 2中S 为+4价,,既可的电子显氧化性,又可失电子显有还原性。
【板书】:(3)SO 2既有还原性又有氧化性①氧化性,SO 2+2H 2S=3S ↓+2H 2O【讲述】:SO 2的还原性应表现在它与氧化剂的反应上,可通过与O 2、KMnO 4(H +)、卤素单质水溶液等氧化剂的反应来证明。
【板书】② SO 2具较强的还原性,可被X 2、O 2、KMnO 4、HNO 3等许多氧化剂氧化:2SO 2+O 22SO 3【讲解】三氧化硫也是一种酸性氧化物,它溶于水生成硫酸,工业上利用这一原理生产硫酸,与碱性氧化物和碱反应生成硫酸盐【板书】2.三氧化硫(酸性氧化物)(1)物理性质: (2)化学性质:SO 3+H 20=H 2SO 4 SO 3+CaO=CaSO 4SO 3+Ca(OH)2=CaSO 4+H 20[阅读]资料卡片:预防硫化氢中毒 Ⅲ、归纳与小结 一、二氧化硫和三氧化硫 1、硫的性质 (1)物理性质:催化剂△(2)化学性质:2、二氧化硫(1)SO2的物理性质:(2)SO2的化学性质①漂白性:②SO2具有酸性氧化物的通性可逆反应:③SO2既有还原性又有氧化性3.三氧化硫(1)物理性质(2)化学性质Ⅳ、课堂检测1、下列变化中,不属于化学变化的是()A、SO2使品红溶液褪色B、氯水使有色布条褪色C、活性炭使红墨水褪色D、漂白粉使某些染料褪色2、能鉴别SO2和CO2的试剂是()A、品红溶液B、澄清石灰水C、紫色石蕊试液D、高锰酸钾溶液3、下列反应中,不说明SO2是酸性氧化物的是()A、B、C、D、4、下列物质中,既具有氧化性又具有还原性的是()A.Cl2B.Na C.H2SO4D.SO2 5、下列关于SO2的说法中,不正确的是()A.SO2是硫及某些含硫化合物在空气中燃烧的产物B.SO2有漂白作用,也有杀菌作用C.SO2溶于水后生成H2SO4D.SO2是一种大气污染物教后反思:第四章非金属及其化合物第三节硫和氮的氧化物(第二课时)。


vocs中的硫氧化物,氮氧化物硫氧化物和氮氧化物是大气中常见的两类污染物,它们对环境和人类健康造成了严重的影响。
本文将分别对硫氧化物和氮氧化物的来源、影响和控制措施进行介绍。
一、硫氧化物硫氧化物主要包括二氧化硫(SO2)和三氧化硫(SO3)。
它们的主要来源是燃煤和燃油的燃烧过程,尤其是工业生产和发电过程中的燃烧排放。
此外,一些工业过程中的化学反应也会释放出硫氧化物。
硫氧化物对环境的主要影响是酸雨的形成。
二氧化硫和氧气在大气中反应生成硫酸,随后与水蒸气结合形成硫酸溶液,降下的雨水中含有硫酸根离子,导致土壤和水体的酸化。
酸雨对植物、土壤和水生生物造成了严重的损害,影响生态平衡。
控制硫氧化物的方法主要包括燃烧技术改进和烟气脱硫技术。
燃烧技术改进可以减少燃烧过程中硫氧化物的生成,例如采用低硫燃料、燃烧过程中加入石灰等。
烟气脱硫技术则是在燃烧过程后对烟气进行处理,将其中的硫氧化物捕集和转化成不易挥发的硫酸盐,从而减少其排放。
二、氮氧化物氮氧化物主要包括一氧化氮(NO)和二氧化氮(NO2),统称为NOx。
它们的主要排放源是汽车尾气、工业废气和燃煤等。
氮氧化物对环境的主要影响是大气污染和臭氧层破坏。
NOx是臭氧的前体物质,大量的氮氧化物排放会导致臭氧层的破坏。
此外,氮氧化物还会与大气中的其他污染物反应生成细颗粒物,对空气质量造成影响,对人体健康产生危害。
控制氮氧化物的方法主要包括燃烧控制和尾气处理技术。
燃烧控制包括优化燃烧过程、减少燃料中的氮含量等,能够减少氮氧化物的生成。
尾气处理技术主要有选择性催化还原(SCR)和选择性非催化还原(SNCR)等,通过在尾气中引入还原剂与氮氧化物反应,将其转化为氮气和水。
总结起来,硫氧化物和氮氧化物是大气污染中的重要组成部分,对环境和人类健康造成了严重的影响。
为了减少其排放,需要采取相应的控制措施,包括燃烧技术改进和烟气处理技术,以减少硫氧化物和氮氧化物的生成和排放。
只有通过全社会的努力,才能减少大气污染,保护我们的环境和健康。

《硫和氮的氧化物》说课稿尊敬的各位评委、老师:大家好!今天我说课的内容是《硫和氮的氧化物》。
下面我将从教材分析、学情分析、教学目标、教学重难点、教法与学法、教学过程、板书设计以及教学反思这几个方面来展开我的说课。
一、教材分析(一)教材的地位和作用《硫和氮的氧化物》是人教版高中化学必修1 第四章第三节的内容。
本节内容是在学生学习了氧化还原反应、非金属单质及其化合物等知识的基础上,进一步介绍硫和氮的氧化物的性质。
这部分知识不仅是对前面所学知识的深化和拓展,也为后续学习硫酸、硝酸等重要的含硫、含氮化合物奠定了基础。
同时,通过对硫和氮的氧化物的学习,还可以让学生了解化学物质在生产生活中的应用以及对环境的影响,培养学生的环保意识和社会责任感。
(二)教材内容本节教材主要包括二氧化硫和二氧化氮的性质、二氧化硫和二氧化氮对大气的污染以及酸雨的形成和防治等内容。
其中,二氧化硫的性质是本节的重点,包括物理性质、化学性质(酸性氧化物的通性、漂白性、还原性等);二氧化氮的性质主要侧重于与水的反应以及氮氧化物对环境的污染。
二、学情分析(一)知识基础学生在初中已经学习了氧气、二氧化碳等非金属氧化物的一些性质,在必修 1 前面的章节中也掌握了氧化还原反应的基本概念和规律,具备了一定的化学知识基础和实验操作能力。
(二)认知能力高中生的思维能力已经从形象思维向抽象思维过渡,但在理解一些抽象的化学概念和原理时,还需要借助实验和直观的感性材料来帮助理解。
(三)学习兴趣学生对化学实验充满兴趣,喜欢通过实验探究来获取知识,但对于一些复杂的化学问题,可能会感到困惑和畏难。
三、教学目标(一)知识与技能目标1、了解二氧化硫和二氧化氮的物理性质和化学性质。
2、掌握二氧化硫的漂白性、还原性以及二氧化氮与水的反应。
3、了解二氧化硫和二氧化氮对大气的污染以及酸雨的形成和防治。
(二)过程与方法目标1、通过实验探究,培养学生的观察能力、分析问题和解决问题的能力。