大学无机化学 第十二章 杂环化合物总结
- 格式:ppt
- 大小:1.74 MB
- 文档页数:43
三员杂环链状醚、硫醚、仲胺比饱和三元杂环的健角小,因此有较大的张力。
三元杂环的构象都是平面形。
氢原子的重叠也是它们产生张力的一个原因。
饱和三元杂环的杂原子都有孤电子对,容易受亲电试剂进攻。
环有偶极矩,亲电试剂和亲核试剂都容易与它们反应。
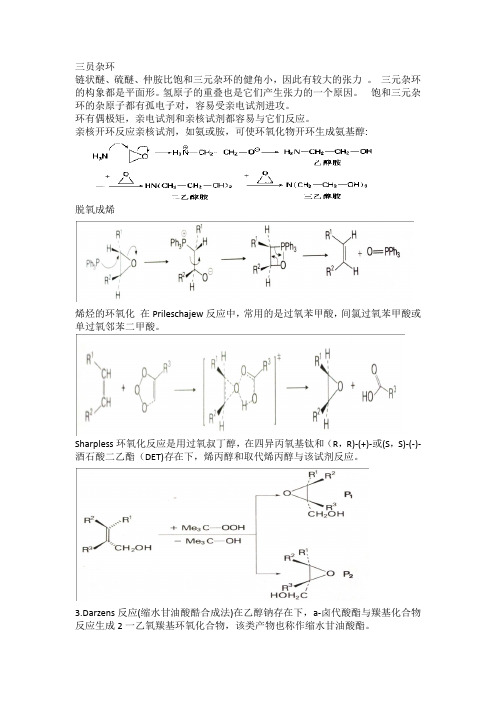
亲核开环反应亲核试剂,如氨或胺,可使环氧化物开环生成氨基醇:脱氧成烯烯烃的环氧化在Prileschajew反应中,常用的是过氧苯甲酸,间氯过氧苯甲酸或单过氧邻苯二甲酸。
Sharpless环氧化反应是用过氧叔丁醇,在四异丙氧基钛和(R,R)-(+)-或(S,S)-(-)-酒石酸二乙酯(DET)存在下,烯丙醇和取代烯丙醇与该试剂反应。
3.Darzens反应(缩水甘油酸酷合成法)在乙醇钠存在下,a-卤代酸酯与羰基化合物反应生成2一乙氧羰基环氧化合物,该类产物也称作缩水甘油酸酯。
Corey合成法该合成方法是由卤化三烷基锍盐或卤化三烷基亚砜盐衍生的S一叶立德与羰基化合物反应四员杂环1.β-氨基酸环化脱水制得【2+2】环加成反应(1)亚胺十烯酮.亲电取代反应呋喃发生亲电取代反应的速度要比苯快。
原因如下:①呋喃的共振能比苯低;②呋喃环上每个原子的电子密度大于1,而苯环上每个原子的 电子密度等于1。
1,4-二羰基化合物(Paal-Knorr反应)在酸碱平衡中,酸加到1,4-二羰基体系13中的一个羰基上,使第2个羰基能与其发生分子内亲核反应形成14;最后,在酸催化下,发生β-消除反应。
.Feist-Benary合成a-卤代羰基化合物和β-酮羧酸酯发生环缩合反应生成3-呋喃酸。
噻吩噻吩的芳香性小于苯大于呋喃,原因:①因为硫和氧相比有较低的电负性,硫上的电子对能更有效地共轭;②硫,作为第二短周期的元素,能够扩展其八隅体。
噻吩的亲电取代反应活性和苯甲醚相近。
反应机制与呋喃相同,取代反应发生在2-位或2,5-位。
光异构化反应最简单的方法是1,4-二碳基化合物硫化后再环化脱水,这和呋喃的Paal-Knorr合成类似。





第十七章杂环化合物基本内容和重点要求⏹杂环化合物的分类和命名;⏹杂环化合物的结构和芳香性;⏹五元杂环化合物的化学性质;⏹六元杂环化合物的化学性质;⏹生物碱重点要求掌握芳香性;五元、六元杂环化合物的化学性质,杂环化合物的亲电取代反应的活性及规律;酸碱性规律。
12.1 杂环化合物的分类和命名1、分类:杂环大体可分为:单杂环和稠杂环两类。
分子中含有由碳原子和其它原子共同组成的环的化合物称为杂环化合物。
杂环中的非碳原子称为杂原子,最常见的杂原子有N、O、S等。
象环醚、内酯、环酐及内酰胺等似乎也应属于杂环化合物。
但是,由于这些环状化合物容易开环形成脂肪族化合物,其性质又与相应的脂肪族化合物类似,因此,一般不放在杂环化合物中讨论。
本章讨论的是环系比较稳定,并且在性质上具有一定芳香性的杂环化合物。
根据环数的多少分为单杂环和多杂环;单杂环又可根据成环原子数的多少分为五元杂环及六元杂环等;多杂环稠杂环、桥杂环及螺杂环,其中以稠杂环较为常见。
稠杂环是由苯环与单杂环或有两个以上单杂环稠并而成。
2、命名(1)用音译法是按外文名称的音译,并加口字旁,表示为环状化合物。
如杂环上有取代基时,取代基的位次从杂原子算起用1,2,3,4,5……(或可将杂原子旁的碳原子依次编为α ,β, γ, δ …)来编号。
如杂环上不止一个杂原子时,则从O,S,N 顺序依次编号,编号时杂原子的位次数字之和应最小:(2)系统命名法:是把杂环看作杂原子转换了相应碳环中的碳原子,命名时以相应的碳环为母体,在碳环名称前加上杂原子的名称,称为“某(杂)某”。
如吡啶称为氮(杂)苯,喹啉称为1-氮(杂)萘。
杂环母环的编号规则(1)含1个杂原子的杂环,从杂原子开始用阿拉伯数字或从靠近杂原子的碳原子开始用希腊字母编号。
(2)如有几个不同的杂原子时,则按O 、S 、-NH-、-N=的先后顺序编号,并使杂原子的编号尽可能小。
(3)有些稠杂环母环有特定的名称和编号原则。