酸碱平衡和沉淀平衡
- 格式:ppt
- 大小:1.22 MB
- 文档页数:76


无机化学中四大平衡相互影响的问题探讨无机化学中的四大平衡包括酸碱平衡、氧化还原平衡、配位平衡和沉淀平衡。
这些平衡之间会相互影响,导致化学反应的方向和速率发生变化。
下面将详细探讨这些平衡之间的相互影响。
首先是酸碱平衡和氧化还原平衡之间的关系。
酸碱反应中通常伴随有氧化还原反应,而氧化还原反应也会发生酸碱反应。
在酸碱平衡中,如果有一种物质发生氧化还原反应,那么该反应将对酸碱平衡造成影响。
如果一种物质发生还原反应,会释放出氢气,从而增加溶液的酸性,导致酸碱平衡向酸性方向偏移。
相反地,如果一种物质发生氧化反应,会消耗氢气,减少溶液的酸性,导致酸碱平衡向碱性方向偏移。
再次是酸碱平衡和沉淀平衡之间的关系。
在沉淀反应中,溶液中的阳离子和阴离子结合形成固体沉淀。
而酸碱反应会影响沉淀平衡的方向和速率。
如果酸碱反应生成了强酸或弱碱,会增加阳离子的浓度,导致溶液中反应生成的沉淀浓度增加,促使沉淀反应向生成沉淀的方向偏移。
相反地,如果酸碱反应生成了弱酸或强碱,会减少阳离子的浓度,导致溶液中反应生成的沉淀浓度减少,促使沉淀反应向解离沉淀的方向偏移。
最后是氧化还原平衡和配位平衡之间的关系。
氧化还原反应中的金属离子可以与配体结合形成配合物。
配位反应会影响氧化还原平衡的方向和速率。
具体而言,如果配位反应中的配合物是氧化剂,会促使氧化反应进行,增加金属离子的氧化态;如果配位反应中的配合物是还原剂,会促使还原反应进行,减少金属离子的氧化态。
配位反应的进行会改变氧化还原平衡反应的方向和速率。
无机化学中的四大平衡相互影响,导致化学反应的方向和速率发生变化。
了解这些相互影响关系对于理解和控制无机化学反应具有重要意义。
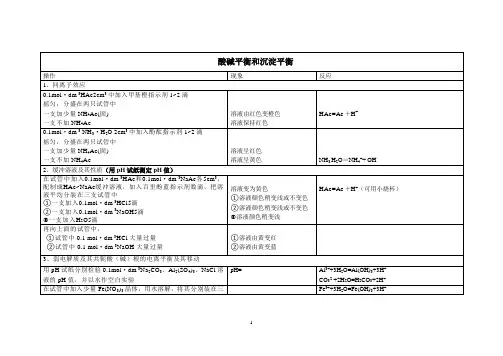
酸碱平衡和沉淀平衡操作现象反应1、同离子效应0.1mol·dm-3HAc2cm3中加入甲基橙指示剂1~2滴摇匀,分盛在两只试管中一支加少量NH4Ac(固) 一支不加NH4Ac 溶液由红色变橙色溶液保持红色HAc=Ac-+H+0.1mol·dm-3 NH3·H2O 2cm3中加入酚酞指示剂1~2滴摇匀,分盛在两只试管中一支加少量NH4Ac(固) 一支不加NH4Ac 溶液呈红色溶液呈黄色NH3 H2O=NH4++ OH-2、缓冲溶液及其性质(用pH试纸测定pH值)在试管中加入0.1mol·dm-3HAc和0.1mol·dm-3NaAc各5cm3,配制成HAc~NaAc缓冲溶液,加入百里酚蓝指示剂数滴,把溶液平均分装在三支试管中①一支加入0.1mol·dm-3HCl5滴②一支加入0.1mol·dm-3NaOH5滴③一支加入H2O5滴溶液变为黄色①溶液颜色稍变浅或不变色②溶液颜色稍变浅或不变色③溶液颜色稍变浅HAc=Ac-+H+(可用小烧杯)再向上面的试管中,①试管中0.1 mol·dm-3HCl大量过量②试管中0.1 mol·dm-3NaOH大量过量①溶液由黄变红②溶液由黄变蓝3、弱电解质及其共轭酸(碱)根的电离平衡及其移动用pH试纸分别检验0.1mol·dm-3Na2CO3、Al2(SO4)3、NaCl溶液的pH值,并以水作空白实验pH= Al3++3H2O=Al(OH)3+3H+CO32-+2H2O=H2CO3+2H+在试管中加入少量Fe(NO3)3晶体,用水溶解,将其分别装在三Fe3++3H2O=Fe(OH)3+3H+1支试管中第一支留作比较第二支中滴加数滴2mol·dm-3HNO3并摇匀第三支用小火加热溶液呈现黄色黄色褪去黄色加深(可水浴加热)在试管中加入0.1mol·dm-3BiCl31滴,用滴管加水稀释,再逐滴加入2mol·dm-3HCl至沉淀刚刚消失为止,再加水稀释出现白色沉淀BiCl3+3H2O=BiOCl(s)+3HCl在试管中加入10%Na2SiO35滴,再加入0.5mol·dm-3NH4Cl1cm3,摇匀白色沉淀NH4++H2O= NH3H2O+H+SiO32-+2H2O=2OH-+H2SiO3(s)透明在试管中加入0.1mol·dm-3A12(SO4)35滴,再加入0.5mol·dm-3 NaHCO32滴气泡白色沉淀HCO3-+ H2O=H2CO3+OH- H2CO3= H2O+CO2Al3++3H2O=Al(OH)3+3H+4、沉淀的生成、溶解和转化(1)在两支试管中各加入0.1mol·dm-3Pb(NO3)22滴一支加入1mol·dm-3KCl5滴一支加入0.01 mol·dm-3KCl5滴将生成沉淀的那一支试管小火加热白色沉淀(针状)澄清,无沉淀沉淀消失Pb2++2Cl-=PbCl2PbCl2在热水中溶解度大(2)在上面实验未产生沉淀的试管中加入0.01mol·dm-3KI 生成黄色沉淀Pb2++2I-=PbI2(黄色)(3)2mL1mol·dm-3MgCl2中加入2ml1 mol·dm-3NaOH(用氨水也可以)将沉淀过滤分盛在两个试管中,一支中加入1mol·dm-3HCl1ml一支中加入1mol·dm-3NH4Cl1ml 白色沉淀沉淀消失沉淀消失Mg2++2OH-⇌Mg(OH)2(如果是用氨水:Mg2++2NH3.H2O⇌Mg(OH)2+2NH4+)Mg(OH)2+2H+=Mg2++H2OMg(OH)2+2NH4Cl=MgCl2+2NH3+2H2O(4)沉淀转化2dK2CrO4溶液,滴加AgNO3溶液试管中滴加NaCl溶液砖红色沉淀转化为白色沉淀CrO42-+2Ag+=Ag2CrO4(砖红)Ag2CrO4+2Cl-=2AgCl(白)+CrO42-2试管中再滴加Na2S溶液转化为黑色沉淀2AgCl(白)+S2-=Ag2S(黑)+2Cl- 5、选做实验(1)分步沉淀:1dK2CrO4溶液(0.1mol/l)+2dNaCl溶液(0.1mol/l),滴加AgNO3溶液,(白色,红色沉淀)(2)缓冲溶液配制:pKa~pH,选Na2HPO4——NaH2PO4溶液混合,测定溶液的pH,用0.1mol/lHCl和0.1mol/l的NaOH试验其pH的变化3。





第四章酸碱平衡和沉淀溶解平衡根据酸碱质子理论,酸碱反应的实质是质子的传递。
根据酸碱质子理论,在水溶液中,弱酸及其共轭碱的关系:KΘa·KΘb=KΘw解离常数KΘa或KΘb:温度不变,解离常数不变。
已知弱酸的浓度和解离度,求弱酸的PH和解离常数?解:因为α=√KΘa·CΘ/C。
C(H+)=√Ka·C。
/CΘ 得出C(H+)=α·C。
/CΘ就可以求出PH,也可以求出解离常数。
酸碱平衡:已知酸的解离常数,求已知浓度C的含酸根的盐的PH?解:由酸的解离常数,根据Ka·Kb=Kw可得其共轭碱的解离常数Kb,代入得C(OH-)=√Kb·C/CΘ,所以C(H+)=Kw/C(OH-),PH=-lg(H+)缓冲溶液:配制缓冲溶液如何选择电解质及其对应的盐?解:解离常数K所对应的p H或POH尽可能地接近缓冲溶液的p H或POH缓冲方程PH=PKΘa(弱酸)-lgC弱酸/C共轭碱当缓冲比C弱酸/C共轭碱=1时,缓冲溶液的缓冲能力最大。
此时PH=PKΘa(弱酸)求缓冲溶液的PH值?解:由弱酸(碱)及其共轭碱(酸)组成。
以弱酸及其共轭碱构成的缓冲溶液(强酸与过量弱碱反应)为例:弱酸的(解离程度很小)浓度近似为强酸的浓度,共轭碱(没有考虑弱酸中所含有的碱根)的浓度=(弱碱的物质的量-强酸的物质的量)/混合后的总体积,则根据缓冲方程PH=PKΘa(弱酸)-lgC弱酸/C共轭碱即得。
如果再向混合液中加入酸或碱,再求弱酸和其共轭碱的浓度,代入缓冲方程即可。
溶度积与溶解度的关系:知溶解度求溶度积Ksp(生成的离子的乘积)?解:在不考虑离子水解的情况下,AB型Ksp=s²AB2或A2B型Ksp=4s³AB3型Ksp=27s4A2B3型Ksp=108s5 s是溶解度知溶度积kΘsp求溶解度s?⚠️AB型或AB2型方程不同。
例如:AgCl在0.1mol·L-1的NaCl溶液中溶解度为1.77×10-9mol·L-1。



酸碱平衡和沉淀平衡、配位平衡实验目的1.了解缓冲溶液的缓冲作用原理及配制。
2.掌握难溶电解质的多相离子平衡及沉淀的生成和溶解的条件。
3.了解配位平衡和沉淀反应、氧化还原反应、溶液的酸度的关系及平衡的移动。
实验原理溶液中的离子平衡包括弱电解质的解离平衡和难溶电解质的沉淀溶解平衡及配合物的配位平衡等。
在弱电解质及其共轭酸(或共轭碱)的解离平衡或难溶电解质的沉淀溶解平衡体系中,加入具有相同离子的易溶强电解质,则平衡向左移动,产生使弱电解质的解离度或难溶电解质的溶解度降低的同离子效应。
由弱酸(或弱碱)及其盐等共轭酸碱对所组成的溶液(例如HAc —NaAc ,NH 3—NH 4C1,H 2PO 4-—HPO 42-等),其pH 值不会因加入少量酸、碱或少量水稀释而发生显著变化,具有这种性质的溶液称为缓冲溶液。
根据溶度积规则可以判断沉淀的生成或溶解。
当体系中离子浓度的幂的乘积大于溶度积常数,即Q>K sp 有沉淀生成;Q<K sp 时,无沉淀生成或沉淀溶解;Q =K sp 时,则为饱和溶液。
配合物的组成一般可分为内界和外界两个部分。
中心离子和配位体组成配合物的内界(一般为配离子或分子);配合物中除中心离子和配位体以外的部分为外界。
当简单离子(或化合物)形成配离子(或配合物)后,其某些性质会发生改变,如颜色,溶解度,氧化还原性质等。
例如Fe 3+能使I -氧化为I 2,但当形成配离子(如FeF 64-)后,却能把I 2还原为I -。
配离子在溶液中同时存在着配合过程和离解过程,即存在着配位平衡,如:Ag + + 2NH 3[Ag(NH 3)2]+2323]][[])([NH Ag NH Ag K ++=稳 K 稳称为稳定常数,不同的配离子具有不同的稳定常数,对于同种类型的配离子,K 稳值愈大,表示配离子愈稳定。
实验内容1. 同离子效应和缓冲溶液(1)同离子效应:在试管中加入0.1mol ·dm -3HAc2cm 3,再加入甲基橙指示剂1~2滴,摇匀,观察溶液的颜色,然后分盛两支试管,在其中一支试管中加入少量NH 4Ac(固),摇动试管以促进溶解,观察溶液颜色的变化。