血清丙氨酸氨基转移酶(ALT)测定(赖氏法)
- 格式:doc
- 大小:49.50 KB
- 文档页数:3





1. 掌握赖氏法测定血清丙氨酸氨基转移酶(ALT)活性的原理和方法。
2. 学会操作赖氏法测定ALT活性的实验步骤。
3. 熟悉ALT测定的临床应用及注意事项。
二、实验原理赖氏法是一种常用的酶偶联速率法,用于测定血清中ALT活性。
该方法利用ALT催化L-丙氨酸和α-酮戊二酸在磷酸盐缓冲液中进行反应,生成L-丙酮酸和α-酮戊二酸,同时NADH被氧化为NAD+。
在特定波长下,NADH的吸光度与ALT活性呈线性关系,通过测定吸光度变化,计算出ALT活性。
三、实验材料与仪器1. 实验材料:(1)血清样本(2)赖氏法ALT测定试剂盒(3)磷酸盐缓冲液(4)L-丙氨酸(5)α-酮戊二酸(6)NADH(7)NAD+(8)分光光度计2. 实验仪器:(1)恒温水浴箱(2)移液器(3)离心机(4)微量滴定板1. 样本处理:取血清样本,按照试剂盒说明书进行稀释。
2. 标准曲线制备:(1)取6个微量滴定板,分别加入不同浓度的标准ALT溶液。
(2)向每个板中加入一定量的磷酸盐缓冲液,混匀。
(3)加入一定量的L-丙氨酸和α-酮戊二酸,混匀。
(4)将滴定板放入恒温水浴箱中,设定反应时间。
(5)反应结束后,加入一定量的NADH和NAD+,混匀。
(6)在特定波长下测定吸光度,以ALT浓度为横坐标,吸光度为纵坐标,绘制标准曲线。
3. 样本测定:(1)按照标准曲线制备的步骤,向微量滴定板中加入血清样本。
(2)按照标准曲线制备的步骤,进行反应和测定吸光度。
(3)根据标准曲线,计算血清样本的ALT活性。
五、结果与分析1. 标准曲线制备:根据标准曲线,得出线性方程为y=0.0068x+0.0015,其中y为吸光度,x为ALT浓度。
2. 样本测定:根据标准曲线,计算血清样本的ALT活性为40 U/L。
六、讨论1. 赖氏法测定ALT活性的原理和步骤简单,操作方便,准确度高。
2. 实验过程中,要注意反应时间的控制,以保证反应充分进行。
3. 标准曲线的制备是实验的关键环节,要确保标准曲线的线性关系良好。


实验十五血清ALT测定(赖氏法)实验十五血清ALT 测定(赖氏法)【目的】1.了解血清ALT 活性测定的原理及测定方法。
2. 掌握血清ALT 活性测定的临床意义。
【原理】丙氨酸与α-酮戊二酸在丙氨酸氨基转移酶(ALT )的作用下生成丙酮酸和谷氨酸。
在反应到达规定时间时,加入2,4-二硝基苯肼-盐酸溶液以终止反应。
生成的丙酮酸与2,4-二硝基苯肼作用,生成丙酮酸2,4-二硝基苯腙。
后者在碱性条件下显棕红色。
根据颜色的深浅,求得血清中丙氨酸氨基转移酶的活力。
反应式如下:C H CH 3NH 2COOHCO CH 2CH 2+ALTCH 3CCOOHO COOHCHNH 2CH 2CH 2+丙酮酸α-酮戊二酸丙氨酸谷氨酸C CH 3O +CH 3CN NO 2NO 2NH 丙酮酸NO 2NO 2NHN H 22,4-二硝基苯肼丙酮酸-2,4-二硝基苯腙(红棕色)NaOH-H 2O【器材】试管、刻度吸管、恒温水浴箱、分光光度计。
耗材:血清,座标纸等。
【试剂】1. 0.1mol/L 磷酸盐缓冲液(pH7.4)称取磷酸氢二钠(Na 2HPO 4,AR)11.928g ,磷酸二氢钾(KH 2PO 4,AR)2.176g ,加少量蒸馏水溶解并稀释至1 000ml 。
2. ALT 底物液称取α-酮戊二酸29.2mg ,DL 丙氨酸1.79g 于烧瓶中,加0.1mol/L pH7.4磷酸盐缓冲液80ml,煮沸溶解后冷却,用1mol/L NaOH调节pH至7.4(约加入0.5ml),再用0.1mol/L 磷酸盐缓冲液在容量瓶内加至100ml,混匀,加氯仿数滴,置冰箱可保存数周。
3. 丙酮酸标准液(2μmol/ml)精确称取丙酮酸钠(AR)22.0mg于100ml容量瓶中,加0.1mol/L pH7.4磷酸盐缓冲液至刻度。
4. 2,4-二硝基苯肼溶液称取2,4-二硝基苯肼19.8mg,用10mol/L盐酸10 ml溶解后,加蒸馏水至100ml,置棕色瓶内,冰箱保存。

授课对象:06级检验1-5班课时:2学时血清丙氨酸氨基转移酶(ALT)测定(赖氏法)目标:1.掌握赖氏法测血清ALT的原理及注意事项2.掌握试剂的配制熟练地制作标准曲线3.规范地进行ALT测定4.了解血清ALT测定的临床意义实验用品:配制试剂用的各种器皿(烧杯、容量瓶、电炉、分析天平等)、37℃水浴箱、721型风光光度计、坐标纸等原理:丙氨酸和α-酮戊二酸在血ALT的作用下生成丙酮酸及谷氨酸,在酶反应达到规定时间时,加入2.4-二硝基苯肼-盐酸溶液以终止反应。
生成的丙酮酸与入2.4-二硝基苯肼作用,生成丙酮酸入2.4二硝基苯腙,苯腙在碱性条件下显红棕色。
根据显色之深浅,求得血清中丙氨酸氨基转移酶活力。
试剂:1. 0.1molPH7.4磷酸盐缓冲液称取磷酸氢二钠(Na2HPO4AR)11.928g,磷酸二氢钾(KH2PO4AR)2.176g,加少量蒸馏水溶解并稀释至1000mL。
2. ALP基质液称取DL丙氨酸[CHCH(NH)COOH]1.79g,α-酮戊二酸[COOH (COCOOH)29.2mg于烧杯中,加入0.1mol/L PH7.4磷酸盐缓冲液80mL,煮沸溶解后待冷,用摩尔NaOH溶液调节PH至7.4(约加入0.5ml),再用0.1mol/LPH7.4磷酸盐缓冲液稀释至100mL,混匀,加氯仿数滴,置冰箱保存数周。
3.1mmol/L2.4-二硝基苯肼溶液称取 2.4-二硝基苯肼[(NO)CHNHNH AR]19.8mg,用10mol/L HC110mL溶解,然后加蒸馏水至100mL,置棕色瓶内,冰箱保存。
4.0.4mol/L NaOH溶液。
5.2mmol/L丙酮酸标准液精确称取丙酮酸钠[CHCOCOONa AR]22.0mg于100mL容量瓶中,加0.1mol/L PH7.4磷酸盐缓冲液至刻度。
此液应新鲜配制,不得久放。
操作:血清ALT测定步骤(赖氏法)加入物(mL)R B血清0.1 0.1ALP基质液0.5 —混匀,置37o C水浴30min2.4-二硝基苯肼0.5 0.5ALP基质液—0.5混匀,置37o C水浴20min0.4mol/L NaOH 5.0 5.0将上述两管混匀,10min后,用蒸馏水调零,λ=505nm比色读取各管吸光度值,用测定管A-对照管A,查标准曲线得ALT活力单位。

赖氏法测定血清丙氨酸氨基转移酶【原理】L-丙氨酸 + α-酮戊二酸 α-丙酮酸 + L-谷氨酸 α-丙酮酸 + 2,4-二硝基苯肼 2,4-二硝基苯腙(红棕色,λ=505nm )利用比色分析原理将样品显色与丙酮酸标准品配制成的系列标准液比较,求出样品中丙氨酸氨基转移酶(ALT )活性。
【试剂】1.0.1mol/L 磷酸二氢钾溶液 称取KH 2PO 4 13.61g ,溶解于蒸馏水中,加水至1 000ml ,4℃保存。
2.0.1mol/L 磷酸氢二钠溶液 称取Na 2HPO 414.22g ,溶解于蒸馏水中,并稀释至1 000ml ,4℃保存。
3.0.1mol/L 磷酸盐缓冲液(pH7.4) 取420ml 0.1mol/L 磷酸氢二钠溶液和80ml 0.1mol/L 磷酸二氢钾溶液,混匀,即为pH7.4的磷酸盐缓冲液。
加氯仿数滴,4℃保存。
4.基质缓冲液 精确称取D-L-丙氨酸1.79g ,α-酮戊二酸29.2mg ,先溶于0.1mol/L 磷酸盐缓冲液约50ml 中,用1mol/L NaOH 调pH 至7.4,再加磷酸盐缓冲液至100ml ,4~6℃保存,该溶液可稳定2w 。
每升底物缓冲液中可加入麝香草酚0.9g 或加氯仿防腐,4℃保存。
配成200mmol/L 丙氨酸与2.0mmol/Lα-酮戊二酸基质缓冲液。
5.1.0mmol/L 2,4-二硝基苯肼溶液 称取2,4-二硝基苯肼(AR )19.8mg ,溶于1.0mol/L 盐酸100ml ,置棕色玻璃瓶中,室温中保存,若冰箱保存可稳定2个月。
若有结晶析出,应重新配制。
6.0.4mol/L NaOH 溶液 称取NaOH 1.6g 溶解于蒸馏水中,并加蒸馏水至100ml ,置具塞塑料试剂瓶内,室温中可长期稳定。
7.2.0mmol/L 丙酮酸标准液 准确称取丙酮酸钠(AR )22.0mg ,置于100ml 容量瓶中,加0.05mol/L 硫酸至刻度。

步骤:一.组长取5个试剂瓶贴标签注明将要装的实际名称,然后倒取试剂。
血清由老师分装后,由组长领取。
二.测定血清ALT1.取2支试管,贴标签注明组别、学号、对照管(B)和测定管(U),用微量移液器分别加0.1ml血清。
2.用移液管向U管中加入0.5ml基质缓冲液。
B管不加。
混匀后同时在水浴温箱中37℃保温30min。
作用:U管中有酶促反应,B管无。
3.用移液管向B、U管各加0.5ml 2,4-二硝基苯肼溶液。
作用:终止反应,生成显色物质。
4.用移液管向B管加入0.5ml基质缓冲液,U管不加。
混匀后在水浴温箱中37℃保温20min。
作用:保证检测条件的一致性。
5.用移液管向B、U管各加2,4-二硝基苯肼溶液作用:碱性条件,显色。
6.B、U管室温放置5min,在波长505nm以蒸馏水调零,读取吸光度。
注意:基质缓冲液和2,4-二硝基苯肼溶液的加入顺序不能颠倒A。
表13-7三.ALT标准曲线绘制1.取5支试管,贴标签标明组别、学号、序号(0、1、2、3、4)。
用移液管取0.1 mol/l磷酸盐缓冲液,各加0.1ml。
2.用移液管取2.0 mol/l丙酮酸标准液加入各试管,0管不加,1、2、3、4管各加0.05、0.10、0.15、0.20ml。
作用:代替酶促反应产物。
3.用移液管取基质缓冲液加入各试管,0、1、2、3、4管分别加0.50、0.45、0.40、0.35、0.30ml。
4.用移液管取2,4-二硝基苯肼溶液加入各试管,各加0.5ml。
5.混匀,各试管同时在水浴温箱中37℃保温20min。
6.用移液管向各试管加2,4-二硝基苯肼溶液。
7.混匀,室温放置5min,在波长505nm以蒸馏水调零,读取吸光度A。
各管吸光度减去0管吸光度为该标准管的吸光度值。
8.以吸光度值为纵坐标,对应的卡门单位为横坐标,各标准管代表的活性单位与吸光度值作图,即成标准曲线。
表13-6。
丙氨酸氨基转移酶(ALT)检测(赖氏法)规程原理本法系依据丙氨酸氨基转移酶(Alaurine Transaminase 缩写为ALT)与由丙氨酸及α-酮戊二酸组成的底物缓冲液产生丙酮酸及谷氨酸。
丙酮酸与2,4-二硝基苯肼作用,生成丙酮酸2,4-二硝基苯腙,在碱性溶液中显红棕色。
通过比色测定可以了解血浆中丙氨酸氨基转移酶的活力。
试剂(1)0.1mol/L磷酸盐缓冲液(pH7.4)准确称取磷酸氢二钠二水合物15.04g、磷酸二氢钾1.09g溶于实验用水中,补加实验用水至500ml。
然后用1mol/L HCl溶液或1mol/L NaOH溶液调整pH至7.4,密封保存。
(2)底物缓冲液(200mmol/L DL-丙氨酸;2mmol/Lα-酮戊二酸)精确称取DL-丙氨酸1.79g 和α-酮戊二酸29.2mg,用0.1mol/L磷酸盐缓冲液溶解并稀释至100ml,用1mol/L氢氧化钠(约0.5ml)调节pH值至7.4,密封保存。
(3)1mmol/L2,4-二硝基苯肼溶液称取2,4-二硝基苯肼19.8mg,用1mol/L浓度的盐酸溶液溶解,并稀释至100ml。
(4)0.4mol/L氢氧化钠溶液称取氢氧化钠16.0g,用实验用水溶解至1000ml。
(5)2mol/L氢氧化钠溶液称取氢氧化钠80g,用实验用水溶解至1000ml。
(6)2mmol/L丙酮酸标准液精确称取丙酮酸钠22.0mg,置于100ml称量瓶中,加0.05mol/L 的硫酸溶液溶解,然后移入100ml容量瓶中,再用0.05mol/L的硫酸溶液洗涤称量瓶三次,将洗涤液并入容量瓶中,补加0.05mol/L的硫酸溶液至容量瓶刻度,摇匀。
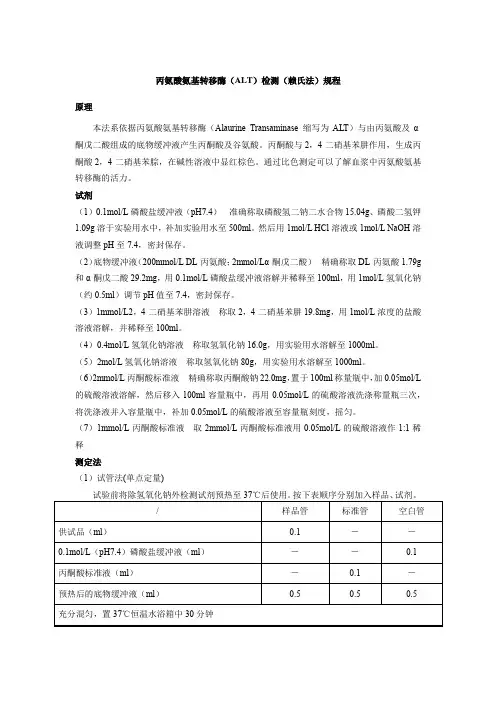
(7)1mmol/L丙酮酸标准液取2mmol/L丙酮酸标准液用0.05mol/L的硫酸溶液作1:1稀释测定法(1)试管法(单点定量)样品酶活力按下式计算样品酶活力(单位)=样品管吸光度值÷标准管吸光度值×标准的单位(2)试管法(标准曲线)试验前将除氢氧化钠外检测试剂预热至37℃后使用。
实验十实验名称:血清中ALT的测定实验目的与要求:掌握赖氏法测定血清丙氨酸氨基转移酶的原理。
实验仪器、试剂:丙氨酸氨基转移酶测定试剂盒,分光光度计实验原理:血清中的丙氨酸氨基转移酶催化丙氨酸和α-酮戊二酸生成丙酮酸和谷氨酸,丙酮酸与2,4-二硝基苯肼反应生成2,4-二硝基苯腙,在碱性溶液中显棕红色,可测定其吸光度值,通过标准曲线计算出丙氨酸氨基转移酶的活力。
操作方法:1、将NaOH溶液稀释10倍,至0.4mol/L,基质液37℃水浴。
2、标准曲线的绘制,取5支试管,按下表分别加入试剂,试管0 1 2 3 4生理盐水(ml)0.1 0.1 0.1 0.1 0.1丙酮酸标准(ml) 0.00 0.05 0.10 0.15 0.20基质液(ml)0.50 0.45 0.40 0.35 0.30活力单位0 28 57 97 150各管加入2,4-二硝基苯肼0.50ml混匀,37℃水浴20分钟,再分别加入0.4mol/LNaOH溶液5.0ml,室温10分钟。
以“0”管调零,505nm测定吸光度,以吸光度为纵坐标,酶活力单位为横坐标绘制标准图。
3、取试管2支,按如下操作:单位ml 测定对照血清0.10 0.10基质液0.50 -混匀,37℃水浴30min2,4-二硝基苯肼0.50 0.50基质液-0.50混匀,37℃水浴20min加入0.4mol/LNaOH溶液5.0ml,室温10分钟。
以对照管调零,505nm测定吸光度,实验现象与数据:记录吸光度值结果分析与结论:在标准曲线上查得酶活力单位。
参考值:0-25临床意义:实验十一实验名称:血清碱性磷酸酶的测定实验目的与要求:掌握AMP法测定血清碱性磷酸酶的原理。
实验仪器、试剂:碱性磷酸酶测定试剂盒半自动生化分析仪实验原理:血清中碱性磷酸酶在碱性条件下将磷酸-4-硝基苯酚中的磷酸基转移到2-氨基-2-甲基-1-丙醇(AMP)并释放4-硝基苯酚。
在405nm处测定4-硝基苯酚生成的速率,即可计算出ALP的活性。
实验十九 赖氏法测定血清丙氨酸氨基转移酶【原理】L-丙氨酸 + α-酮戊二酸α-丙酮酸 + L-谷氨酸 α-丙酮酸 + 2,4-二硝基苯肼2,4-二硝基苯腙 (红棕色,λ=505nm )利用比色分析原理将样品显色与丙酮酸标准品配制成的系列标准液比较,求出样品中丙氨酸氨基转移酶(ALT )活性。
【试剂】1.0.1mol/L 磷酸二氢钾溶液 称取KH 2PO 4 13.61g ,溶解于蒸馏水中,加水至1 000ml ,4℃保存。
2.0.1mol/L 磷酸氢二钠溶液 称取Na 2HPO 414.22g ,溶解于蒸馏水中,并稀释至1 000ml ,4℃保存。
3.0.1mol/L 磷酸盐缓冲液(pH7.4) 取420ml 0.1mol/L 磷酸氢二钠溶液和80ml 0.1mol/L 磷酸二氢钾溶液,混匀,即为pH7.4的磷酸盐缓冲液。
加氯仿数滴,4℃保存。
4.基质缓冲液 精确称取D-L-丙氨酸1.79g ,α-酮戊二酸29.2mg ,先溶于0.1mol/L 磷酸盐缓冲液约50ml 中,用1mol/L NaOH 调pH 至7.4,再加磷酸盐缓冲液至100ml ,4~6℃保存,该溶液可稳定2w 。
每升底物缓冲液中可加入麝香草酚0.9g 或加氯仿防腐,4℃保存。
配成200mmol/L 丙氨酸与2.0mmol/Lα-酮戊二酸基质缓冲液。
5.1.0mmol/L 2,4-二硝基苯肼溶液 称取2,4-二硝基苯肼(AR )19.8mg ,溶于1.0mol/L 盐酸100ml ,置棕色玻璃瓶中,室温中保存,若冰箱保存可稳定2个月。
若有结晶析出,应重新配制。
6.0.4mol/L NaOH 溶液 称取NaOH 1.6g 溶解于蒸馏水中,并加蒸馏水至100ml ,置具塞塑料试剂瓶内,室温中可长期稳定。
7.2.0mmol/L 丙酮酸标准液 准确称取丙酮酸钠(AR )22.0mg ,置于100ml 容量瓶中,加0.05mol/L 硫酸至刻度。
授课对象:06级检验1-5班
课时:2学时
血清丙氨酸氨基转移酶(ALT)测定(赖氏法)
目标:1.掌握赖氏法测血清ALT的原理及注意事项
2.掌握试剂的配制熟练地制作标准曲线
3.规范地进行ALT测定
4.了解血清ALT测定的临床意义
实验用品:配制试剂用的各种器皿(烧杯、容量瓶、电炉、分析天平等)、37℃水浴箱、721型风光光度计、坐标纸等
原理:
丙氨酸和α-酮戊二酸在血ALT的作用下生成丙酮酸及谷氨酸,在酶反应达到规定时间时,加入2.4-二硝基苯肼-盐酸溶液以终止反应。
生成的丙酮酸与入2.4-二硝基苯肼作用,生成丙酮酸入2.4二硝基苯腙,苯腙在碱性条件下显红棕色。
根据显色之深浅,求得血清中丙氨酸氨基转移酶活力。
试剂:
1. 0.1molPH7.4磷酸盐缓冲液称取磷酸氢二钠(Na2HPO4AR)11.928g,磷酸二氢钾(KH2PO4AR)
2.176g,加少量蒸馏水溶解并稀释至1000mL。
2. ALP基质液称取DL丙氨酸[CHCH(NH)COOH]1.79g,α-酮戊二酸[COOH (COCOOH)29.2mg于烧杯中,加入0.1mol/L PH7.4磷酸盐缓冲液80mL,煮沸溶解后待冷,用摩尔NaOH溶液调节PH至7.4(约加入0.5ml),再用0.1mol/LPH7.4磷酸盐缓冲液稀释至100mL,混匀,加氯仿数滴,置冰箱保存数周。
3.1mmol/L2.4-二硝基苯肼溶液称取 2.4-二硝基苯肼[(NO)CHNHNH AR]19.8mg,用10mol/L HC110mL溶解,然后加蒸馏水至100mL,置棕色瓶内,冰箱保存。
4.0.4mol/L NaOH溶液。
5.2mmol/L丙酮酸标准液精确称取丙酮酸钠[CHCOCOONa AR]22.0mg于
100mL容量瓶中,加0.1mol/L PH7.4磷酸盐缓冲液至刻度。
此液应新鲜配制,不得久放。
操作:
血清ALT测定步骤(赖氏法)
加入物(mL)R B
血清0.1 0.1
ALP基质液0.5 —
混匀,置37o C水浴30min
2.4-二硝基苯肼0.5 0.5
ALP基质液—0.5
混匀,置37o C水浴20min
0.4mol/L NaOH 5.0 5.0
将上述两管混匀,10min后,用蒸馏水调零,λ=505nm比色读取各管吸光度值,用测定管A-对照管A,查标准曲线得ALT活力单位。
血清ALT测定步骤(赖氏法)标准曲线制作:
加入物(ml)0 1 2 3 4 5
2mmol/L丙酮酸标准液0 0.05 0.10 0.15 0.20 0.25 ALP基质液0.5 0.45 0.40 0.35 0.30 0.25 0.1mol pH7.4磷酸盐缓冲液0.1 0.1 0.1 0.1 0.1 0.1
混匀,置37o C水浴30min
2.4-二硝基苯肼溶液0.5 0.5 0.5 0.5 0.5 0.5
混匀,置37o C水浴20min
0.4mol/L NaOH 5.0 5.0 5.0 5.0 5.0 5.0 相当于ALT单位0 28 57 97 150 200 混匀,10min后,用蒸馏水调零,λ=505nm比色读取各管吸光度值,将各管之系光度减去0号管吸光度值后,以吸光度为纵坐标,各管相应的ALT单位为横坐标,绘制标准曲线。
结果报告:
被检者———————
血清ALT——————U——[<35U]
报告者————————————年————月————日
临床意义:
1.赖氏法的酶活力单位是用卡门法所测出的酶活力单位相当于用本法所生成的丙酮酸量的相关系数套用卡门单位而来,卡门单位的定义:在规定表件下(血清1ml,反应液总量3ml,在25o C下作用1min,用内径1cm 的比色杯),测定340nm波长处吸光度减少值(A),每减少0.001为一个酶活力单位。
2.血清对照管吸光度基本相同,因此同一批标本只做2~3个血清对照管求其平均即可。
亦可以空白管替代对照管。
但脂血、溶血和黄疸血清应单独做对照管。
3.测定结果超过200卡门单位时,应将血清稀释后在进行测定,结果乘以稀释倍数。
4. 酶测定中,温度、时间对酶的活力影响很大,故应控制好测定时的温度(要求准确到37±0.5o C),并准确掌握保温时间。
5. 配制底物液时,如改用改L—型丙氨酸,则应按上法减半量用(因ALT只作用与L-型丙氨酸)。
6. 丙酮酸钠的纯度,对曲线有明显影响,纯度低曲线斜率就低,使查得的酶活力单位显著增高。
故应选择外观洁白、干燥的丙酮酸钠使用。
7. 丙酮酸的显色受温度影响,故应于季节变化时及底物成份之批号更换时重新制作标准曲线。
8.于α-酮戊二酸也能与2.4-二硝基苯肼作用生成苯腙而显色,为了减少其对丙酮酸测定的干扰作用,底物中α-酮戊二酸的浓度很低,不能保证酶反应的充分进行;且2.4-二硝基苯肼的浓度也比较低,因此标准曲线不呈直线。
课后小结:。