几种晶体模型
- 格式:ppt
- 大小:910.50 KB
- 文档页数:15

七大晶系详细图解一、四方晶系。
其中两个水平轴(X 四方晶系四方晶系的三条晶轴互相垂直,即α=β=γ=90°轴、Y轴)长度一样,Z轴的长度可长可短,通俗的说:四方晶系的晶体大多是四棱的柱状体,有的是长柱体,有的是短柱体,即其晶胞必具有四方柱的形状。
横截面为正方形,四个柱面是对称的,即相邻和相对的柱面都是一样的,但和顶端不对称。
所有主晶面交角都是90。
特征对称元素为四重轴。
如果Z轴发育,它就是长柱状甚至针状;如果两个横轴(X轴、Y轴)发育大于Z轴,那么晶体就会呈现四方板状,最有代表的就是磷酸二氢钠和硫酸镍β了。
常见的立方晶系的晶体模型图:注:柱体的棱角发育成窄小晶面,此种晶体又叫“复四方”——四个主柱面,四个小柱面。
晶体实物图:三、斜方晶系斜方晶系的晶体中三个轴的长短完全不相等,它们的交角仍然是互为90度垂直。
即X≠Y≠Z。
Z轴和Y轴相互垂直90°。
X轴与Y轴垂直,但是不与Z轴垂直,即α=γ=90,β>90°与正方晶系直观相比,区别就是:x轴、y轴长短不一样。
如果围绕z轴旋转,四方晶系旋转九十度即可使x轴y轴重合,旋转一周使x轴y轴重合四次(使另两轴重合的次数多于两次,该轴称“高次轴”),四方晶系有一个高次轴,也叫“主轴”。
斜方晶系围绕z轴旋转,需180度才可使x轴y 轴重合,旋转一周只重合两次,属低次轴。
也就是说,斜方晶系的对称性比四方晶系要低。
特征对称元素是二重对称轴或对称面。
其实,斜方晶系的晶体如果围绕x轴或y轴旋转,情况与围绕z轴旋转相同。
换句话说,斜方晶系没有高次轴,或曰没有理论上的主轴。
从模型上看,四方晶系的x轴和y轴所指向的晶面完全都是对称相同的,斜方晶系的x轴和y轴所指向的晶面却是各自相等的。
常见立方晶系模型图:斜方晶系晶体两个轴(如x轴、y轴)构成的平面,即晶体横截面是长方形,也可以是菱形,或者两者的复合形,如下图:晶体实物图:四、单斜晶体单斜晶系的三个晶轴长短皆不一样,即X≠Y≠Z。

氯化钠晶体离子晶体(1)NaCI晶胞中每个Na+等距离且最近的Cl-(即Na+配位数)为6个(2)(3)NaCI晶胞中每个CI-等距离且最近的Na+(即CI-配位数)一个晶胞内由均摊法计算出一个晶胞内占有的Na+4个; 占有的CI-4个。
在该晶体中每个Na+周围与之最接近且距离相等的Na+ 与每个Na+等距离且最近的CI-所围成的空间几何构型为CsCI晶体(注意:右侧小立方体为CsCI晶胞;左侧为8个晶胞)(1)CsCI晶胞中每个Cs+等距离且最近的C「(即Cs+配位数)为8个CsCI晶胞中每个CI-等距离且最近的Cs+(即CI-配位数)为8个,这几个Cs+在空间构成的几何构型为正方体。
(2)在每个Cs+周围与它最近的且距离相等的Cs+有6个这几个Cs+在空间构成的几何构型为正八面体。
• Cs* OCI- (3)一个晶胞内由均摊法计算出一个晶胞内占有的Cs+ 1个;占有的CI- 1个CaF2晶体(1))Ca2+立方最密堆积,F-填充在全部四面体空隙中。
(2)CaF2晶胞中每个Ca2+等距离且最近的F-(即Ca2+配位数)为8个CaF2晶胞中每个F-等距离且最近的Ca2+(即F-配位数)为4个(3)一个晶胞内由均摊法计算出一个晶胞内占有的Ca2+4个;占有的F-8个。
ZnS晶体:(1)1个ZnS晶胞中,有4 个S2「,有4个Zn2+(2)Zn2+的配位数为4个, S2_的配位数为4个O£n?,•原子晶体(1) 金刚石晶体a 每个金刚石晶胞中含有 8个碳原子,最小的碳环为 6元环,并且不在同一平面(实际为椅 式结构),碳原子为sp 3杂化,每个C 以共价键跟相邻的_4_个 C 结合,形成正四面体。
键角109° 28'b 、 每个碳原子被12个六元环共用,每个共价键被6个六元环共用c 、 12g 金刚石中有2mol 共价键,碳原子与共价键之比为 (2) Si 晶体由于Si 与碳同主族,晶体Si 的结构同金刚石的结构。

常见晶体模型及晶胞计算引言晶体是由周期性排列的原子、离子或分子构成的固体材料。
晶体的周期性排列导致了其具有一些特殊的性质,例如独特的光学、电学和热学性质。
为了研究晶体的这些性质,科学家提出了各种模型来描述晶体的结构。
在本文中,我们将介绍几种常见的晶体模型,并讨论晶胞计算的方法。
晶体模型1.金属晶体模型金属晶体模型是最简单的晶体模型之一、金属晶体由金属原子构成,没有共价键或离子键。
金属晶体的特点是具有密堆结构,例如面居中立方(fcc)或体居中立方(bcc)结构。
这些结构可以用简单的立方晶胞来描述,其中原子位于晶格点上。
2.离子晶体模型离子晶体是由正负离子构成的晶体。
离子晶体的特点是具有离子键,即正离子和负离子之间的静电相互作用力。
离子晶体的结构可以用通常称为离子晶胞的基本单元来描述。
离子晶胞中包含正离子和负离子,并且具有充分保持电中性的结构。
3.共价晶体模型共价晶体由共价键相互连接的原子或离子组成。
共价键是由共用电子对形成的,这些电子对由每个原子的价电子共享。
共价晶体的结构可以用共价晶胞来描述,其中原子或分子通过共价键连接。
晶胞计算晶胞计算是研究晶体结构的一种方法。
具体来说,晶胞计算是为了确定晶体的晶胞参数,即晶体中原子、离子或分子的排列和间距。
晶胞计算通常包括以下步骤:1.数据收集:这是晶胞计算的第一步。
通过使用X射线衍射、中子衍射或电子衍射等实验技术,收集晶体的衍射数据。
2.数据分析:在收集到晶体的衍射数据后,需要对这些数据进行分析。
这包括确定晶胞中原子的位置和间距。
一般采用的方法是使用维护衍射方程来进行数据分析。
3.模型构建:在完成数据分析后,可以构建晶胞模型。
这可以通过使用复结构拓扑方法或使用分子动力学模拟等方法来实现。
4.晶胞参数优化:晶胞参数的优化是为了获得最佳的晶胞参数。
这可以通过使用晶体学软件进行计算和优化来实现。
5.结果解释:最后一步是对晶胞计算结果进行解释和分析。
这可以包括确定晶体中原子、离子或分子的排列和结构,并进一步研究晶体的性质。
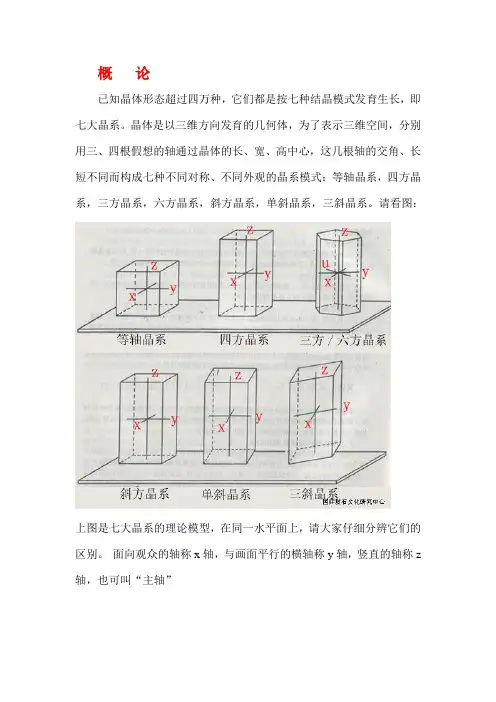
概论已知晶体形态超过四万种,它们都是按七种结晶模式发育生长,即七大晶系。
晶体是以三维方向发育的几何体,为了表示三维空间,分别用三、四根假想的轴通过晶体的长、宽、高中心,这几根轴的交角、长短不同而构成七种不同对称、不同外观的晶系模式:等轴晶系,四方晶系,三方晶系,六方晶系,斜方晶系,单斜晶系,三斜晶系。
请看图:上图是七大晶系的理论模型,在同一水平面上,请大家仔细分辨它们的区别。
面向观众的轴称x轴,与画面平行的横轴称y轴,竖直的轴称z 轴,也可叫“主轴”一,等轴晶系简介等轴晶系的三个轴长度一样,且相互垂直,对称性最强。
这个晶系的晶体通俗地说就是方块状、几何球状,从不同的角度看高低宽窄差不多。
如正方体、八面体、四面体、菱形十二面体等,它们的相对晶面和相邻晶面都相似,这种晶体的横截面和竖截面一样。
此晶系的矿物有黄铁矿、萤石、闪锌矿、石榴石,方铅矿等。
请看这种晶系的几种常见晶体的理论形态:等轴晶系的三个晶轴(x轴y轴z轴)一样长,互相垂直。
常见的等轴晶系的晶体模型图二,四方晶系简介四方晶系的三个晶轴相互垂直,其中两个水平轴(x轴、y轴)长度一样,但z轴的长度可长可短。
通俗地说,四方晶系的晶体大都是四棱的柱状体,(晶体横截面为正方形,但有时四个角会发育成小柱面,称“复四方”),有的是长柱体,有的是短柱体。
再,四方晶系四个柱面是对称的,即相邻和相对的柱面都一样,但和顶端不对称(不同形);所有主晶面交角都是九十度交角。
请看模型图:四方晶系的晶体如果z轴发育,它就是长柱状甚至针状;如果两个横轴(x 、y)发育大于竖轴z轴,那么该晶体就是四方板状,最有代表性的就是钼铅矿。
锡石的长柱状晶体(顶端另有斜生的小晶体)。
请注意看柱体的棱角发育成窄小晶面,此种晶体又叫“复四方”——四个主柱面,四个小柱面。
这是短柱状锆石,柱体几乎不发育。
象个四方双锥体或假八面体钼铅矿的晶体是四方板状,也就是两个横轴的发育程度大大超越竖轴(z 轴)鱼眼石晶体晶体在实际生长中有许多因素影响它的正常形状,如z轴“平移”或平行连生等,四方晶系的晶体横截面有时不是正方形,会略带长方形。
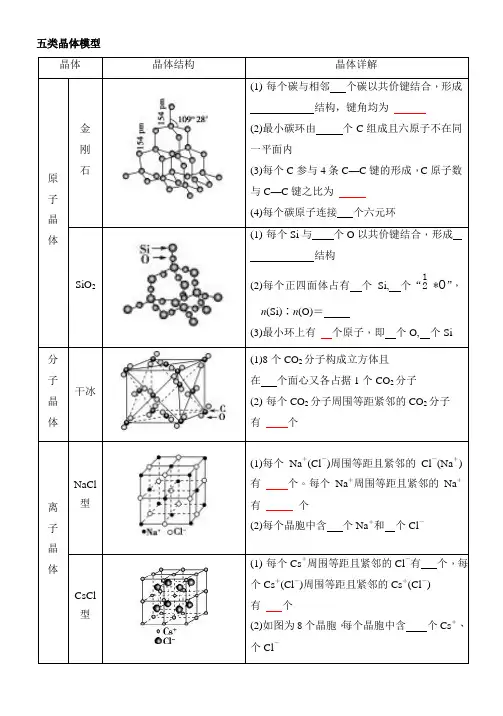
五类晶体模型晶体晶体结构晶体详解原子晶体金刚石(1)每个碳与相邻个碳以共价键结合,形成结构,键角均为(2)最小碳环由个C组成且六原子不在同一平面内(3)每个C参与4条C—C键的形成,C原子数与C—C键之比为(4)每个碳原子连接个六元环SiO2(1)每个Si与个O以共价键结合,形成结构(2)每个正四面体占有个Si, 个“21*O”,n(Si)∶n(O)=(3)最小环上有个原子,即个O, 个Si分子晶体干冰(1)8个CO2分子构成立方体且在个面心又各占据1个CO2分子(2)每个CO2分子周围等距紧邻的CO2分子有个离子晶体NaCl型(1)每个Na+(Cl-)周围等距且紧邻的Cl-(Na+)有个。
每个Na+周围等距且紧邻的Na+有个(2)每个晶胞中含个Na+和个Cl-CsCl型(1)每个Cs+周围等距且紧邻的Cl-有个,每个Cs+(Cl-)周围等距且紧邻的Cs+(Cl-)有个(2)如图为8个晶胞,每个晶胞中含个Cs+、个Cl-金属晶体简单立方堆积典型代表,空间利用率,配位数为体心立方堆积典型代表、、,空间利用率,配位数为六方最密堆积典型代表Mg、Zn、Ti,空间利用率,配位数为面心立方最密堆积典型代表、、,空间利用率;配位数为石墨晶体层状晶体石墨层状晶体中,层与层之间的作用是,平均每个正六边形拥有的碳原子个数是,C原子采取的杂化方式是,每个碳原子连接个六元环。
下列是钠、铜、碘、金刚石、干冰、氯化钠、氟化钙、水合铜离子的晶胞示意图(未按顺序排序),将对应物质名称写在晶胞结构下:。

常见晶体模型及晶胞计算
一、晶体模型
晶体模型是用来描述晶体结构的数学模型,它是由晶体中的原子,原子之间的相互作用以及构成晶体结构的基本构件构成的。
晶体模型有很多种,主要包括普通晶体模型、块体晶体模型、多解晶构模型、时效晶体模型、闪锌晶体模型等。
1.普通晶体模型:普通晶体模型包括立方晶体模型、六方晶体模型和六点晶体模型,它依据晶体原子的八面体集合和块体构件来描述晶体的结构。
2.块体晶体模型:块体晶体模型是指块体晶体的特殊形状,即一种多晶体结构模型,它以晶胞的形状来描述晶体结构,每一晶胞都包含若干个晶体原子。
3.多解晶构模型:多解晶构模型是一种描述晶体结构的复杂模型,它以自动运算机技术,以多样的晶胞几何位置,把晶体分解成若干个块体,用最小的能量来构建晶体结构,从而避免晶体自组织构建的耗能现象。
4.时效晶体模型:时效晶体模型也称为“时效条件”。
它描述了晶体原子的动力学过程,它有助于理解晶体中不同原子间的相互作用,以及晶体在不断降温、淬火和轧缩的过程中的变化。

金属晶体的四种堆积模型
金属晶体是由金属原子按照一定的排列构成的固体,它们具有规则的晶体结构,其中最常见的是四种堆积模型:面心立方模型、面心六方模型、空心六方模型和空心八方模型。
面心立方模型是最常见的金属晶体堆积模型,它由八个原子组成,每个原子都位于晶体的八个顶点上,形成一个立方体。
这种模型的特点是,每个原子都与其他七个原子有相同的距离,因此它具有良好的稳定性。
面心六方模型是一种比面心立方模型更复杂的晶体堆积模型,它由十二个原子组成,每个原子都位于晶体的六个面上,形成一个六面体。
这种模型的特点是,每个原子都与其他五个原子有不同的距离,因此它具有较高的热稳定性。
空心六方模型是一种比面心六方模型更复杂的晶体堆积模型,它由十八个原子组成,每个原子都位于晶体的六个面上,形成一个空心六面体。
这种模型的特点是,每个原子都与其他十一个原子有不同的距离,因此它具有较高的热稳定性和机械稳定性。
空心八方模型是一种比空心六方模型更复杂的晶体堆积模型,它由二十四个原子组成,每个原子都位于晶体的八个面上,形成一个空心八面体。
这种模型的特点是,每个原子都与其他十七个原子有不同的距离,同样具有较高的热稳定性和机械稳定性。
总之,金属晶体的四种堆积模型是面心立方模型、面心六方模型、空心六方模型和空心八方模型,它们各自具有不同的特点,可以满足不同的应用需求。

金属晶体的四种堆积模型总结Metal crystals can be classified into four main stacking models: Close-packed cubic (FCC), Close-packed hexagonal (HCP), Body-centered cubic (BCC), and Simple cubic (SC). These models represent different ways in which metal atoms arrange themselves in a crystal lattice. Close-packed cubic structures have atoms arranged in layers of repeating ABCABC... pattern, giving them high packing efficiency.金属晶体可以分为四种主要的堆积模型:密堆立方(FCC)、密堆六方(HCP)、体心立方(BCC)和简单立方(SC)。
这些模型代表了金属原子在晶格中排列的不同方式。
密堆立方结构中,原子按照重复ABCABC...模式排列在不同层中,使得具有较高的填充效率。
Close-packed hexagonal structures, on the other hand, consist of layers with an ABAB... stacking sequence. This type of arrangement gives rise to a compact structure with a hexagonal unit cell. Body-centered cubic structures have atoms arranged in a simple cubic lattice with an additional atom at the center of the cube. This arrangement provides good mechanical properties due to thepresence of the central atom, which enhances the strength of the crystal lattice.另一方面,密堆六方结构由具有ABAB...堆叠序列的层组成。

氯化钠晶体(1)NaCl晶胞中每个Na+等距离且最近的Cl-(即Na+配位数)为6个NaCl晶胞中每个Cl-等距离且最近的Na+(即Cl-配位数)为6个(2)一个晶胞内由均摊法计算出一个晶胞内占有的Na+4_个;占有的Cl-4个。
(3)在该晶体中每个Na+周围与之最接近且距离相等的Na+共有12个;与每个Na+等距离且最近的Cl-所围成的空间几何构型为正八面体CsCl晶体(注意:右侧小立方体为CsCl晶胞;左侧为8个晶胞)(1)CsCl晶胞中每个Cs+等距离且最近的Cl-(即Cs+配位数)为8个CsCl晶胞中每个Cl-等距离且最近的Cs+(即Cl-配位数)为8个,这几个Cs+在空间构成的几何构型为正方体。
(2)在每个Cs+周围与它最近的且距离相等的Cs+有6个这几个Cs+在空间构成的几何构型为正八面体。
(3)一个晶胞内由均摊法计算出一个晶胞内占有的Cs+ 1个;占有的Cl- 1个。
CaF2晶体(1))Ca2+立方最密堆积,F-填充在全部四面体空隙中。
(2)CaF2晶胞中每个Ca2+等距离且最近的F-(即Ca2+配位数)为8个CaF2晶胞中每个F-等距离且最近的Ca2+(即F-配位数)为4个(3)一个晶胞内由均摊法计算出一个晶胞内占有的Ca2+4个;占有的F-8个。
ZnS晶体:(1)1个ZnS晶胞中,有4个S2-,有4个Zn2+。
(2)Zn2+的配位数为4个,S2-的配位数为 4个。
Si O金刚石 金刚石晶胞 金刚石晶胞分位置注释(1)金刚石晶体a 、每个金刚石晶胞中含有8个碳原子,最小的碳环为6元环,并且不在同一平面(实际为椅 式结构),碳原子为sp 3杂化,每个C 以共价键跟相邻的_4_个C 结合,形成正四面体。
键角109°28’b 、每个碳原子被12个六元环共用,每个共价键被6个六元环共用c 、12g 金刚石中有2mol 共价键,碳原子与共价键之比为 1:2 (2)Si 晶体由于Si 与碳同主族,晶体Si 的结构同金刚石的结构。

大学化学常见晶胞模型介绍晶胞模型是研究固体结构和晶体性质的基础。
本文将介绍几种常见的晶胞模型,帮助大学化学研究者更好地理解晶体结构和性质。
简单立方模型简单立方模型是一种简化的晶胞模型,用于描述一些简单的晶体结构。
它由八个立方角共享的原子构成。
每个原子都与六个相邻原子相连,形成一个立方结构。
这种简单的晶体结构适用于一些金属元素,如铁、钠等。
面心立方模型面心立方模型是一种常见的晶胞模型,常用于描述许多金属和化合物的结构。
它由八个立方角共享的原子和每个面上一个原子构成。
每个原子都与十二个相邻原子相连,形成一个紧密堆积的结构。
这种晶体结构具有较高的密度和机械强度。
体心立方模型体心立方模型也是一种常见的晶胞模型,常用于描述一些金属元素和化合物的结构。
它由八个立方角共享的原子和一个位于晶胞中心的原子构成。
每个原子都与八个相邻原子相连,形成一个更紧密的结构。
这种晶体结构同样具有较高的密度和机械强度。
面心体心立方模型面心体心立方模型是一种较复杂的晶胞模型,常用于描述一些化合物的结构。
它由八个立方角共享的原子、每个面上一个原子和一个位于晶胞中心的原子构成。
每个原子都与十四个相邻原子相连,形成一个更加紧密的结构。
这种晶体结构具有更高的密度和较好的热力学性质。
总结通过了解这几种常见的晶胞模型,我们可以更好地理解不同结构的晶体的特点和性质。
化学研究者可以通过进一步研究这些模型,扩展对晶胞结构和晶体性质的认识。
以上即为大学化学常见晶胞模型的介绍。
---注意:以上内容为简化表述,不涉及具体晶胞参数和具体晶体结构的分析。
七大晶系详细图解已知晶体的形态已经超过了四万种,但是万物都会有规律,晶体自然也是有的。
它们都是按七种结晶方式模式发育的,即七大晶系.晶体即是一种以三维方向发育的的几何体,为了表示三维空间,分别用三、四跟人为添加的轴来表示晶体的长宽高以及中心.三条轴分别用X、Y、Z(U)(Z轴也可叫做“主轴")来表示,而为了更好表示轴之间的度数,我们用α、β、γ来表示轴角。
就这样出现了七种不同的晶系模式:立方晶系(也称等轴晶系)、四方晶系、三方晶系、六方晶系、正交晶系(也称斜方晶系)、单斜晶系、三斜晶系。
其中又按照对称程度又分为高级晶族、中级晶族、低级晶族。
高级晶族中只有一个立方晶系;中级晶族有六方、四方、三方三个晶系;低级晶族有正交、单斜、三斜三个晶系。
一、立方晶系立方晶系的三个轴的长度是一样的,即X=Y=Z,且互相垂直,即α=β=γ=90°,对称性最强。
具有4个立方体对角线方向三重轴特征对称元素的晶体归属立方晶系.属于立方晶系的有:面心立方晶胞、体心立方晶胞、简单立方晶胞。
这个晶系的晶体并不是只有狭义的正方体一种形状,四面体、八面体、十二面体形状的晶体都属于立方晶系。
它们从不同角度看高低宽窄都差不太多,相对晶面和相邻晶面都相似,横截面和竖截面一样.最典型立方晶系的晶体为:氯化钠。
常见立方晶系晶体模型图:晶体实物图:二、四方晶系四方晶系四方晶系的三条晶轴互相垂直,即α=β=γ=90°。
其中两个水平轴(X 轴、Y轴)长度一样,Z轴的长度可长可短,通俗的说:四方晶系的晶体大多是四棱的柱状体,有的是长柱体,有的是短柱体,即其晶胞必具有四方柱的形状.横截面为正方形,四个柱面是对称的,即相邻和相对的柱面都是一样的,但和顶端不对称.所有主晶面交角都是90.特征对称元素为四重轴。
如果Z轴发育,它就是长柱状甚至针状;如果两个横轴(X轴、Y轴)发育大于Z轴,那么晶体就会呈现四方板状,最有代表的就是磷酸二氢钠和硫酸镍β了.常见的立方晶系的晶体模型图:注:柱体的棱角发育成窄小晶面,此种晶体又叫“复四方"-—四个主柱面,四个小柱面。
七大晶系详细图解已知晶体的形态已经超过了四万种,但是万物都会有规律,晶体自然也是有的。
它们都是按七种结晶方式模式发育的,即七大晶系。
晶体即是一种以三维方向发育的的几何体,为了表示三维空间,分别用三、四跟人为添加的轴来表示晶体的长宽高以及中心。
三条轴分别用X、Y、Z(U)(Z轴也可叫做“主轴”)来表示,而为了更好表示轴之间的度数,我们用α、β、γ来表示轴角。
就这样出现了七种不同的晶系模式:立方晶系(也称等轴晶系)、四方晶系、三方晶系、六方晶系、正交晶系(也称斜方晶系)、单斜晶系、三斜晶系。
其中又按照对称程度又分为高级晶族、中级晶族、低级晶族。
高级晶族中只有一个立方晶系;中级晶族有六方、四方、三方三个晶系;低级晶族有正交、单斜、三斜三个晶系。
一、立方晶系立方晶系的三个轴的长度是一样的,即X=Y=Z,且互相垂直,即α=β=γ=90°,对称性最强。
具有4个立方体对角线方向三重轴特征对称元素的晶体归属立方晶系。
属于立方晶系的有:面心立方晶胞、体心立方晶胞、简单立方晶胞。
这个晶系的晶体并不是只有狭义的正方体一种形状,四面体、八面体、十二面体形状的晶体都属于立方晶系。
它们从不同角度看高低宽窄都差不太多,相对晶面和相邻晶面都相似,横截面和竖截面一样。
最典型立方晶系的晶体为:氯化钠。
常见立方晶系晶体模型图:晶体实物图:二、四方晶系四方晶系四方晶系的三条晶轴互相垂直,即α=β=γ=90°。
其中两个水平轴(X 轴、Y轴)长度一样,Z轴的长度可长可短,通俗的说:四方晶系的晶体大多是四棱的柱状体,有的是长柱体,有的是短柱体,即其晶胞必具有四方柱的形状。
横截面为正方形,四个柱面是对称的,即相邻和相对的柱面都是一样的,但和顶端不对称。
所有主晶面交角都是90。
特征对称元素为四重轴。
如果Z轴发育,它就是长柱状甚至针状;如果两个横轴(X轴、Y轴)发育大于Z轴,那么晶体就会呈现四方板状,最有代表的就是磷酸二氢钠和硫酸镍β了。
1.原子晶体(金刚石和二氧化硅)(1) 金刚石晶体中,每个C与另外4个C形成共价键,C—C 键之间的夹角是109°28′,最小的环是六元环。
含有1 mol C的金刚石中,形成的共价键有2 mol。
(2) SiO2晶体中,每个Si原子与4个O成键,每个O原子与2个硅原子成键,最小的环是十二元环,在“硅氧"四面体中,处于中心的是Si原子。
2.分子晶体(1) 干冰晶体中,每个CO2分子周围等距且紧邻的CO2分子有12个。
(2)冰的结构模型中,每个水分子与相邻的4个水分子以氢键相连接,含1 mol H2O的冰中,最多可形成2 mol“氢键”。
3.离子晶体(1)NaCl型:在晶体中,每个Na+同时吸引6个Cl-,每个Cl -同时吸引6个Na+,配位数为6.每个晶胞含4个Na+和4个Cl-。
(2) CsCl型:在晶体中,每个Cl-吸引8个Cs+,每个Cs+吸引8个Cl-,配位数为8。
4.石墨晶体石墨层状晶体中,层与层之间的作用是分子间作用力,平均每个正六边形拥有的碳原子个数是2,C原子采取的杂化方式是sp2。
5.常见金属晶体的原子堆积模型结构型式常见金属配位数晶胞面心立方最密Cu、Ag、Au12堆积A1体心立方堆积A2Na、K、Fe8六方最密堆积A3Mg、Zn、Ti12特别提醒(1) 判断某种微粒周围等距且紧邻的微粒数目时,要注意运用三维想象法。
如NaCl晶体中,Na+周围的Na+数目(Na+用“○”表示):每个面上有4个,共计12个.(2)常考的几种晶体主要有干冰、冰、金刚石、SiO2、石墨、CsCl、NaCl、K、Cu等,要熟悉以上代表物的空间结构。
当题中信息给出与某种晶体空间结构相同时,可以直接套用某种结构.典例硅是重要的半导体材料,构成了现代电子工业的基础.回答下列问题:(1) 基态Si原子中,电子占据的最高能层符号为,该能层具有的原子轨道数为,电子数为。
(2) 硅主要以硅酸盐、等化合物的形式存在于地壳中。
七大晶系详细图解一、四方晶系四方晶系四方晶系的三条晶轴互相垂直,即α=β=γ=90°。
其中两个水平轴(X 轴、Y轴)长度一样,Z轴的长度可长可短,通俗的说:四方晶系的晶体大多是四棱的柱状体,有的是长柱体,有的是短柱体,即其晶胞必具有四方柱的形状。
横截面为正方形,四个柱面是对称的,即相邻和相对的柱面都是一样的,但和顶端不对称。
所有主晶面交角都是90。
特征对称元素为四重轴。
如果Z轴发育,它就是长柱状甚至针状;如果两个横轴(X轴、Y轴)发育大于Z轴,那么晶体就会呈现四方板状,最有代表的就是磷酸二氢钠和硫酸镍β了。
常见的立方晶系的晶体模型图:注:柱体的棱角发育成窄小晶面,此种晶体又叫“复四方”——四个主柱面,四个小柱面。
晶体实物图:三、斜方晶系斜方晶系的晶体中三个轴的长短完全不相等,它们的交角仍然是互为90度垂直。
即X≠Y≠Z。
Z轴和Y轴相互垂直90°。
X轴与Y轴垂直,但是不与Z轴垂直,即α=γ=90,β>90°与正方晶系直观相比,区别就是:x轴、y轴长短不一样。
如果围绕z轴旋转,四方晶系旋转九十度即可使x轴y轴重合,旋转一周使x轴y轴重合四次(使另两轴重合的次数多于两次,该轴称“高次轴”),四方晶系有一个高次轴,也叫“主轴”。
斜方晶系围绕z轴旋转,需180度才可使x轴y 轴重合,旋转一周只重合两次,属低次轴。
也就是说,斜方晶系的对称性比四方晶系要低。
特征对称元素是二重对称轴或对称面。
其实,斜方晶系的晶体如果围绕x轴或y轴旋转,情况与围绕z轴旋转相同。
换句话说,斜方晶系没有高次轴,或曰没有理论上的主轴。
从模型上看,四方晶系的x轴和y轴所指向的晶面完全都是对称相同的,斜方晶系的x轴和y轴所指向的晶面却是各自相等的。
常见立方晶系模型图:斜方晶系晶体两个轴(如x轴、y轴)构成的平面,即晶体横截面是长方形,也可以是菱形,或者两者的复合形,如下图:晶体实物图:四、单斜晶体单斜晶系的三个晶轴长短皆不一样,即X≠Y≠Z。