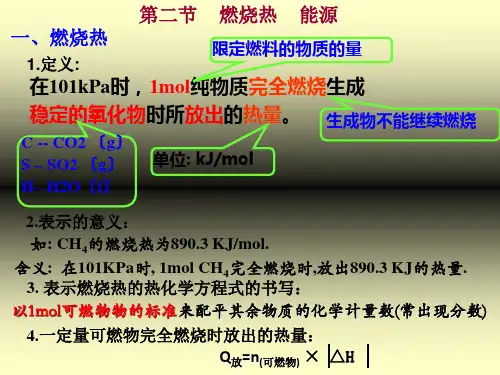
1.条件: 25℃,101KPa
2.标准:1mol物质
3.要求:完全燃烧,生成稳定的化合物
4.符号: △H为“-”或△H <0
5.单位:kJ/mol
C→CO2,而不是CO
S→SO2,而不是SO3
H2→H2O(l)而不是H2O(g),
燃烧热与中和热的区别与联系
相 同 能量变化 点 ΔH
反应物的量
燃烧热
不相同,因为石墨与金刚石的晶体结构不同,具有 的能量也不相同 不相同,因为石墨与金刚石的晶体结构不同,共具有的能 量也不相同 C(石墨s)+ O2(g)= CO2(g) ΔH= -393.5 kl/mol C(金刚石s)+ O2(g)= CO2(g) ΔH= -395.0 kl/mol
说明金刚石具有的总能量高,不稳定
①2H2(g) + O2(g) = 2H2O(l) ΔH =-571.6kJ/mol
Or ②H2(g) + 1/2O2(g) = H2O(l)
ΔH =-285.8 kJ/mol
。
其中的ΔH 能表示其燃烧热的是 ② 。
3、参照数据讨论: 石墨与金刚石的燃烧热是否相同,为什么?
从燃烧热数据可判断哪个更稳定吗?
ΔH=-110.5kJ/mol ΔH= + 393.5kJ/mol
C. C(s)+O2(g) = CO2(g) ΔH=-393.5 kJ
D. C(s)+O2(g) = CO2(g)
条件:25℃,101KPa
ΔH=-393.5 kJ/mol
各物质状态
练习2:下列热化学方程式中 ΔH 的数值能表示 可燃物燃烧热的是
名称 化学式 ΔH/kJ/mol
乙烷 C2H6(g) -1559.8 乙烯 C2H4(g) -1411.0 乙炔 C2H2(g) -1299.6 乙醇 C2H5OH(l) -1366.8 丙烷 C3H8(g) -2219.9 苯 C6H6(l) -3267.5