植物组织中总糖和还原糖含量的测定
- 格式:ppt
- 大小:145.00 KB
- 文档页数:22


植物中还原糖含量测定
植物中的还原糖是指一类可以还原铜离子的碳水化合物,主要包括葡萄糖、果糖和蔗糖等。
在植物中,还原糖是一种重要的营养物质,也是植物代谢的重要产物。
测定植物中的还原糖含量对于了解植物的生长发育和代谢状态具有重要意义。
测定植物中的还原糖含量通常采用硫酸酚法或硫酸亚铁法。
硫酸酚法是将植物样品加入酚和硫酸,经过加热后,还原糖与酚反应生成有色产物,然后用比色法测定产物的吸光度,从而计算出还原糖的含量。
硫酸亚铁法是将植物样品加入硫酸亚铁溶液,还原糖与亚铁离子反应生成蓝色络合物,然后用比色法测定产物的吸光度,计算出还原糖的含量。
通过测定植物中的还原糖含量,可以了解植物的生长发育和代谢状态。
在植物生长过程中,还原糖的含量会受到光照、温度、水分等环境因素的影响,因此还原糖含量的变化可以反映植物对环境的适应能力。
此外,还原糖也是植物的能量来源之一,其含量的变化还可以反映植物的养分代谢和能量代谢状态。
总之,测定植物中的还原糖含量对于研究植物生长发育和代谢
具有重要意义,可以为植物生理生态学研究提供重要的数据支持。
同时,还原糖的含量变化也可以为农业生产提供参考,帮助农民更好地管理和调控作物的生长。
因此,加强对植物中还原糖含量的测定研究具有重要的理论和应用价值。

植物组织中还原糖含量的测定(3,5–二硝基水杨酸法一、实验目的通过本实验,掌握还原糖定量测定的基本原理,学习比色定糖法的基本操作。
二、实验原理3,5–二硝基水杨酸与还原糖共热后被还原成棕红色物质(即3–氨基–5–硝基水杨酸,该物质在540nm波长处有最大吸收。
在一定浓度范围内,还原糖的量与棕红色物质的光吸收值成正比例关系,利用比色法可定量测定样品中的含糖量。
三、实验仪器、试剂和材料1.仪器:25ml刻度试管、离心管或漏斗、三角瓶、容量瓶、刻度吸管、离心机、分光光度计等。
2.试剂:1mg/ml葡萄糖标准液、3,5–二硝基水杨酸3.材料:食用面粉四、实验操作步骤1、葡萄糖标准曲线的制作取7支干燥洁净的25ml刻度试管或大试管,编号,按下表准确加样:0 1 2 3 4 5 6管号葡萄糖标0 0.2 0.4 0.6 0.8 1.0 1.2准液/ml蒸馏水/ml 2.0 1.8 1.6 1.4 1.2 1.0 0.83,5–二硝基水杨1.5 1.5 1.5 1.5 1.5 1.5 1.5酸/mlA540 nm将各管摇匀,在沸水浴中加热5min,取出后立即放入盛有冷水的烧杯中冷却至室温,再以蒸馏水定容至25ml,加塞后颠倒混匀。
在540nm波长下,用0号管为参比管调零,分别读取各管的吸光度(A540nm。
以吸光度为纵坐标,葡萄糖毫克数为横坐标绘制标准曲线。
2、样品中还原糖的提取准确称取1.5g食用面粉,放在小锥形瓶中,先以少量蒸馏水调成糊状,然后加25ml蒸馏水,搅匀,置于50℃恒温水浴中保温20min,然后将锥形瓶中内容物转入一个50mL容量瓶中,用蒸馏水定容至刻度。
充分混合,过滤,滤液即为还原糖待测液。
3、样品含糖量的测定分别取2ml还原糖待测液于两支刻度试管或大试管中,然后各加3,5–二硝基水杨酸1.5ml。
其余操作与制作葡萄糖标准曲线时相同。
测定各管吸光度。
五、实验结果处理以上述还原糖待测液的吸光度平均值,在标准曲线上查出相应的还原糖毫克数。

植物还原糖和总糖的测定实验报告实验目的:本实验旨在通过测定植物中还原糖和总糖的含量,了解植物中糖的组成和含量,并掌握测定糖的方法。
实验原理:还原糖是指具有还原性的糖类物质,例如葡萄糖、果糖等。
总糖是指所有糖类物质的总和,包括还原糖和非还原糖。
本实验测定还原糖和总糖的方法是利用硫酸铜和碱性硫脲试剂的反应。
还原糖能够将硫酸铜(CuSO4)还原成氧化亚铜(Cu2O),从而产生红色沉淀。
而非还原糖则不能起到还原作用,因此不会产生红色沉淀。
实验材料和仪器:材料:植物样品、蒸馏水、硫酸铜溶液、碱性硫脲试剂溶液、氯仿、无水乙醇。
仪器:试管、移液管、离心机、恒温水浴。
实验步骤:1. 将植物样品研磨成细粉。
2. 取适量植物样品加入试管中,并加入适量蒸馏水,使样品完全浸没。
3. 将试管放入恒温水浴中加热,使水浴温度保持在70℃左右,加热30分钟,使植物中的糖充分溶解。
4. 将试管取出,冷却至室温。
5. 取1 mL植物提取液加入新的试管中,加入1 mL硫酸铜溶液,混匀。
6. 加入2 mL碱性硫脲试剂溶液,混匀。
7. 加入10 mL氯仿,并用离心机离心5分钟,分离出氯仿层。
8. 将氯仿层转移至干净的试管中,加入2 mL无水乙醇,混匀。
9. 加热试管,使氯仿和乙醇挥发,得到含有还原糖的溶液。
10. 将溶液转移到比色皿中,使用分光光度计测定溶液的吸光度,记录吸光度值A1。
计算结果:1. 计算还原糖的含量:根据实验原理可知,还原糖的含量与吸光度呈线性关系。
根据已知浓度的标准溶液制作一系列不同浓度的还原糖标准曲线,通过测定待测溶液的吸光度,可以根据标准曲线确定还原糖的含量。
2. 计算总糖的含量:首先将植物提取液进行酶解,将非还原糖转化为还原糖,然后按照上述方法测定还原糖的含量。
最后,将还原糖的含量乘以一个修正系数,即可得到总糖的含量。
实验结果:根据实验步骤测定,得到待测溶液的吸光度值A1为X。
通过标准曲线,可以确定还原糖的含量为Y。

实验一还原糖和总糖的测定姓名:李凯学号:5603115053一、实验目的1、掌握还原糖和总糖测定的基本原理2、学习比色法测定还原糖的操作方法和分光光度计的使用二、实验原理还原糖的测定是糖定量测定的基本方法。
还原糖是指含有自由醛基或酮基的糖类,单糖都是还原糖,双糖和多糖不一定是还原糖,其中乳糖和麦芽糖是还原糖,蔗糖和淀粉是非还原糖。
利用糖的溶解度不同,可将植物样品中的单糖、双糖和多糖分别提取出来,对没有还原性的双糖和多糖,可用酸水解法使其降解成有还原性的单糖进行测定,再分别求出样品中还原糖和总糖的含量(还原糖以葡萄糖含量计)。
还原糖在碱性条件下加热可被氧化成糖酸及其它产物,而氧化剂3,5-二硝基水杨酸则被还原为棕红色的3-氨基-5-硝基水杨酸。
在一定范围内,还原糖的量与棕红色物质颜色的深浅成正比关系,利用分光光度计在540nm波长下测定光密度值,查对标准曲线并计算,便可求出样品中还原糖和总糖的含量。
由于多糖水解为单糖时,每断裂一个糖苷键需加入一分子水,所以在计算多糖含量时应乘以系数0.9。
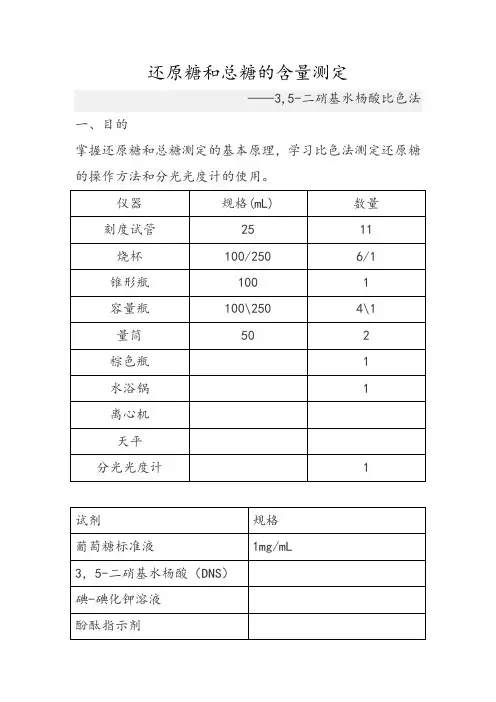
三、实验材料和试剂1、实验材料面粉2、实验试剂①1mg/ml葡萄糖标准液②3,5-二硝基水杨酸(DNS)试剂③碘-碘化钾溶液:④酚酞指示剂:⑤6M HCl和6M NaOH四、实验器材具塞玻璃刻度试管,50ml离心管,100ml烧杯,100ml 三角瓶,100ml容量瓶,移液管:1ml;2ml;10ml,恒温水浴锅,离心机,天平,分光光度计。
五、操作步骤1、制作葡萄糖标准曲线取7支具塞刻度试管编号,按表1分别加入浓度为1mg/ml的葡萄糖标准液、蒸馏水和DNS试剂,配成不同浓度的葡萄糖反应液。
将各管摇匀,在沸水浴中准确加热5min取出,冷却至室温,用蒸馏水补足至10ml,加塞后颠倒混匀,在分光光度计上进行比色。
调波长540nm,用0号管调零点,分别测出1~6号管的光密度值。
以光密度值为纵坐标,葡萄糖含量(mg)为横坐标,在坐标纸上绘出标准曲线。
还原糖和总糖的含量测定材料:小麦面粉;精密pH 试纸四、操作步骤1. 制作葡萄糖标准曲线取7支20mL 具塞刻度试管编号,按表1分别加入浓度为1mg/mL 的葡萄糖标准液、蒸馏水和3,5-二硝基水杨酸(DNS)试剂,配成不同葡萄糖含量的反应液。
表1 葡萄糖标准曲线制作2. 样品中还原糖和总糖的测定(1)还原糖的提取准确称取3.00g 食用面粉,放入100mL 烧杯中,先用少量蒸馏水调成糊状,然后加入50mL 蒸馏水,搅匀,置于50℃恒温水浴中保温20min,使还原糖浸出。
将浸出液(含沉淀)转移到50mL 离心管中,于4000r/min下离心5min,沉淀可用20mL 蒸馏水洗一次,再离心,将二次离心的上清液收集在100mL容量瓶中,用蒸馏水定容至刻度,混匀,作为还原糖待测液。
(2)总糖的水解和提取准确称取1.00g食用面粉,放入100mL三角瓶中,加15mL 蒸馏水及10mL 6M HCl,置沸水浴中加热水解30min(水解是否完全可用碘-碘化钾溶液检查)。
待三角瓶中的水解液冷却后,加入1 滴酚酞指示剂,用6mol/LNaOH 中和至微红色,用蒸馏水定容在100mL容量瓶中,混匀。
将定容后的水解液过滤,取滤液10mL,移入另一100mL容量瓶中定容,混匀,作为总糖待测液。
(3)显色和比色取4支20mL 具塞刻度试管,编号,按表2 所示分别加入待测液和显色剂,空白调零可使用制作标准曲线的0号管。
加热、定容和比色等其余操作与制作标准曲线相同。
五、结果与计算:计算出7、8号管光密度值的平均值和9、10管光密度值的平均值,在标准曲线上分别查出相应的还原糖毫克数,按下式计算出样品中还原糖和总糖的百分含量。

总糖和还原糖的测定──3,5-二硝基水杨酸法目的要求:掌握还原糖和总糖的测定原理,学习用比色法测定还原糖的方法。
实验原理:在NaOH和丙三醇存在下,3,5-二硝基水杨酸(DNS)与还原糖共热后被还原生成氨基化合物。
在过量的NaOH碱性溶液中此化合物呈桔红色,在540nm波长处有最大吸收,在一定的浓度范围内,还原糖的量与光吸收值呈线性关系,利用比色法可测定样品中的含糖量。
黄色桔红色试剂和器材一、试剂3,5-二硝基水杨酸(DNS)试剂:称取6.5g DNS溶于少量热蒸馏水中,溶解后移入1000ml容量瓶中,加入2mol/L氢氧化钠溶液325ml,再加入45g丙三醇,摇匀,冷却后定容至1000ml。
葡萄糖标准溶液:准确称取干燥恒重的葡萄糖200mg,加少量蒸馏水溶解后,以蒸馏水定容至100ml,即含葡萄糖为2.0mg/ml。
6mol/L HCl:取250ml浓HCl(35%~38%)用蒸馏水稀释到500ml。
碘-碘化钾溶液:称取5g碘,10g碘化钾溶于100ml蒸馏水中。
6N NaOH:称取120g NaOH溶于500ml蒸馏水中。
0.1% 酚酞指示剂。
二、材料藕粉,小麦淀粉或玉米淀粉。
三、器材723PC、S22型分光光度计,天平,水浴锅,电炉,试管若干等。
一、葡萄糖标准曲线制作取5支15mm×180mm试管,按下表加入2.0mg/ml葡萄糖标准液和蒸馏水。
管号葡萄糖标准液蒸馏水葡萄糖含量OD540 /ml /ml /mg0 1 00.210.80.42 0.4 0.6 0.83 0.6 0.4 1.24 0.8 0.2 1.65 1 0 2操作方法在上述试管中分别加入DNS试剂2.0ml,于沸水浴中加热2min进行显色,取出后用流动水迅速冷却,各加入蒸馏水9.0ml,摇匀,在540nm波长处测定光吸收值。
以1.0ml蒸馏水代替葡萄糖标准液按同样显色操作为空白调零点。
以葡萄糖含量(mg)为横坐标,光吸收值为纵坐标,绘制标准曲线。

植物组织中总糖和还原糖含量的测定(蒽酮比色法)2010-5-24一、实验目的掌握蒽酮比色法测定总糖和还原糖含量的原理和方法,学会正确使用分光光度计。
二、实验原理游离的己糖或多糖中的己糖基、戊糠醛及己糖醛酸在浓硫酸的作用下脱水生成糠醛衍生物,糠醛衍生物与蒽酮缩合成蓝色的化合物,在620nm处有最大吸收,在一定糖浓度范围内(200ug/ml),溶液吸光度值与糖溶液的浓度成线性关系。
用酸将植物组织中没有还原性的多糖和寡糖彻底水解成具有还原性的单糖,或直接提取植物组织中的还原糖,即可对植物组织中的总糖和还原糖进行定量测定。
三、实验材料1.可见分光光度计、电子天平(1/100)、粉碎机、水浴锅、电炉。
2.研钵、量筒、三角烧瓶、烧杯、容量瓶、玻璃漏斗、试管1.5cm×15cm、刻度吸管、胶头滴管、pH试纸、坐标纸。
3.植物原料,如银耳、木耳、菜叶等。
四、实验试剂1.蒽酮试剂:取2g蒽酮溶于l000ml体积分数为80%的硫酸中,当日配制使用。
2.标准葡萄糖溶液(0.1mg/m1):称取100mg葡萄糖,溶于蒸馏水并稀释至1 000ml(可滴加几滴甲苯作防腐剂)。
3.6mol/L HCl溶液:50ml盐酸,加水至100ml。
4.10%NaOH溶液:称取10g NaOH固体,溶于蒸馏水并稀释至100ml。
五、操作步骤1.葡萄糖标准曲线的绘制取干净试管6支,按下表进行操作。
以吸光度为纵坐标,各标准液浓度(mg/m1)为横坐标做图。
2.样品中还原糖的提取和测定称取植物原料干粉0.1~0.5g,加水约3ml,在研钵中磨成匀浆,转入三角烧瓶中,并用约30ml的蒸馏水冲洗研钵2~3次,洗出液也转入三角烧瓶中。
于50℃水浴中保温半小时(使还原糖浸出),取出,冷却后定容至100ml。
过滤,取lml滤液进行还原糖的测定:吸取lml总糖类溶液置试管中,浸于冰浴中冷却,再加入4ml蒽酮试剂,沸水浴中准确加热10min,取出用自来水冷却后比色,其他条件与做标准曲线相同,测得的吸光度值由标准曲线查算出样品液的糖含量。
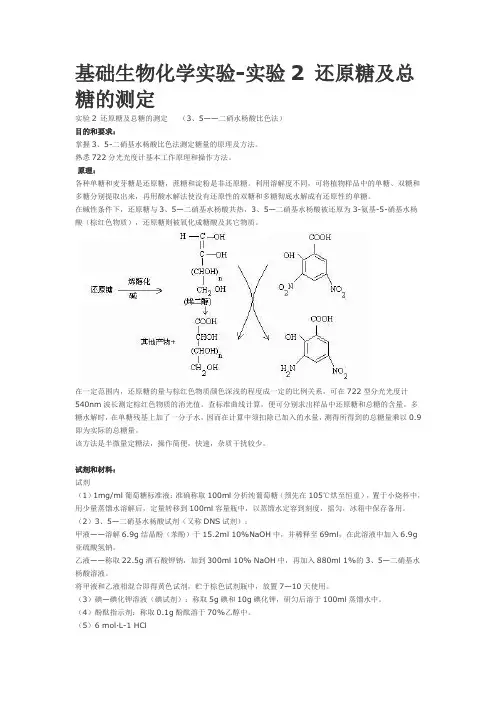
基础生物化学实验-实验2 还原糖及总糖的测定实验2 还原糖及总糖的测定(3、5——二硝水杨酸比色法)目的和要求:掌握3、5-二硝基水杨酸比色法测定糖量的原理及方法。
熟悉722分光光度计基本工作原理和操作方法。
原理:各种单糖和麦芽糖是还原糖,蔗糖和淀粉是非还原糖。
利用溶解度不同,可将植物样品中的单糖、双糖和多糖分别提取出来,再用酸水解法使没有还原性的双糖和多糖彻底水解成有还原性的单糖。
在碱性条件下,还原糖与3、5—二硝基水杨酸共热,3、5—二硝基水杨酸被还原为3-氨基-5-硝基水杨酸(棕红色物质),还原糖则被氧化成糖酸及其它物质。
在一定范围内,还原糖的量与棕红色物质颜色深浅的程度成一定的比例关系,可在722型分光光度计540nm波长测定棕红色物质的消光值。
查标准曲线计算,便可分别求出样品中还原糖和总糖的含量。
多糖水解时,在单糖残基上加了一分子水,因而在计算中须扣除已加入的水量,测得所得到的总糖量乘以0.9即为实际的总糖量。
该方法是半微量定糖法,操作简便,快速,杂质干扰较少。
试剂和材料:试剂(1)1mg/ml葡萄糖标准液:准确称取100ml分析纯葡萄糖(预先在105℃烘至恒重),置于小烧杯中,用少量蒸馏水溶解后,定量转移到100ml容量瓶中,以蒸馏水定容到刻度,摇匀,冰箱中保存备用。
(2)3、5—二硝基水杨酸试剂(又称DNS试剂);甲液——溶解6.9g结晶酚(苯酚)于15.2ml 10%NaOH中,并稀释至69ml,在此溶液中加入6.9g 亚硫酸氢钠。
乙液——称取22.5g酒石酸钾钠,加到300ml 10% NaOH中,再加入880ml 1%的3、5—二硝基水杨酸溶液。
将甲液和乙液相混合即得黄色试剂,贮于棕色试剂瓶中,放置7—10天使用。
(3)碘—碘化钾溶液(碘试剂):称取5g碘和10g碘化钾,研匀后溶于100ml蒸馏水中。
(4)酚酞指示剂:称取0.1g酚酞溶于70%乙醇中。
(5)6 mol·L-1 HCl(6)6 mol·L-1NaOH(7)面粉2、器材大试管、大离心管、量筒、三角瓶、容量瓶、刻度吸管、玻璃漏斗、滤纸、白瓷板、电热恒温水浴槽、低速台式离心机、天平、722型分光光度计。

《生物化学》实验指导书适用专业:生物科学、食品科学、生物工程、农学、园艺、环境科学孝感学院生命科学与技术学院生物化学实验细则为了保证生物化学实验的顺利进行,培养同学们掌握良好、规范的生物化学基本实验技能,特制定以下实验细则,请同学们严格遵守。
1. 实验前应提前预习实验指导书并复习相关知识。
2. 严格按照生物化学实验分组,分批进入实验室,不得迟到。
非本实验组的同学不准进入实验室。
3. 进入实验室必须穿实验服。
各位同学进入各自实验小组实验台后,保持安静,不得大声喧哗和嬉戏,不得无故离开本实验台随便走动。
绝对禁止用实验仪器或药物嬉耍。
4. 实验中应保持实验台的整洁,废液倒入废液桶中,用过的滤纸放入垃圾桶中,禁止直接倒入水槽中或随地乱丢。
5. 实验中要注意节约药品与试剂,爱护仪器,使用前应了解使用方法,使用时要严格遵守操作规程,不得擅自移动实验仪器。
否则,因非实验性损坏,由损坏者赔还。
6. 使用水、火、电时,要做到人在使用,人走关水、断电、熄火。
7. 做完实验要清洗仪器、器皿,并放回原位,擦净桌面。
8. 实验后,要及时完成实验报告。
目录实验一还原糖和总糖的测定——3,5-二硝基水杨酸比色法...............................1实验二油脂酸价的测定............................................................5实验三蛋白质的提取及浓度测定¬(紫外吸收法)........................................7实验四淀粉酶活力的测定...........................................................9实验五酶的激活和抑制作用......................................................13实验六氨基酸的分离鉴定――纸层析法............................................14实验七基因组DNA的快速提取---碘化钾法........................................16实验八琼脂糖凝胶电泳技术――DNA样品检测.....................................18实验一还原糖和总糖的测定——3,5-二硝基水杨酸比色法一、目的与要求掌握还原糖和总糖测定的基本原理,学习比色法测定还原糖的操作方法和分光光度计的使用。

DNS法测定植物组织中还原糖及总糖含量实验的改进作者:查岭生胡鹏等来源:《安徽农学通报》2013年第11期摘要:针对现有生物化学实验“DNS法测定植物组织中还原糖及总糖含量”中的一些不足进行改进,包括实验材料选择、波长选择、DNS量、显色时间、DNS的配制等方面,最后对实验中一些注意事项进行了详细分析,以提高该实验的教学效果。
关键词:DNS法;实验教学;还原糖;改进中图分类号 Q547 文献标识码 B 文章编号 1007-7731(2013)11-16-023,5-二硝基水杨酸法(DNS法)是在碱性条件下,DNS与还原糖加热后被还原成橘红色氨基化合物,然后比色测定糖含量。
该法可测定还原糖和总糖含量,并可通过多糖=总糖-还原糖,粗略获得多糖含量。
相比之下,该方法具有操作简便、快速、灵敏度高、杂质干扰较小等优点[1-9]。
“DNS法测定植物组织中还原糖及总糖含量”实验涉及了一些基本的生物化学实验技能,如组织捣碎(或研磨)、离心技术、定容操作、比色测定及标准曲线绘制等。
该实验能有效提高学生的基本操作技能和动手能力,同时能将理论知识与实际应用很好地结合在一起。
实验的学时及难度适中,在生物化学实验中是一项很好的综合性实验。
笔者根据多年来实验教学经验总结,现对该实验相关步骤进行改进,并对实验中值得注意的地方进行详细总结,以提高其教学效果。
1 方法改进1.1 实验材料选择多数生物化学实验教材中的该实验对象为淀粉[1-5]。
淀粉作为实验材料的缺点主要有:(1)还原糖含量一般很低(如红薯淀粉);(2)不同淀粉的还原糖含量也不一样;(3)材料本身缺乏可操作性等。
本着材料来源容易,还原糖含量高,色素影响小,易提取,能有效提高学生的动手能力和激发实验兴趣,理论与实际应用有效结合等各方面的因素,结合多年来的实验经验积累,认为白薯(又名“地瓜”)为最佳实验材料。
1.2 波长选择考虑到DNS显色液的影响、葡萄糖标准曲线的线性和最大吸收值等相关因素[6,10-11],多年来本科实验教学结果证明520nm为最适测定波长。
果蔬中总糖及还原糖含量的测定一、实验目的1、掌握总糖和还原糖含量的测定方法。
2、学习分光光度计的原理和操作方法。
3、了解蒽酮法测定可溶性糖含量的原理。
二、实验原理总糖是指样品中的还原单糖及在本实验条件下能水解成还原单糖的蔗糖、麦芽糖和可部分水解成葡萄糖的淀粉。
多糖为非还原糖,可用酸将没有还原性的多糖和寡糖彻底水解成具有还原性的单糖,再利用还原糖的性质进行测定,这样就可分别求出总糖和还原糖的含量。
糖在浓硫酸作用下,可经脱水反应生成糖醛,生成的糖醛或羟甲基糖醛可与蒽酮反应生成蓝绿色糖醛衍生物,在一定范围内,颜色的深浅与糖的含量成正比。
糖类与蒽酮反应生成的有色物质,在可见光区的吸收峰为630nm,可在此波长下进行比色,故可用于糖的定量。
三、实验器材1、材料:梨2、仪器:分光光度计、恒温水浴锅、电子分析天平、高速冷冻离心机、容量瓶(100mL×2)、玻璃漏斗、量筒、研钵、锥形瓶、试管、移液管、pH试纸3、试剂:蒽酮试剂:取2g蒽酮溶于1000mL体积分数为80%的硫酸中,当日配制使用。
标准葡萄糖溶液(0.1mg/mL):称取100mg葡萄糖,溶于蒸馏水并稀释至1000mL(可加几滴甲苯作防腐剂)。
6mol/L HCl溶液20% NaOH溶液:称取20g NaOH固体,溶于蒸馏水并稀释至100mL。
四、实验操作1、葡萄糖标准曲线的绘制:取6 支大试管,从0 ~ 5 分别编号,按下表加入各试剂以吸光度为纵坐标,各标准液浓度(mg/mL )为横坐标做图得标准曲线。
2、样品中还原糖的提取和测定称取1g 梨,加蒸馏水约3mL ,在研钵中磨成匀浆,转入三角烧瓶中,并用约12mL 蒸馏水冲洗研钵2~3次,洗出液也转入三角烧瓶中。
于50℃水浴中保温约30min (使还原糖浸出),取出置于离心管内,5000r/min 离心10min ,冷却后定容至100mL 。
吸取1mL 滤液置于试管中,浸于冰浴中冷却,再加入4mL 蒽酮试剂,沸水浴中煮沸10min ,取出冷却后比色,其他条件与做标准曲线相同。
还原糖和总糖的测定
还原糖和总糖的测定是食品分析中常用的方法之一。
还原糖是指能够被还原剂还原成相应糖醇的单糖和少量的双糖,如葡萄糖、果糖、麦芽糖等。
而总糖则包括还原糖和不可还原糖,如蔗糖、乳糖、淀粉等。
还原糖的测定方法主要是利用还原剂将还原糖还原成相应的糖醇,然后用比色法或滴定法测定还原糖的含量。
其中,最常用的还原剂是菲林试剂,它能够将还原糖还原成蓝色的菲林铁络合物。
而比色法则是利用分光光度计测定菲林铁络合物的吸光度,从而计算出还原糖的含量。
总糖的测定方法则需要先将不可还原糖水解成还原糖,然后再进行还原糖的测定。
水解方法主要有酸水解和酶水解两种。
其中,酸水解是将样品加入稀酸中,加热反应,使不可还原糖水解成还原糖。
而酶水解则是利用相应的酶将不可还原糖水解成还原糖。
常用的酶有葡萄糖酸酶、乳糖酶等。
总糖的测定方法也可以利用比色法或滴定法进行测定。
其中,滴定法是将样品加入酸性溶液中,加入菲林试剂,然后用氢氧化钠溶液滴定至蓝色消失,从而计算出总糖的含量。
而比色法则是将样品加入酸性溶液中,加入菲林试剂,然后用分光光度计测定菲林铁络合物的吸光度,从而计算出总糖的含量。
还原糖和总糖的测定方法是食品分析中常用的方法之一。
通过这些方法,可以准确地测定食品中的糖类含量,为食品质量控制和营养评价提供重要的依据。