催化原理-绪论(2)
- 格式:ppt
- 大小:11.44 MB
- 文档页数:69

催化原理重点知识点总结催化原理是化学反应速率中的关键因素之一,它能够降低活化能,加速反应进行。
催化原理涉及多个重要的知识点,下面是一个1200字以上的催化原理重点知识点总结:1.催化剂的作用机制催化剂通过提供新的反应路径,降低了反应活化能,并且能够参与反应形成中间产物,最后再释放出来以参与下一个反应循环。
催化剂的作用可以是吸附活化、解离和结合产物等。
2.催化剂的分类催化剂可以分为均相催化剂和异相催化剂。
均相催化剂与反应物和产物均处在相同的相态,异相催化剂与反应物和产物处在不同的相态,常见的包括固体催化剂和液体催化剂。
3.催化剂的选择和设计催化剂的选择和设计是催化化学的基础。
合适的催化剂应具有高的催化活性、高的选择性和稳定性。
常用的催化剂包括金属催化剂、酶和酶模拟剂、过渡金属催化剂等。
4.受体饱和和产物反馈对催化反应的影响在催化反应中,受体饱和和产物反馈都会影响反应的速率和选择性。
受体饱和是指反应物与催化剂之间的相互作用,如果反应物过多,催化剂会饱和,从而降低反应速率。
产物反馈是指产物对反应速率的影响,产物过多会抑制反应速率。
5.催化反应的速率方程催化反应的速率方程描述了反应速率与反应物浓度和催化剂浓度之间的关系。
速率方程可以根据实验数据通过拟合得到,一般可以用Arrhenius 方程、Michaelis-Menten 方程等形式进行表示。
6.酶催化反应酶是一种具有高度催化活性和专一性的生物催化剂,它通过降低活化能来加速化学反应。
酶催化反应具有高效率、高选择性和温和条件等优点,常用于生物体内的代谢过程中。
7.过渡金属催化反应过渡金属催化反应是分子催化领域的重要研究方向之一、过渡金属催化剂通常具有复杂的配体结构和反应机制,可以实现多种催化反应,如氧化反应、还原反应、羰基化反应等。
8.催化剂中的活性位点催化剂中的活性位点是指催化反应发生的具体位置。
活性位点可以是金属表面上的孤立原子、簇状结构、缺陷位点等,也可以是有机催化剂特有的功能基团。

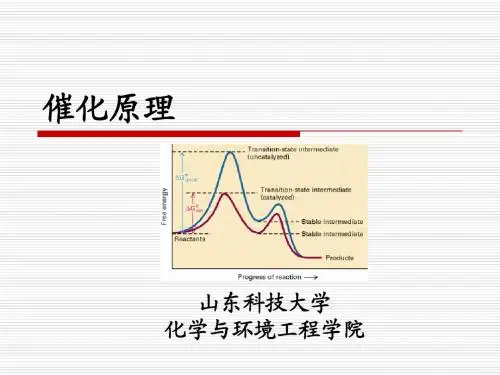
1 Catalysts that speed the reaction are called positive catalysts. Substances that slow a catalyst's effect in a chemical reaction are called inhibitors.催化作用是指催化剂对化学反应所产生的效应。
2 Catalysis is the change in rate of a chemical reaction due to the participation of a substance called a catalyst. Unlike other reagents that participate in the chemical reaction, a catalyst is not consumed by the reaction itself.催化剂是一种能够改变一个化学反应的反应速度,却不改变化学反应热力学平衡位置,本身在化学反应中不被明显地消耗的化学物质。
——现代定义3 只有热力学允许,平衡常数较大的反应加入适当催化剂才是有意义的!Only allowed by thermodynamics, addition of appropriate catalysts for those reactions with larger equilibrium constant of the reaction is meaningful!催化作用通过改变反应历程而改变反应速度Catalysis change the reaction rate by changing the reaction path4 不同催化剂对特定的反应体系有选择性(机理选择性)Different catalysts have selectivity to the specific reaction system (Mechanism selectivity)催化剂因催化剂结构不同导致选择性(扩散选择性)。
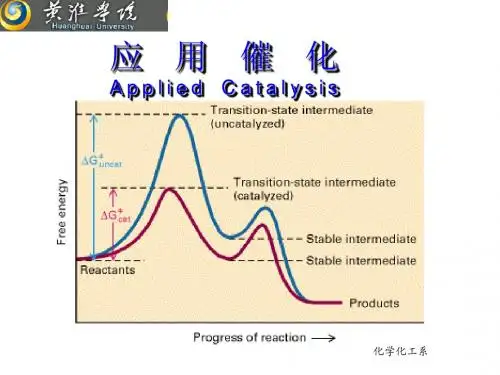


催化原理(适用于化工工艺专业)(Catalysis: Theory & Application)目的和要求催化原理是催化理论和催化实践并重的学科。
它的教学目的是使学生掌握催化作用的基本规律,了解催化过程的化学本质和熟悉工业催化技术的基本要求和特征,为化工工艺专业专门人才的培养提供坚实的理论基础。
要求学生在掌握催化化学基本概念和理论的基础上,注重与催化剂的工业应用紧密结合。
基本内容及学时分配绪论(1学时)第一章催化作用与催化剂(共8学时)第一节催化作用的定义与特征(2学时)第二节催化剂的组成的功能(2学时)第三节对工业催化剂的要求(2学时)第四节均相催化与均相催化剂简介(2学时)第二章吸附作用与多相催化(共8学时)第一节多相催化的反应步骤(1学时)第二节吸附等温线(2学时)第三节金属表面上的化学吸附(2.5学时)第四节氧化物表面上的化学吸附(2.5学时)第三章各类催化剂及其催化作用(共10学时)第一节酸碱催化剂及其催化作用(2学时)第二节分子筛催化剂及其催化作用(2学时)第三节金属催化剂及其催化作用(2学时)第四节金属氧化物和硫化物催化剂及其催化作用(2学时)第五节络合催化剂及其催化作用(2学时)第一章至第三章复习(3学时)第四章工业催化剂的制备与使用(共4学时)第一节工业催化剂的制备(2学时)第二节工业催化剂的使用(2学时)第五章工业催化剂的活性评价与宏观物性的表征(共5学时)第一节催化剂的活性测试的基本概念(1学时)第二节催化剂的活性测试(2学时)第三节催化剂的宏观物性及其测定(2学时)第四、五章复习(2学时)总课时44学时包括35学时授课,5学时复习,4学时参观或实践教材黄仲涛主编,化学工业出版社,1994。
北京主要参考书[1] 李玉敏工业催化原理,天津大学出版社1992 天津[2] 高正中实用催化,化学工业出版社1996 北京[3]吴越催化化学(上、下册),科学出版社1998 北京。

简述催化的基本原理及应用催化的基本原理催化是指在化学反应中,通过加入少量的物质(催化剂),来提高反应速率、降低反应能量,从而加速反应的过程。
催化剂是一种能够通过改变反应的反应机理,降低反应活化能的物质。
催化剂通常不参与反应,可以在反应结束后重新被收集和使用。
催化的基本原理可以归结为两个主要方面:活化能和反应速率的影响。
1. 活化能的降低催化剂能够通过两种方式降低反应的活化能:•提供一个能够吸附反应物的表面,使得反应物能够更容易相互靠近,从而增加反应速率。
•提供一个新的反应途径,能够降低反应物达到其过渡态的能量,从而降低反应的活化能。
2. 反应速率的影响催化剂对反应速率的影响主要体现在以下两个方面:•催化剂能够提供有利于反应进行的表面,并吸附反应物分子,使其更容易与其他反应物分子发生碰撞,从而增加反应速率。
•催化剂能够提供新的反应途径,使得反应物分子能够更容易地转化为产物,并降低反应的反应能量。
催化的应用催化在化学工业中拥有广泛的应用。
下面列举了一些常见的催化应用:1.石油加工催化剂–催化裂化:通过催化剂将高沸点的石油分子裂解成低沸点的化合物,用来制造汽油、润滑油等产品。
–催化氢化:使用催化剂将不饱和烃类转化为饱和烃类,同时除去杂质,提高产品质量。
–催化重整:通过催化剂将低辛烷值的烃类转化为高辛烷值的烃类,提高汽油质量。
2.化学合成催化剂–催化剂在有机合成中广泛应用,例如用催化剂合成药物、染料等有机化合物。
–催化剂在无机合成中也有重要应用,例如用催化剂合成催化剂、陶瓷材料、电子材料等。
3.环境保护催化剂–尾气净化催化剂:用于汽车尾气中有害气体的转化和去除,减少对环境的污染。
–污水处理催化剂:通过催化剂将污水中的有机物和有害物质转化为无害物质,提高水质。
4.生物催化–酶催化:利用天然酶或改造的酶作为催化剂,加速生物反应,例如发酵、合成生物活性物质等。
以上只是催化的一些基本原理及应用的简述,实际上催化在化学领域的应用非常广泛,涉及到多个领域。

三元催化的工作原理
三元催化是指在催化剂中含有三种不同类型的活性组分,常见的是铂(Pt)、钯(Pd)和铑(Rh)等金属。
三元催化剂的工作原理是通过催化剂表面的活性位点吸附反应物,提供必要的反应活性位点,从而促进反应的发生。
具体而言,三元催化剂的工作原理主要包括以下几个步骤:
1. 吸附:反应物分子在催化剂表面的活性位点上吸附。
在吸附过程中,反应物的化学键发生变化,使其更易于与其他反应物发生反应。
这一步骤在催化剂表面产生吸附物种。
2. 活化:吸附物种通过吸附和解离,使其成为可以参与反应的活性种。
活性种的形成通常需要一定的能量,这个能量称为活化能。
催化剂的存在可以降低活化能,使反应更容易发生,从而提高反应速率。
3. 反应:活性种与其他反应物发生化学反应。
在反应过程中,化学键的断裂和形成,产生新的化学物质。
催化剂提供了有效的反应路径,降低了反应物与活性种之间的能垒,加速反应速率。
4. 解吸:反应产物在催化剂表面从活性位点上解吸。
解吸过程中,反应产物分子从活性位点脱离,重新进入气相或溶液相。
同时,催化剂表面的活性位点重新变得可用。
通过上述步骤,三元催化剂能够在化学反应中起到促进剂的作
用。
三元催化剂的优势在于不同金属的配合能够提供更多类型的活性位点,从而更好地适应不同反应的需求,提高反应的选择性和效率。

催化的应用原理1. 催化反应的基本概念催化是一种通过添加催化剂来加速化学反应速率的方法。
催化剂是一种物质,它能够在反应中参与并加速反应速度,而且在反应结束后可以重新回到原始状态,不被消耗。
催化反应在许多工业和生物过程中都得到了广泛应用,例如化工生产、能源转换、环境保护等领域。
2. 催化反应的核心原理催化反应的核心原理是降低反应活化能,从而加速反应速率。
在化学反应中,反应物需要克服能垒才能转变为产物。
而催化剂通过提供新的反应途径,降低了反应的能垒,使得反应能够以更低的能量开启。
这样,反应物与催化剂共同形成中间体,然后经过一系列反应步骤生成最终产物。
3. 催化反应的基本步骤催化反应可以分为三个基本步骤:吸附、反应和脱附。
3.1 吸附催化剂与反应物之间发生吸附作用,催化剂表面上的活性位点吸附反应物分子。
这个吸附过程可以通过物理力学和化学作用力来实现,例如静电作用、范德华力等。
3.2 反应吸附在催化剂表面上的反应物分子发生化学反应。
催化剂的活性位点提供了合适的环境和条件,使得反应物能够以更低的能量进行反应。
在这个过程中,反应物分子之间重新排列,化学键的形成和断裂,生成新的分子。
3.3 脱附生成的产物从催化剂表面脱附,重新进入反应体系。
催化剂则重新回到原始状态,等待下一轮反应的发生。
4. 催化剂的种类和作用方式4.1 催化剂的种类催化剂可以分为两类:阳离子催化剂和阴离子催化剂。
阳离子催化剂是指催化剂本身是带正电荷的离子,例如H+、Ag+等;阴离子催化剂则是指催化剂本身是带负电荷的离子,例如OH-、CO32-等。
4.2 催化剂的作用方式催化剂可以通过多种方式来加速反应速率,包括以下几种方式:•提供正确的反应活化能路径:催化剂提供了一个更佳的反应途径,使得反应物能够以更低的能量进行反应。
•降低反应物之间的排斥力:催化剂与反应物发生吸附后,可以改变反应物分子之间的排布,减少排斥力,促进反应进行。
•改变反应物的构型:催化剂能够改变反应物的构型,使得反应物分子更容易发生变换。

《催化原理》教学大纲二、课程目的和任务催化原理课程是化学工程与工艺专业的必修专业课以及其他相关专业的选修课。
催化剂在现代化学工业中占有重要的地位,了解和掌握催化剂与催化作用的基本原理对于化学工程与工艺专业以及相关专业的学生是具有相当重要的意义。
通过对本课程的学习,使学生了解目前工业生产和科学研究中最常用的四大类型催化剂,即酸碱催化剂、金属催化剂、过渡金属氧化物催化剂和络合物催化剂。
掌握催化作用基础,各类催化剂的组成、结构、催化反应、催化作用原理以及催化剂的工业应用和典型实例的剖析。
三、本课程与其它课程的关系本课程是在无机化学、有机化学、物理化学等课程的基础上,综合运用先修课程的基础知识,分析和解决化工生产与科学研究中催化剂与催化作用的问题,同时为今后的工作与进一步学习化工中的其它专业知识提供理论基础。
四、教学内容、重点、教学进度、学时分配(一)绪论(1学时)1、主要内容催化剂与催化作用的重要性;催化科学的发展及特点。
2、重点催化剂、催化作用概念3、教学要求了解本课程的性质、任务和内容,了解催化学科的发展及重要性。
(二)催化剂与催化作用的基础知识(3学时)1、主要内容催化作用的特征;催化作用的分类;固体催化剂的组成和结构层次;催化剂的反应性能及工业对催化剂的要求;多相催化反应系统分析。
2、重点催化作用的基本特征,固体催化剂的组成。
3、教学要求了解催化作用的基础知识,掌握催化作用的基本特征和固体催化剂的组成和结构层次。
利用催化作用的基本特征解决一些实际问题。
(三)催化剂的吸附、表面积、孔结构(2学时)1、主要内容催化剂的物理吸附和化学吸附;化学吸附类型和化学吸附态;吸附平衡与吸附等温方程;催化剂的表面积及孔结构。
2、重点物理吸附和化学吸附鉴别,吸附平衡,化学吸附态。
3、教学要求了解催化剂的物性及主要表征方法,催化剂的吸附。
(四)金属催化剂及其催化作用(8学时)1、主要内容金属催化剂的应用及催化作用;金属催化剂的化学吸附;金属催化剂电子因素与催化作用的关系;金属催化剂晶格结构与催化作用的关系;负载型金属催化剂及其催化作用;合金催化剂及其催化作用;金属催化剂催化作用的典型反应分析。