盖斯定律练习题
- 格式:ppt
- 大小:345.50 KB
- 文档页数:24
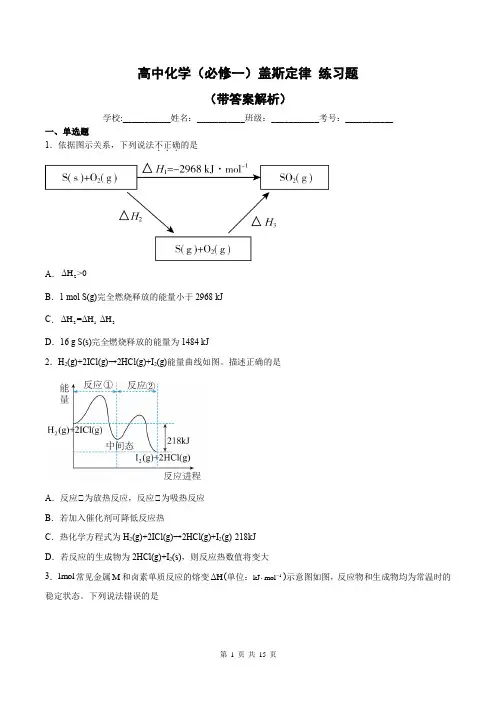
高中化学(必修一)盖斯定律练习题(带答案解析)学校:___________姓名:___________班级:___________考号:___________一、单选题1.依据图示关系,下列说法不正确...的是ΔH>0A.2B.1 mol S(g)完全燃烧释放的能量小于2968 kJΔH=ΔH-ΔHC.213D.16 g S(s)完全燃烧释放的能量为1484 kJ2.H2(g)+2ICl(g)→2HCl(g)+I2(g)能量曲线如图。
描述正确的是A.反应①为放热反应,反应①为吸热反应B.若加入催化剂可降低反应热C.热化学方程式为H2(g)+2ICl(g)→2HCl(g)+I2(g)-218kJD.若反应的生成物为2HCl(g)+I2(s),则反应热数值将变大3.1mol常见金属M和卤素单质反应的熔变ΔH(单位:1⋅)示意图如图,反应物和生成物均为常温时的kJ mol-稳定状态。
下列说法错误的是A .2MBr 与2Cl 反应的ΔH<0B .由2MCl (s)分解制得M 的反应是吸热反应C .化合物的热稳定性顺序:2222MI MBr MCl MF >>>D .2222MF (s)Br (l)MBr (s)F (g)+=+ -1ΔH=+600kJ mol ⋅4.硫酸工业中的钒催化剂参与反应的相对能量变化如图所示,下列热化学方程式错误的是A .-1243252V O (s)+SO (g)V O (s)+SO (g)ΔH=-24kJ mol ⋅ B .-142432VOSO (s)V O (s)+2SO (g)ΔH=+200kJ mol ⋅C .-12524242V O (s)+2SO (g)2VOSO (s)+V O (s)ΔH=-352kJ mol ⋅D .-125234V O (s)+SO (g)+SO (g)2VOSO (s)ΔH=-376kJ mol ⋅ 5.N 2O 和CO 是环境污染性气体,可在Pt 2O +表面转化为无害气体,有关化学反应的物质变化过程及能量变化过程分别如图甲、乙所示。

第1章 化学反应的热效应1.2.1盖斯定律一、选择题1.已知:()()()22C s O g 2CO g += 11-Q kJ mol -∆=⋅H()()()22C s O g CO g += 12-Q kJ mol -∆=⋅H()()()22S s O g SO g += 13Q kJ mol -∆=-⋅H CO 与镍反应会造成镍催化剂中毒,为防止镍催化剂中毒,工业上常用SO 2将CO 氧化,二氧化硫转化为单质硫,则对应反应的热化学方程式为A .()()()()2S s 2CO g SO s 2C s +=+ ()11232Q -2Q +Q kJ mol -∆=⋅HB .()()()()2S s 2CO g SO s 2C s +=+ ()113Q -Q kJ mol H -∆=⋅C .()()()()22SO g 2CO g S s 2CO g +=+ ()1123Q -2Q +Q kJ mol -∆=⋅H D .()()()()22SO g 2CO g S s 2CO g +=+ ()11232Q -Q +2Q kJ mol -∆=⋅H2.已知()()()2223g H g CH CH CH g +=△ 1157kJ mol H -∆=-⋅。
已知()g △的标准燃烧热12092kJ mol H -∆=-⋅,()223CH CH CH g 的标准燃烧热12220kJ mol H -∆=-⋅,1 mol 液态水蒸发为气态水的焓变144kJ mol H -∆=+⋅。
则2mol 氢气完全燃烧生成气态水的()1kJ mol H -∆⋅为A .-658B .-48C .-329D .-2853.H 2与N 2在催化剂表面生成NH 3,反应历程及能量变化示意如下:下列说法错误的是 A .①→②吸收能量B .②→③形成了N -H 键C .选择不同的催化剂会改变反应热D .该反应为放热反应4.甲烷燃烧时的能量变化如图,有关说法正确的是A.图1中反应为:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H= +890.3kJ/molB.图2中反应为:CH4(g)+32O2(g)=CO(g)+2H2O(g) △H=−607.3kJ/molC.由图可以推知:CO2和CO相比,CO更稳定D.由图可以推得:CO(g)+12O2(g)=CO2(g) △H=−283kJ/mol5.通过以下反应均可获取H2。

高二化学盖斯定律练习题一、选择题:1. 盖斯定律是描述什么现象的定律?A. 气体扩散B. 气体溶解C. 气体振动D. 气体压缩2. 盖斯定律中的P代表什么?A. 压力B. 温度C. 体积D. 质量3. 盖斯定律中的V代表什么?A. 压力B. 温度C. 体积D. 质量4. 盖斯定律中的n代表什么?A. 压力B. 温度C. 体积D. 物质的量5. 盖斯定律中的T代表什么?A. 压力B. 温度C. 体积D. 质量二、简答题:1. 用盖斯定律解释为什么气球会膨胀?根据盖斯定律,气体的体积与温度成正比,当气球中的气体受热时,气体的温度上升,体积也随之增加,导致气球膨胀。
2. 盖斯定律在生活中有哪些应用?盖斯定律在以下方面有应用:气球的膨胀、热空气球的升空、气体在容器中的压力变化等。
三、计算题:1. 一个气球的体积为1.5 L,在温度为25°C时,气球的体积为多少?根据盖斯定律,V1 / T1 = V2 / T2,代入已知数据进行计算:(1.5 L) / (25+273.15 K) = V2 / (25+273.15 K)V2 = (1.5 L) / (25+273.15) K * (25+273.15 K)V2 ≈ 1.3 L2. 一个气球在温度为35°C时的体积为2L,温度升高到45°C,气球的体积为多少?根据盖斯定律,V1 / T1 = V2 / T2,代入已知数据进行计算:(2 L) / (35+273.15 K) = V2 / (45+273.15 K)V2 = (2 L) / (35+273.15 K) * (45+273.15 K)V2 ≈ 2.3 L总结:通过本次盖斯定律练习题,我们对盖斯定律的应用和计算有了更深入的理解。
盖斯定律在描述气体行为和计算气体参数方面起到了重要的作用,可以帮助我们解释和预测与气体相关的现象和实验结果。
在日常生活和科学研究中,盖斯定律的应用广泛而重要。

盖斯定律习题一、选择题1.化学反应中常常伴有能量变化,下列说法错误的是 ( ) A 原电池是将部分化学能转化为电能 B TNT 爆炸是将部分化学能转化为动能 C 铝热反应是将部分化学能转化为热能 D 甲烷燃烧是将全部的化学能转化为热能2.分析右面的能量变化示意图,确定下列选项中正确的是( )A.2 A (g )+ B(g) 2 C (g )△H <0B.2 A (g )+ B(g) 2 C (g ) △H >0 2 C △H <0C.2A + B 2 A +B △H <0D.2C 3.从如右图所示的某气体反应的能量变化分析,以下判断错误的是( )A.这是一个放热反应B.该反应可能需要加热C.生成物的总能量低于反应物的总能量D.反应物比生成物更稳定 4.(2007年海南卷)已知:(1)Zn (s )+1/2O 2(g )=ZnO (s );ΔH=-348.3 kJ/mol(2)2Ag (s )+1/2O 2(g )=Ag 2O (s );ΔH=-31.0 kJ/mol则Zn (s )+Ag 2O (s )=ZnO (s )+2Ag (s )的ΔH 等于( ) A .-317.3 kJ/mol B.-379.3 kJ/mol C.-332.8 kJ/mol D.+317.3 kJ/mol5.已知在相同状况下,要使同一化学键断裂需要吸收的能量等于形成该化学键放出的能量。
下列说法正确的是 ( ) A .电解熔融的Al 2O 3可以制得金属铝和氧气,该反应是一个放出能量的反应 B .水分解产生氢气和氧气时放出能量C .相同状况下,反应2SO 2+O 2=2SO 3是一个放热反应,则反应2SO 3=2SO 2+O 2是一个吸热反应D .氯化氢分解成氢气和氯气时需要放出能量6.下列图象分别表示有关反应的反应过程与能量变化的关系据此判断下列说法中正确的是 ( ) A .石墨转变为金刚石是吸热反应 B .白磷比红磷稳定C .S(g)+O 2(g)=SO 2(g) ΔH 1,S(s)+O 2(g)=SO 2(g) ΔH 2,则ΔH 1>ΔH 2D .CO(g)+H 2O(g)=CO 2(g)+H 2(g) ΔH >07.[双选题]已知25℃、101 kPa 条件下:①4Al(s)+3O 2(g)===2Al 2O 3(s) ΔH =-2 834.9 kJ/mol ②4Al(s)+2O 3(g)===2A l2O 3(s) ΔH =-3 119.1 kJ/mol 由此得出的正确结论是( )A .等质量的O 2比O 3的能量低,由O 2变O 3为放热反应B .等质量的O 2比O 3的能量低,由O 2变O 3为吸热反应C .O 3比O 2稳定,由O 2变O 3为放热反应D .O 2比O 3稳定,由O 2变O 3为吸热反应 8.(2012·吉林一中质检)根据下列热化学方程式: (1)C(s)+O 2(g)===CO 2(g) ΔH 1=-393.5 kJ/mol (2)H 2(g)+12O 2(g)===H 2O(l) ΔH 2=-285.8 kJ/mol(3)CH 3COOH(l)+2O 2(g)===2CO 2(g)+2H 2O(l) ΔH 3=-870.3 kJ/mol 可以计算出2C(s)+2H2(g)+O2(g)===CH3COOH(l)的反应热为( ) A .ΔH =+244.1 kJ/mol B .ΔH =-488.3 kJ/mol C .ΔH =-996.6 kJ/mol D .ΔH =+996.6 kJ/mol 9.(2007年海南卷)已知:(1)Zn (s )+1/2O 2(g )=ZnO (s );ΔH=-348.3 kJ/mol (2)2Ag (s )+1/2O 2(g )=Ag2O (s );ΔH=-31.0 kJ/mol则Zn (s )+Ag 2O (s )=ZnO (s )+2Ag (s )的ΔH 等于( ) A.-317.3 kJ/mol B.-379.3 kJ/mol C.-332.8 kJ/mol D.+317.3 kJ/mol10.甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是①CH 3OH(g)+H 2O(g)=CO 2(g)+3H 2(g); △H= + 49.0 kJ·mol -1②CH 3OH(g)+1/2O 2(g)=CO 2(g)+2H 2(g);△H=-192.9 kJ·mol -1 下列说法正确的是 ( )A .CH 3OH 的燃烧热为192.9 kJ·mol -1B .CH 3OH 的燃烧热为133.9 kJ·mol -1低高物质所具有的总能量2 A (g) + B(g) 2 C (g)C .CH 3OH 转变成H 2的过程一定要吸收能量D .根据②推知反应: CH 3OH(l)+1/2O 2(g)=CO 2(g)+2H 2(g)的△H>-192.9kJ·mol -1 11.肼(N 2H 4)是火箭发动机的一种燃料,反应时N 2O 4为氧化剂,反应生成N 2和水蒸气。

第 1 页 共 1 页 (1) 利用方程组消去中间产物 反应1 + (-反应2)= 反应3(2) 列式: △H 1—△H 2 = △H 3∴△H 3=△H 1 -△H 2=-393.5 kJ/mol -(-283.0 kJ/mol)=-110.5 kJ/mol 〖例题2〗根据下列热化学方程式分析,C(s)的燃烧热△H 等于 ( D )C(s) + H 2O(l) === CO(g) + H 2(g) △H 1 =+175.3kJ·mol —12CO(g) + O 2(g) == 2CO 2(g) △H 2=—566.0 kJ·mol —1 2H 2(g) + O 2(g) == 2H 2O(l) △H 3=—571.6 kJ·mol —1A. △H 1 + △H 2 —△H 3B.2△H 1 + △H 2 + △H 3C. △H 1 + △H 2/2 + △H 3D. △H 1 + △H 2/2 + △H 3/2 〖练习1〗已知氟化氢气体中有平衡关系:2H 3F 33H 2F 2 △H 1= a kJ·mol —1 H 2F 22HF △H 2= b kJ·mol —1已知a 、b 均大于0;则可推测反应:H 3F 33HF 的△H 3为( D )A.(a + b ) kJ·mol —1B.(a — b )kJ·mol —1C.(a + 3b )kJ·mol —1D.(0.5a + 1.5b )kJ·mol —1〖练习2〗由金红石(TiO 2)制取单质Ti ,涉及到的步骤为:TiO2TiCl 4−−−−→−Ar C /800/0镁Ti 已知:① C (s )+O 2(g )=CO 2(g ) ∆H 1 =-393.5 kJ·mol -1 ② 2CO (g )+O 2(g )=2CO 2(g ) ∆H 2 =-566 kJ·mol -1 ③ TiO 2(s )+2Cl 2(g )=TiCl 4(s )+O 2(g ) ∆H 3 =+141 kJ·mol -1则TiO 2(s )+2Cl 2(g )+2C (s )=TiCl 4(s )+2CO (g )的∆H = -80 kJ·mol -1 。

盖斯定律 专题训练1.下列关于盖斯定律描述不正确的是( )A .化学反应的反应热不仅与反应体系的始态和终态有关,也与反应的途径有关B .盖斯定律遵守能量守恒定律C .利用盖斯定律可间接计算通过实验难测定的反应的反应热D .利用盖斯定律可以计算有副反应发生的反应的反应热【答案】A【解析】A. 化学反应的反应热与反应体系的始态和终态有关,与反应途径无关,A 错误;B. 盖斯定律也遵守能量守恒定律,B 正确;C. 利用盖斯定律可间接计算通过实验难以测定的反应的反应热,C 正确;D. 利用盖斯定律可以计算有副反应发生的反应的反应热,D 正确;答案选A 。
2.下列关于如图所示转化关系(X 代表卤素)的说法中正确的是( )A .△H 1越小,HX 就越稳定B .△H 1+△H 2+△H 3=0C .按照Cl 、Br 、I 的顺序,△H 2依次增大D .过程Ⅲ能量变化形式与高温煅烧石灰石的能量变化形式相同【答案】A【解析】A .△H 1越小,放热越多,HX 能量越低,HX 就越稳定,A 正确; B .根据盖斯定律,△H 1=△H 2+△H 3,B 错误;C .原子半径越小,键能越大,按照Cl 、Br 、I 的顺序,△H 2依次减小,C 错误;D .过程Ⅲ形成化学键放热,高温煅烧石灰石吸热,能量变化形式不相同,D 错误。
答案选A 。
3.在298K 、100kPa 时,已知:2H 2O(g)=2H 2(g)+O 2(g) △H 1H 2(g)+Cl 2(g)=2HCl(g) △H 22Cl 2(g)+2H 2O(g)=4HCl(g)+O 2(g) △H 3则△H 3与△H 1和△H 2间的关系正确的是( )A .△H 3=△H 1+2△H 2B .△H 3=△H 1+△H 2C .△H 3=△H 1-2△H 2D .△H 3=△H 1-△H 2【答案】A【解析】①2H 2O(g)=2H 2(g)+O 2(g) △H 1②H 2(g)+Cl 2(g)=2HCl(g) △H 2③2Cl 2(g)+2H 2O(g)=4HCl(g)+O 2(g) △H 3则由盖斯定律可知,反应③=①+2×②,△H 3=△H 1+2△H 2。

盖斯定律练习题(打印版)## 盖斯定律练习题### 一、选择题1. 根据盖斯定律,下列反应中哪一个反应的热效应与反应①2H₂(g)+ O₂(g) → 2H₂O(g)和反应②2H₂(g) + O₂(g) → 2H₂O(l)的热效应之和相等?A. 4H₂(g) + 2O₂(g) → 4H₂O(g)B. 4H₂(g) + 2O₂(g) → 4H₂O(l)C. 2H₂(g) + O₂(g) → 2H₂O(l) + 2H₂O(g)D. 2H₂(g) + O₂(g) → 2H₂O(g) + 2H₂O(l)2. 盖斯定律表明,如果一个化学反应可以通过一系列其他化学反应的组合来实现,那么这个反应的热效应与直接进行该反应的热效应相同。
以下哪个选项正确地描述了盖斯定律?A. 反应的热效应仅取决于反应物和生成物的量。
B. 反应的热效应仅取决于反应物的量。
C. 反应的热效应仅取决于生成物的量。
D. 反应的热效应取决于反应物和生成物的量以及反应的路径。
### 二、计算题3. 已知反应①:C(s) + O₂(g) → CO₂(g),ΔH₁ = -393.5kJ/mol;反应②:CO(g) + ½O₂(g) → CO₂(g),ΔH₂ = -283.0kJ/mol。
利用盖斯定律,计算反应C(s) + CO₂(g) → 2CO(g)的ΔH。
4. 已知反应③:H₂(g) + Cl₂(g) → 2HCl(g),ΔH₃ = -185.0kJ/mol;反应④:2HCl(g) → 2HCl(s),ΔH₄ = -92.3 kJ/mol。
利用盖斯定律,计算反应H₂(g) + Cl₂(g) → 2HCl(s)的ΔH。
### 三、简答题5. 盖斯定律在化学反应热力学研究中有何重要性?6. 简述如何使用盖斯定律来确定一个未知反应的热效应。
答案:1. B2. A3. 根据盖斯定律,我们可以将反应①和反应②相加得到目标反应,因此ΔH = ΔH₁ + ΔH₂ = -393.5 kJ/mol + (-283.0 kJ/mol) = -676.5 kJ/mol。

选择题:盖斯定律在化学中的主要应用是什么?A. 描述化学反应中的能量变化B. 计算化学反应的熵变C. 预测化学反应的方向D. 通过已知反应的热效应计算未知反应的热效应(正确答案)下列哪个选项不是盖斯定律的推论?A. 化学反应的热效应与反应的途径无关B. 化学反应的热效应可以通过实验测定C. 化学反应的热效应是恒定的,不随条件改变D. 化学反应的热效应可以通过已知反应的热效应进行加减运算得到(正确答案)使用盖斯定律时,需要满足什么条件?A. 所有反应都必须在同一温度下进行B. 所有反应都必须在标准状态下进行C. 只需要知道起始和终止状态的热效应(正确答案)D. 必须知道每一步反应的具体机理下列哪个选项是盖斯定律的一个实际应用?A. 计算化合物的熔点B. 计算化合物的溶解度C. 通过已知燃烧热计算未知化合物的生成热(正确答案)D. 计算化合物的电离能盖斯定律适用于哪种类型的反应?A. 只有放热反应B. 只有吸热反应C. 所有类型的化学反应(正确答案)D. 只有可逆反应在使用盖斯定律计算反应热时,如果反应的方向颠倒,其反应热应如何处理?A. 保持不变B. 乘以2C. 改变符号(正确答案)D. 除以2下列哪个选项描述了盖斯定律的基本思想?A. 化学反应的热效应与反应物的量成正比B. 化学反应的热效应是恒定的,不随反应条件改变C. 化学反应的热效应可以通过已知反应的热效应进行组合计算(正确答案)D. 化学反应的热效应与反应的速率无关已知反应A的热效应和反应B的热效应,如果要计算反应A+B的热效应,应使用哪种方法?A. 将A和B的热效应相加(正确答案)B. 将A和B的热效应相减C. 将A和B的热效应相乘D. 将A和B的热效应相除盖斯定律在化学热力学中的主要作用是什么?A. 预测化学反应的速率B. 计算化学反应的平衡常数C. 通过已知反应的热效应计算未知反应的热效应(正确答案)D. 描述化学反应的机理。

盖斯定律练习题一、选择题1. 下列关于盖斯定律的说法,正确的是:A. 盖斯定律适用于所有化学反应B. 盖斯定律仅适用于放热反应C. 盖斯定律表明,反应热与反应途径无关D. 盖斯定律适用于物理变化2. 在25℃和1个大气压下,1摩尔理想气体体积为:A. 22.4LB. 24.5LC. 26.7LD. 28.0L3. 已知反应2A → B + C,ΔH = 100 kJ/mol。
下列哪个反应的ΔH最大?A. A → 0.5B + 0.5C,ΔH = 50 kJ/molB. 2B → A + C,ΔH = 100 kJ/molC. 2A → B,ΔH = 200 kJ/molD. B + C → 2A,ΔH = 100 kJ/mol二、填空题1. 盖斯定律是热力学第一定律的另一种表述形式,它是由______科学家提出的。
2. 在恒压条件下,系统的焓变等于______与______之差。
3. 已知反应2H2 + O2 → 2H2O,ΔH = 571.6 kJ/mol。
若反应物为4H2和2O2,则4H2O时放出的热量为______ kJ。
三、计算题1. 已知反应N2 + 3H2 → 2NH3,ΔH = 92.4 kJ/mol。
计算反应2N2 + 6H2 → 4NH3的ΔH。
2. 在25℃和1个大气压下,已知反应CO + 0.5O2 → CO2,ΔH = 283 kJ/mol。
计算反应2CO + O2 → 2CO2的ΔH。
3. 已知反应H2 + Cl2 → 2HCl,ΔH = 184.6 kJ/mol。
若反应物为2H2和2Cl2,计算4HCl时放出的热量。
四、判断题1. 盖斯定律适用于所有化学反应,包括可逆反应。
()2. 反应热与反应途径无关,只与反应的始态和终态有关。
()3. 在恒压条件下,系统的内能变化等于焓变。
()五、简答题1. 简述盖斯定律的内容。
2. 请举例说明如何利用盖斯定律计算反应热。
3. 为什么说盖斯定律是热力学第一定律的另一种表述形式?六、匹配题将下列反应与相应的ΔH值匹配:A. C(s) + O2(g) → CO2(g) ΔH = 393.5 kJ/molB. H2(g) + 0.5O2(g) → H2O(l) ΔH = 285.8 kJ/molC. N2(g) + 3H2(g) → 2NH3(g) ΔH = 92.4 kJ/molD. CH4(g) + 2O2(g) → CO2(g) + 2H2O(l) ΔH = 890.4 kJ/mol1. 制备氨气的合成反应2. 碳燃烧二氧化碳的反应3. 氢气燃烧水的反应4. 甲烷燃烧二氧化碳和水的反应2H2(g) + O2(g) → 2H2O(l) ΔH = 571.6 kJ/molN2(g) + 3H2(g) → 2NH3(g) ΔH = 92.4 kJ/molC(s) + O2(g) → CO2(g) ΔH = 393.5 k J/mola) 2N2(g) + 6H2O(l) → 4NH3(g) + 6H2O(l)b) CH4(g) + 2O2(g) → CO2(g) + 2H2O(l)H2(g) + Cl2(g) → 2HCl(g) ΔH = 184.6 kJ/mol2H2(g) + O2(g) → 2H2O(g) ΔH = 483.6 kJ/molC(s) + 2H2(g) → CH4(g) ΔH = 74.8 kJ/mola) 2CH4(g) + 4HCl(g) → C2H6Cl4(l) + 2H2(g)b) 2H2O(g) → 2H2(g) + O2(g)八、实验题1. 设计一个实验,通过测定反应热来验证盖斯定律。


1.强酸和强碱的稀溶液的中和热可表示为:H +(aq)+OH -(aq)=H 2O(1) △H =-57.3kJ /mol已知:CH 3COOH(aq)+NaOH(aq)=CH 3COONa(aq)+H 2O ;△H =- Q 1kJ /mol 21H 2SO 4(浓) + NaOH(aq) = 21Na 2SO 4(aq) +H 2O(1);△H =- Q 2kJ /mol HNO 3(aq)+KOH(aq)=KNO 3(aq)+H 2O(1) ; △H =- Q 3kJ /mol 上述反应均为溶液中的反应,则Q 1、Q 2、Q 3的绝对值大小的关系为( C )。
(A)Q 1=Q 2=Q 3 (B)Q 2>Q 1>Q 3 (C)Q 2>Q 3>Q 1 (D)Q 2=Q 3>Q 1 2.已知:CH 4(g)+2O 2(g)==CO 2(g)+2H 2O(1) △H =- Q 1 kJ 2H 2(g)+O 2(g)==2H 2O(g) △H =- Q 2 kJ 2H 2(g)+O 2(g)==2H 2O(1) △H =- Q 3kJ 常温下,取体积比为4:1的甲烷和氢气的混合气体11.2L(已折合成标准状况),经完全燃烧后恢复至常温,则放出的热量为( A )。
(A)0.4Q 1+0.05Q 3 (B)0.4Q 1+0.05Q 2 (C)0.4Q 1+0.1Q 3 (D)0.4Q 1+0.2Q 23.盖斯定律在生产和科学研究中有很重要的意义。
有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。
现根据下列的5个反应(由氨气、HCl 和水制备NH 4C1水溶液)。
请判断反应④的反应热__△H =-16.3kJ /m01______________。
①NH 3(g)+HCl(g)=NH 4Cl(s) △H =-176kJ/mol②NH 3(g)+H 2O(l)=NH 3(aq) △H =-35.1kJ /mol ③HCl(g)+H 2O(l)=HCl(aq) △H =-72.3kJ /mol ④NH 4C1(s)+H 2O(1)=NH 4C1(aq)⑤NH 3(aq)+HCl(aq)=NH 4C1(aq)△H =-52.3kJ /mol 4.已知下列热化学反应方程式:Fe 203(s)+3CO(g)=2Fe(s)+3C02(g)△H =-24.8kJ /molFe 203(s)+31CO(g)==32Fe 2O 3(s)+C02(g)△H =-15.73kJ /molFe 304(s)+CO(g)==3FeO(s)+C02(g)△H =+640.4kJ /mol 试写出CO 气体还原FeO 固体得到Fe 固体和CO 2气体的热化学反应方程式:____ CO(g)+FeO(s)==Fe(s)+CO 2(g) ; △H =-218kJ /mol 5.(2006山东潍坊高三模拟,13)下列说法或表示方法中正确的是( D ) A.等质量的硫蒸气和硫磺分别完全燃烧,后者放出的热量多B.氢气的燃烧热为285.8 kJ ·mol -1,则氢气燃烧的热化学方程式为:2H 2(g)+O 2(g)====2H 2O(l) ΔH =285.8 kJ ·mol -1C.Ba(OH)2·8H 2O(s)+2NH 4Cl(s) ====BaCl 2(s)+2NH 3(g)+10H 2O(l) ΔH <0D.已知中和热为57.3 kJ ·mol -1,若将含0.5 mol H 2SO 4的浓溶液与含1 mol NaOH 的溶液混合,放出的热量要大于57.3 kJ 6.已知299 K 时,合成氨反应N 2(g )+3H 2(g) ====2NH 3(g) ΔH=-92.0 kJ ·mol -1,将此温度下的1 mol N 2和3 mol H 2放在一密闭容器中,在催化剂存在时进行反应。
第一章盖斯定律练习:1. 下列关于盖斯定律的说法不正确的是( )A .不管反应是一步完成还是分几步完成,其反应热相同B .反应热只与反应体系的始态和终态有关,而与反应的途径无关C .有些反应的反应热不能直接测得,可通过盖斯定律间接计算得到D .根据盖斯定律,热化学方程式中△H 直接相加即可得总反应热2. 已知在298K 时下述反应的有关数据: C(s)+21O 2(g) === CO(g) △H 1 = -110.5 kJ• mol -1C(s)+O 2(g) === CO 2(g) △H 2= -393.5 kJ• mol -1则C(s)+CO 2(g) === 2CO(g) 的△H 为( )A. +283.5 kJ• mol -1B. +172.5 kJ• mol -1C. -172.5 kJ• mol -1D. -504 kJ• mol -13.已知:(1)Zn (s )+12O 2(g )=== ZnO(s),ΔH= -348.3 kJ·mol -1,(2)2Ag(s)+ 12O 2(g )=== Ag 2O(s),ΔH= -31.0 kJ·mol -1,则Zn (s )+ Ag 2O(s) === ZnO(s)+ 2Ag(s)的ΔH 等于( )A .-317.3 kJ·mol -1B .-379.3 kJ·mol -1C .-332.8 kJ·mol -1D .317.3 kJ·mol -14.已知:①2C(s)+O 2(g)====2CO(g) ΔH=-221.0 kJ·mol -1;②2H 2(g)+O 2(g) ====2H 2O(g) ΔH=-483.6 kJ·mol -1。
则制备水煤气的反应C(s)+H 2O(g) ====CO(g)+H 2(g)的ΔH 为( )A.+262.6 kJ·mol -1B.-131.3 kJ·mol -1C.-352.3 kJ·mol -1D.+131.3 kJ·mol -15.已知:(1)Fe 2O 3(s) +32C(s)===32CO 2(g)+2Fe(s) ΔH 1=+234.1 kJ·mol -1(2)C(s)+O 2(g)===CO 2(g) ΔH 2=-393.5 kJ·mol -1则2Fe(s)+32O2(g)===Fe2O3(s) 的ΔH是()A.-824.4 kJ·mol-1B.-627.6 kJ·mol-1C.-744.7 kJ·mol-1D.-169.4 kJ·mol-16.在微生物作用的条件下,NH+4经过两步反应被氧化成NO-3。
盖斯定律练习题(一)1.(1)H2S的燃烧热ΔH =-a kJ·mol-1 ,则H2S燃烧反应的热化学方程式为。
(2)已知:高温下,在密闭容器中用H2还原WO2可得到金属钨。
当温度过高时,WO2(s)会转变为WO2 (g)。
请根据以下反应:①WO2 (s) + 2H2 (g) W (s) + 2H2O (g);ΔH =+66.0 kJ· mol-1②WO2 (g) + 2H2 (g) W (s) + 2H2O (g);ΔH =-137.9 kJ· mol-1计算出WO2 (s) WO2 (g) ΔH =______________________。
2.已知:①2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol②2H2(g)+O2(g)=2H2O(g)△H=-484kJ/mol③CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890kJ/mol则:CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=________________________。
3.我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法。
高炉内可能发生的反应:①C(s)+O2(g)=CO2(g) △H1=-393.5kJ/mol②C(s)+ CO2(g)2CO(g) △H2=+172.5 kJ/mol③4CO(g)+Fe3O4(s)=4CO2(g)+3Fe(s) △H3=-13.7 kJ/mol则:3 Fe(s)+2 O2(g)= Fe3O4(s)ΔH =________________________。
4.已知下列反应的反应热:①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1=-870.3kJ/mol②C(s)+O2(g)=CO2(g) ΔH2=-393.5kJ/mol③H2(g)+1/2O2(g)=H2O(l) ΔH3=-285.8kJ/mol则:2C(s)+O2(g)+2 H2(g)=CH3COOH(l)ΔH =_______________________。
盖斯定律练习(解析版)1.以下反应可表示获得乙醇并用作汽车燃料的过程,下列有关说法正确的是()①6CO2(g)+6H2O(1)═C6H12O6(s)+6O2(g)△H1②C6H12O6(s)═2C2H5OH(1)+2CO2(g)△H2③C2H5OH(1)+3O2(g)═2CO2(g)+3H2O(1)△H3A.2△H3=﹣△H1﹣△H2B.△H3、△H1、△H2均为△H<0C.在不同油耗汽车中发生反应③,△H3会不同D.植物的光合作用通过反应①将热能转化为化学能【答案】A【解析】A、由盖斯定律可知:﹣①﹣②=③×2,则2△H3=﹣△H1﹣△H2,故A正确;B、假设反应热均小于0,根据2△H3=﹣△H1﹣△H2可知△H2=﹣△H1﹣2△H3,则若△H1<0,△H3<0,则△H2>0,与假设矛盾,故B错误;C、焓变与反应的始态和终态有关,则在不同油耗汽车中发生反应③,△H3相同,故C错误;D、植物的光合作用利用太阳能,将太阳能转化成化学能,故D错误。
故选:A。
2.2021年,NASA宣布将发起“CO2转化挑战赛“,这项研究有助于解决在火星上的生存问题。
下列说法不正确的是()A.△H1=﹣(△H2+△H3+△H4)B.用工业催化剂代替微生物发酵,△H5不变C.葡萄糖的燃烧热为﹣△H1D.“人造转化器”所起的作用就是催化剂【答案】D【解析】A、根据盖斯定律可知△H1=﹣(△H2+△H3+△H4),故A正确;B、催化剂不改变反应热,故用工业催化剂代替微生物发酵,△H5不变,故B正确;C、根据图示可知葡萄糖的燃烧热为﹣△H1,故C正确;D、“人造转化器”的目的使非自发反应反应发生,故D错误;故选:D。
4.2mol金属钠和1mol氯气反应的能量关系如图所示,下列说法不正确的是()A.△H2>0B.△H4+△H5+△H8=△H1C.在相同条件下,2K(g)→2K+(g)的△H3′<△H3D.△H6+△H7=△H8【答案】B【解析】A.Na从固态变为液态的程中需要吸收热量,则△H2>0,故A正确;B.由盖斯定律可知,过程1为2、3、4、5、6、7的过程之和,则△H2+△H3+△H4+△H5+△H6+△H7=△H1,故B错误;C.由钾原子原子核外有4个电子层,其失去最外层一个电子所需的能量较小,则2K(g)→2K+(g)的△H2<△H3,故C正确;D.由盖斯定律可知△H6+△H7=△H8,故D正确。
专题三、盖斯定律(课后练习)1.已知: 2H2(g)+ O2(g)=2H2O(l) ΔH= -571.6KJ· mol-1CH4(g)+ 2O2(g)=CO2(g)+2H2O(l) ΔH= -890KJ· mol-1现有H2与CH4的混合气体112L(标准状况), 使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3695KJ, 则原混合气体中H2与CH4的物质的量之比是()A. 1∶1B. 1∶3C. 1∶4D. 2∶32.N4分子结构与P4相似, 已知断裂1mol N-N吸收167kJ热量, 生成1mol N≡N放出942kJ热量。
根据以上信息和数据, 下列说法正确的是()A. N4属于一种新型的化合物B. N4沸点比P4(白磷)高C. N4与N2互为同素异形体D. 1mol N4气体转变为N2将吸收882kJ热量3.使18g焦炭发生不完全燃烧, 所得气体中CO占1/3体积, CO2占2/3体积,已知:C(S)+ 1/2O2(g)=CO(g);△H=-Q1 KJ/mol, CO(g)+ 1/2O2(g)=CO2(g);△H=-Q2 KJ/mol与这些焦炭完全燃烧相比较, 损失的热量是()A.1/3Q1KJB.1/3Q2KJC.1/3(Q1+Q2)KJD.1/2Q2KJ4、(07年高考海南化学卷·6)已知:(1)Zn(s)+1/2O2(g) = ZnO(s);△H =-348.3 kJ/mol(2)2Ag(s)+1/2O2(g) = Ag2O(s);△H=-31.0 kJ/mol则Zn(s)+Ag2O(s) = ZnO(s)+2Ag(s)的△H等于()A. -317.3 kJ/molB. -379.3 kJ/molC. -332.8 kJ/molD. 317.3 kJ/mol5.已知一定温度和压强下, 合成氨反应:N2(g)+3H2(g) /2NH3(g);△H=-92.0KJ·mol-1, 将1mol N2和3mol H2充入一密闭容器中, 保持恒温恒压, 在催化剂存在时进行反应, 达到平衡时, 测得N2的转化率为20%。
高二盖斯定律练习题一、选择题1. 电阻为R的电路中,通过电流为I,则该电路的电压为()。
A. U = I / RB. U = R / IC. U = I * RD. U = √(I / R)2. 在一个电路中,有一个电阻为8欧的电阻器,通过2安的电流,则该电路的电压为()。
A. U = 4 VB. U = 16 VC. U = 0.25 VD. U = 10 V3. 一个电路中,通过电压为10伏的电源,通过的电流为2安,求该电路中的总电阻是多少欧姆?A. 5 ΩB. 12 ΩC. 20 ΩD. 0.2 Ω4. 电流为0.5安的电路中通过电压为10伏的电源,求该电路的总电阻是多少?A. 20 ΩB. 25 ΩC. 2 ΩD. 5 Ω5. 电路中的电源电压为5伏,总电阻为10欧姆,求通过电路中的电流强度。
A. 50 AB. 0.5 AC. 15 AD. 2 A二、填空题1. 在一个电路中,电阻为4欧的电阻器通过2安的电流,则该电路的电压为()伏。
2. 一个电路中,通过电压为30伏的电源,通过的电流为0.5安,求该电路中的总电阻是多少()欧姆?3. 电流为2安的电路中通过电压为6伏的电源,求该电路的总电阻是多少()欧姆?4. 一个电路中的电源电压为10伏,总电阻为20欧姆,求通过电路中的电流强度()安。
5. 在一个电路中,通过电源电压为12伏,通过电流为3安,求该电路的总电阻是多少()欧姆?三、计算题1. 有一个电路,通过的电流为2安,总电阻为10欧姆,求该电路中的电压是多少伏?2. 在电路中,电阻为6欧的电阻器通过的电流为2安,求该电路中的电压是多少伏?3. 在一个电路中,电源电压为5伏,总电阻为20欧姆,求该电路中的电流强度是多少安?4. 一个电路中,通过电流为3安,总电阻为15欧姆,求该电路中的电压是多少伏?5. 电流为0.5安的电路中通过的电压为10伏,求该电路的总电阻是多少欧姆?四、解答题1. 请用公式解释盖斯定律的表达式,并说明各个字母的含义。
高二盖斯定律练习题试卷一、选择题1. 盖斯定律是由哪位科学家提出的?A. 爱因斯坦B. 盖斯C. 牛顿D. 马克思2. 盖斯定律是描述什么现象的定理?A. 万有引力B. 能量守恒C. 力的平衡D. 社会经济发展3. 盖斯定律的数学表达式是什么?A. F = maB. E = mc²C. P = mvD. P = F/A4. 盖斯定律中的质量指的是什么?A. 物体的重量B. 物体所受的重力C. 物体的体积D. 物体的惯性5. 盖斯定律中的加速度指的是什么?A. 物体的速度B. 物体的变速率C. 物体的运动方向D. 物体的力二、填空题1. 盖斯定律中的力单位是__________。
2. 当一个物体受到净合力时,它的加速度__________。
3. 一辆汽车质量为500kg,受到的净合力为1000N,则它的加速度为__________。
4. 物体的质量与它所受的合力成__________关系。
5. 盖斯定律适用于__________。
三、解答题1. 描述盖斯定律的原理及其在实际生活中的应用。
盖斯定律是指物体所受的合力与物体的质量和加速度成正比,即F = ma。
根据这个定律,我们可以计算物体所受的合力或加速度,从而更好地理解和预测物体的运动。
在实际生活中,盖斯定律有许多应用。
例如,在交通安全中,我们可以通过应用盖斯定律来计算碰撞时所受的合力和加速度,进而评估事故的严重程度和安全性。
此外,盖斯定律也应用在机械工程中,用于设计和优化各种运动设备和机器。
2. 一辆汽车质量为800kg,在无摩擦的水平路面上受到1000N的向前推力。
求该汽车的加速度。
根据盖斯定律,加速度等于受到的合力除以物体的质量。
所以,这辆汽车的加速度为:a = F / m= 1000N / 800kg= 1.25 m/s²3. 盖斯定律适用于物体在不同情况下的运动吗?请说明理由。
是的,盖斯定律适用于物体在不同情况下的运动。