胞浆、胞核提取(细胞)
- 格式:docx
- 大小:13.20 KB
- 文档页数:1

胞浆胞核蛋白提取
1 细胞密度80%-90%时,取出细胞置于冰上。
2 使用预冷的PBS缓冲液冲洗3遍,去除残留液体。
3 向培养瓶中加入300ul的胞质溶胶提取缓冲液A(cytosol extraction buffer A, CEB-
A),刮取细胞至1.5ml进口离心管中。
4 在涡旋震荡混匀器上震荡30s,冰上静置10min,每5min震荡一次。
5 加入30ul的胞质溶胶提取缓冲液B(cytosol extraction buffer B, CEB-B),
涡旋震荡混匀10s,冰上放置1min.
6 4℃离心,1000g,5min。
7 吸取上清,既得到胞浆蛋白。
8 加入100ul的CEB-A,清洗核沉淀,4℃离心,1000g,5min。
9 弃上清,加入40ul的核提取缓冲液(nuclear extraction buffer,NEB)
涡旋震荡混匀10s,冰上放置30min,每5min涡旋震荡10s。
10 4℃离心,1000g,5min。
11 吸取上清,既得到核蛋白。
12 分装至0.2进口EP管中,-80℃保存。
胞浆蛋白—核蛋白抽提试剂盒产品编号产品名称包装SINP001 胞浆-核蛋白抽提试剂盒50×产品简介:细胞核和细胞浆目前成为研究细胞组分的两个热点,获得高浓度的细胞核蛋白和细胞浆蛋白成为得到好的研究结果的重要实验过程。
本试剂盒主要原理是在低渗透压条件下,使细胞充分膨胀,然后破坏细胞膜,释放出细胞浆蛋白,离心得到细胞核沉淀。
最后通过高盐的细胞核蛋白抽提试剂抽提得到细胞核蛋白。
本试剂盒是本公司非放射性EMSA试剂盒(cat; SIDET001, SIDET003, SIDET004,)实验成功的重要部分,经BCA测定24cm2贴壁细胞(或50ml规格培养瓶养的悬浮细胞)抽提物,核蛋白浓度约为 2.5ug/ul或更高。
抽提得到的蛋白可以用于Western,EMSA,footprinting,报告基因检测以及酶活力测定等后续操作。
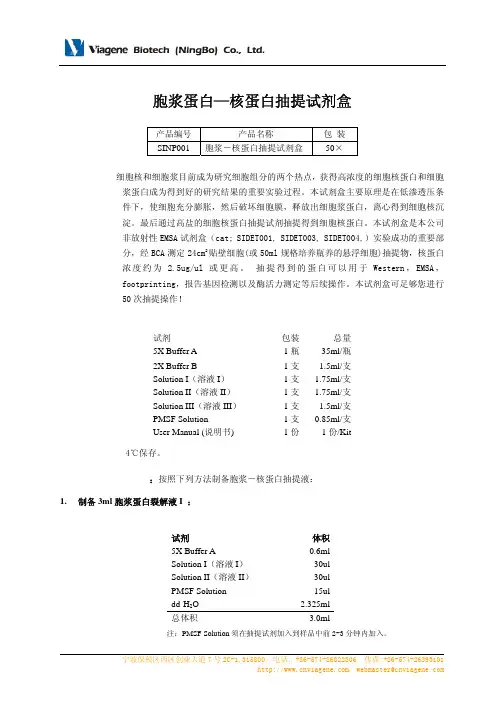
本试剂盒可足够您进行50次抽提操作!包装清单:试剂包装总量5X Buffer A 1瓶35ml/瓶2X Buffer B1支 1.5ml/支Solution I(溶液I)1支 1.75ml/支Solution II(溶液II)1支 1.75ml/支Solution III(溶液III)1支 1.5ml/支PMSF Solution 1支0.85ml/支User Manual (说明书)1份1份/Kit保存温度: 4℃保存。
Ⅰ.准备抽提试剂:按照下列方法制备胞浆-核蛋白抽提液:1.制备3ml胞浆蛋白裂解液I :试剂体积5X Buffer A0.6mlSolution I(溶液I)30ulSolution II(溶液II)30ulPMSF Solution 15uldd-H2O 2.325ml总体积 3.0ml注:PMSF Solution须在抽提试剂加入到样品中前2-3分钟内加入。
2.制备1.02ml胞浆蛋白裂解液II:试剂体积Solution III(溶液III)20ul胞浆蛋白裂解液I 1.0ml总体积 1.02ml3.制备1ml核裂解液:试剂体积2X Buffer B25ulSolution I(溶液I)0.5ulSolution II(溶液II)0.5ulPMSF Solution0.25uldd-H2O23.75ul总体积 50ul注:PMSF Solution须在抽提试剂加入到样品中前2-3分钟内加入。

胞浆蛋白/核蛋白/膜蛋白抽提试剂盒(真核细胞) (Catalog #DBI-1021 ; DBI-1022; Store kit at 4℃)描述:本试剂盒提供了蛋白抽提试剂A,蛋白抽提抽提试剂B,蛋白抽提试剂C三种具有独特组分的缓冲液。
所有试剂采用PIPES缓冲系统。
通过实验,可以得到:细胞胞浆蛋白(其中含有含有可溶性的骨架蛋白);细胞膜蛋白(其中包含细胞质膜蛋白和细胞器膜蛋白);细胞核蛋白;其最后剩余的沉淀为难溶性的胞质骨架和纤维蛋白。
提取方法简单,可靠,快速。
获得的各种部分蛋白纯度高,可用于PAGE 电泳、Western Blot、免疫共沉淀、EMSA等后续研究。
该试剂盒所得到的蛋白溶液适合用Bradeford法(DBI生物产品:DBI-1045,1046)蛋白定量和BCA方法(DBI生物产品:DBI-1047,1048)进行定量。
II 试剂盒组分:III.蛋白质抽提步骤:A. 注意事项和试剂准备:•打开试剂盒后,于4度保存蛋白抽提液;于-20度保存蛋白酶抑制剂,样品缓冲液(6×)。
•使用前, 加10ul的蛋白酶抑制剂于1ml蛋白抽提试剂A中,使成为蛋白抽提混合试剂(该混合物被称为Extraction Buffer Mix ——A);加2ul的蛋白酶抑制剂于200ul蛋白抽提试剂B中,使成为蛋白抽提混合试剂(该混合物被称为Extraction Buffer Mix ——B);加2ul的蛋白酶抑制剂于200ul蛋白抽提试剂C中,使成为蛋白抽提混合试剂(该混合物被称为Extraction Buffer Mix ——C);试剂盒组分DBI-1021 DBI-1022 包装50 次100 次颜色蛋白抽提试剂A蛋白抽提试剂A-1蛋白抽提试剂B蛋白抽提试剂C混合型蛋白酶抑制剂(100×)SDS-PAGE 样品缓冲液(6×)50ml500ul50ml25ml1支5支100ml1000ul100ml50ml1支10支棕色棕色棕色棕色棕色绿色•在试验过程中确保抽提混合物始终保存在在碎冰中。
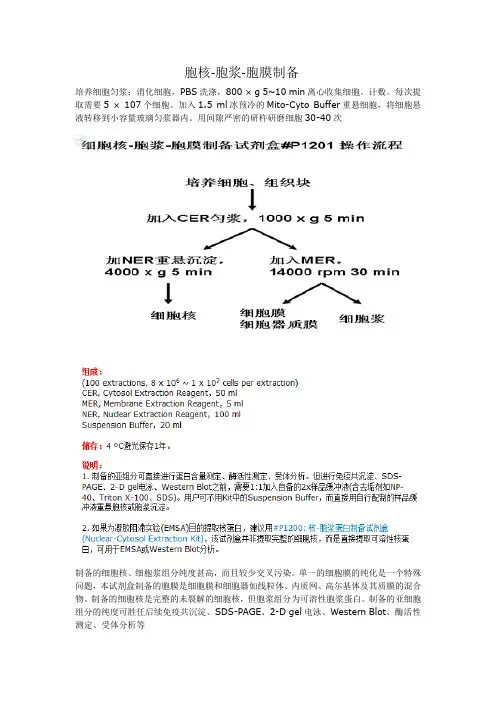
胞核-胞浆-胞膜制备
培养细胞匀浆:消化细胞,PBS洗涤,800 × g 5~10 min离心收集细胞。
计数。
每次提取需要5 × 107个细胞。
加入1.5 ml冰预冷的Mito-Cyto Buffer重悬细胞,将细胞悬液转移到小容量玻璃匀浆器内。
用间隙严密的研杵研磨细胞30-40次
制备的细胞核、细胞浆组分纯度甚高,而且较少交叉污染。
单一的细胞膜的纯化是一个特殊问题,本试剂盒制备的胞膜是细胞膜和细胞器如线粒体、内质网、高尔基体及其质膜的混合物。
制备的细胞核是完整的未裂解的细胞核,但胞浆组分为可溶性胞浆蛋白。
制备的亚细胞组分的纯度可胜任后续免疫共沉淀、SDS-PAGE、2-D gel电泳、Western Blot、酶活性测定、受体分析等。

![骨髓活检诊断病理学基本知识介绍[1]](https://uimg.taocdn.com/758f935f804d2b160b4ec0a2.webp)
骨髓活检诊断病理学基本知识介绍一、骨髓组织的结构与功能(图1)(一)支持造血组织的骨组织结构1.骨小梁:骨小梁是骨皮质在松质骨内的延伸部分,即骨小梁与骨皮质相连接,在骨髓腔中呈不规则立体网状结构,如丝瓜络样或海绵状,起支持造血组织的作用。
正常情况下,骨小梁具有一定的长度,它们之间有一定距离。
骨小梁形成后至20岁左右,骨小梁表面被覆一层骨原细胞(osteogenic cell)或成骨细胞(o ast),因为都在骨髓腔内表面,故通称骨内膜细胞(endosteal cell)。
成骨细胞,排列在骨小梁表面,胞浆突起可与周围的成骨细胞胞浆相接,它是由紧贴骨表面扁平的骨原细胞发育来的(1)。
图1 骨髓组织基本结构图2 骨与骨髓组织结构从左到右:骨外膜、皮质骨、骨小梁及骨髓造血组和血管。
石蜡切片H-E 染色100 ×2.骨原细胞:骨原细胞可认为是松质骨或骨小梁表面处于静止状态的“干细胞”,具有多向分化的潜能,在不同的因子刺激下可转化为不同类型的细胞。
它常常与附近窦内皮相连续,在骨改建过程中它转化为成骨细胞,由扁平状变为立方状。
成骨细胞的作用是分泌骨胶原,合成骨基质中的有机成分(胶原和糖蛋白等)并身包埋在骨基质中。
在20岁以前的骨皮质内侧可见软骨基质(HE染色呈蓝色)及成串排列的软骨细胞,骨内膜面成骨细胞、破骨细胞也较多,软骨基质嗜呈浅灰蓝色。
20岁以后软骨细胞及软骨基质逐渐减少,成熟骨组织逐渐增多,25岁以后均为成熟板层骨(HE染色呈红色),成骨细胞及破骨细胞也明显减少Islam HHA(1985)认为在适当的造血因子作用下,骨原细胞还可能转化为造血干细胞并发育或演变为某些造血细胞,如可分化发育为粒系造血细胞。
因常骨髓幼稚粒系造血细胞总是靠近骨小梁表面生长的,并将逐步发育成熟的粒细胞推向骨小梁之间中央区。
即越靠近骨小梁粒系细胞越幼稚,越远离骨小系细胞越成熟。
3.破骨细胞:破骨细胞(osteoclast)是一种大型分支状游动细胞,胞体直径可长100μm ,其分支不规则,形状和大小不一,胞核大小也不一致,数目可由6~50个或更多不相连。

细胞质细胞内的胞浆和细胞器细胞质是细胞内的一种特殊结构,由胞浆和细胞器组成。
它在维持细胞功能和生命活动中起着重要的作用。
本文将从细胞质的组成和功能两个方面介绍细胞质的相关知识。
一、细胞质的组成细胞质由胞浆和细胞器两部分组成。
1. 胞浆:胞浆是细胞质的基础物质,它是由细胞器在其中悬浮的胶状物质。
胞浆主要由水、有机物、离子、蛋白质等组成。
它的主要功能是提供细胞内各种化学反应所需的环境,并提供细胞器运动的场所。
2. 细胞器:细胞器是细胞质中具有特定结构和功能的小器官。
常见的细胞器有核糖体、内质网、高尔基体、线粒体、溶酶体等。
(1)核糖体:核糖体是细胞中参与蛋白质合成的重要细胞器。
它由RNA和蛋白质组成,分布在胞质中或附着在内质网上。
核糖体主要的功能是根据DNA中的信息合成蛋白质。
(2)内质网:内质网是一种复杂的膜系统,存在于细胞质中。
它分为粗面内质网和滑面内质网。
粗面内质网上覆盖着许多核糖体,参与合成蛋白质。
而滑面内质网则主要参与脂类的代谢和合成。
(3)高尔基体:高尔基体是由扁平而弯曲的膜片叠加而成。
它主要参与蛋白质的修饰、分拣和运输。
高尔基体还与溶酶体和内质网之间有着重要的联系。
(4)线粒体:线粒体是细胞内的“动力站”,主要参与细胞呼吸过程中的能量转换,并产生三磷酸腺苷(ATP)。
(5)溶酶体:溶酶体是一种包裹着消化酶的小膜囊,主要参与细胞对外界物质的摄取、消化和分解。
二、细胞质的功能细胞质作为细胞的重要组成部分,具有以下功能:1. 细胞代谢:胞浆中有丰富的溶胶和胶体,是细胞内许多生物化学反应的场所。
胞浆中发生的一系列化学反应,如蛋白质合成、糖原合成、脂肪代谢等,都依赖于细胞质的环境。
2. 细胞运动:细胞质中的胞浆可以提供细胞器的运动场所。
细胞器在胞浆中的运动对于细胞的形态维持、物质运输、信号传导等起着重要的作用。
3. 物质传递:细胞质中的细胞器通过胞浆与细胞膜相连,形成细胞内物质传递的通路。
细胞器之间通过胞浆中的胶束作为“公路”,使细胞内物质传递更加便捷。

细胞核和胞浆分离机制及其动态调控细胞是生命的基本单位,存在于生物体中,是构成生物体的最小结构和功能单位。
不同于其他非细胞生物,细胞具有细胞膜、细胞质、细胞核等器官,其中,细胞核是细胞内最为重要的器官之一,是细胞总控制中心和基因存储库。
然而,当细胞分裂时,细胞核和胞浆会分离,分别进入两个新细胞中,这是因为细胞需要保证每个新细胞都具有完整的遗传物质和器官。
细胞核分离机制的演化细胞核和胞浆的分离自然界中广泛存在,其分离机制是细胞发生和演化的一部分,但不同生物体的分离机制可能有所不同。
比如,人和动物的细胞在分裂时,细胞核和胞浆是同时分裂的,而植物细胞在分裂时,只有胞浆分裂,细胞核仍在中央。
回到细胞核和胞浆的分离机制,研究表明,细胞核和胞浆的分离是由微管和微丝两种细胞骨架支撑的。
在有丝分裂中,最早被发现的是BI染色体 - 马达蛋白复合物,通过这一复合物,细胞核会被拽到新细胞的一个极端,胞浆会被拽到另一个极端。
这个复合物是由马达蛋白和微管两部分组成的,微管通过将二聚体结构交叉排列,形成一个管状结构。
在微管的动力学中,动态不稳定性是非常重要的,它允许微管快速增长和快速缩小。
微管的左右方向性由某些种类的微管组织蛋白所确定,这种蛋白能够通过诸如蛋白交联和四联肌的方式来影响微管的行为。
不同于微管,在细胞质的分离中,微丝起着至关重要的作用,微丝是细胞中质构最长的纤维,结构类似于纺锤体,可以承受压力和张力。
微丝由一种名为肌动蛋白的蛋白质维持其结构。
这种蛋白是两个相互作用的三聚体形式,可使微丝快速缩短和扭曲。
动态调节细胞核和胞浆分离就像生物体的其他组成部分一样,微管和微丝组成的分离机制也会受到动态调节。
在分离细胞核和胞浆时,这种调节尤其重要。
细胞中有许多激酶和磷酸酶,它们能够调节微管和微丝的行为。
例如,蛋白激酶B1(PKB)能够通过磷酸化蛋白11进行调节,这是一种微管关联蛋白。
这种蛋白的缺失会导致细胞分裂的异常,表明其重要性。

贵州师范大学作业题目:细胞凋亡课程名称:分子与细胞生物学任课教师姓名: XXXXXXXXXX研究生姓名: XXXXXXXXXXXXXX学号: XXXXXXXXXXXXXXXXX年级: 2010级专业:动物学学院(部、所):生命科学学院任课教师评分:评阅意见:任课教师签名:年月日细胞凋亡摘要:人体内的细胞注定是要死亡的,有些死亡是生理性的,有些死亡则是病理性的,有关细胞死亡过程的研究,近年来已成为生物学、医学研究的一个热点,到目前为此,人们已经知道细胞的死亡起码有两种方式,即细胞坏死与细胞凋亡。
细胞坏死是早已被认识到的一种细胞死亡方式,而细胞凋亡则是近年逐渐被认识的一种细胞死亡方式,细胞凋亡是细胞的一种基本生物学现象,在多细胞生物去除不需要的或异常的细胞中起着必要的作用。
它在生物体的进化、内环境的稳定以及多个系统的发育中起着重要的作用。
细胞凋亡不仅是一种特殊的细胞死亡类型,而且具有重要的生物学意义及复杂的分子生物学机制。
凋亡是多基因严格控制的过程。
这些基因在种属之间非常保守,如Bcl-2家族、caspase家族、癌基因如C-myc、抑癌基因P53等,随着分子生物学技术的发展对多种细胞凋亡的过程有了相当的认识,但是迄今为止凋亡过程确切机制尚不完全清楚。
而凋亡过程的紊乱可能与许多疾病的发生有直接或间接的关系。
如肿瘤、自身免疫性疾病等,能够诱发细胞凋亡的因素很多,如射线、药物等。
关键词:细胞凋亡Bcl-2家族、caspase家族、癌基因 C-myc、 抑癌基因P53Abstract:The human body cell is doomed to die, and some death is physical in nature, some deaths are a pathological, the process of cell death, in recent years has become a biology, medical research, a hot spot, to the currently Therefore, cell death has been known at least two ways, namely, necrosis and apoptosis. Cell necrosis has long been recognized as a cell death and apoptosis is gradually being recognized in recent years, a cell death, Apoptosis is a basic biological phenomenon cells, in multicellular organisms to remove unwanted or abnormal cells plays an essential role. Its evolution in the organism, the environment, stability and development of multiple systems plays an important role. Apoptosis is not only a special type of cell death, but also have important biological significance and complexity of the molecular biological mechanisms.Apoptosis is a tightly controlled process of multiple genes. These genes are conserved between the species, such as Bcl-2 family, caspase family of oncogenes such as C-myc, tumor suppressor gene P53, etc., with the development of molecular biology techniques, the process of apoptosis with a variety of considerable understanding, but so far the exact mechanism of apoptosis is not fully understood. The disorder may be associated with apoptosis in many diseases have a direct or indirect relationship. Such as cancer, autoimmune diseases, can induce apoptosis in a number of factors, such as radiation, drugs and so on.Keywords: apoptosis Bcl-2 family caspase family C-myc P53 tumor suppressor gene细胞凋亡的研究历史1. 凋亡概念的形成1965年澳大利亚科学家发现,结扎鼠门静脉后,电镜观察到肝实质组织中有一些散在的死亡细胞这些的溶酶体并未被破坏,显然不同于细胞坏死。

胞浆胞核蛋白提取
1 细胞密度80%-90%时,取出细胞置于冰上。
2 使用预冷的PBS缓冲液冲洗3遍,去除残留液体。
3 向培养瓶中加入300ul的胞质溶胶提取缓冲液A(cytosol extraction buffer A, CEB-
A),刮取细胞至1.5ml进口离心管中。
4 在涡旋震荡混匀器上震荡30s,冰上静置10min,每5min震荡一次。
5 加入30ul的胞质溶胶提取缓冲液B(cytosol extraction buffer B, CEB-B),
涡旋震荡混匀10s,冰上放置1min.
6 4℃离心,1000g,5min。
7 吸取上清,既得到胞浆蛋白。
8 加入100ul的CEB-A,清洗核沉淀,4℃离心,1000g,5min。
9 弃上清,加入40ul的核提取缓冲液(nuclear extraction buffer,NEB)
涡旋震荡混匀10s,冰上放置30min,每5min涡旋震荡10s。
10 4℃离心,1000g,5min。
11 吸取上清,既得到核蛋白。
12 分装至0.2进口EP管中,-80℃保存。
蛋白质分离与提取是生命科学研究基础中的基础,分离细胞核蛋白和细胞浆蛋白,不仅可以
用于研究蛋白在细胞内的定位,而且很多时候分离出来的核蛋白可以用于转录调控方面的研究,例如WB,EMSA(也称gel shift),footprinting,报告基因,酶活性分析等。
Abbkine细胞核蛋白&胞浆蛋白提取试剂盒(KTP3001)
细胞核蛋白&胞浆蛋白提取试剂盒组分:原理:通过细胞浆蛋白抽提试剂,在低渗透压条件下,使细胞充分膨胀,然后破坏细胞膜,释放出细胞浆蛋白,然后通过离心得到细胞核沉淀。
最后通过高盐的细胞核蛋白抽提试剂抽提得到细胞核蛋白。
∙细胞浆蛋白溶液A (CES A)
∙细胞浆蛋白溶液B (CES B)
∙核提取溶液 (NES)
∙DTT (500X)
∙蛋白酶抑制剂 (100X)
∙
另外还有蛋白酶抑制剂套装(Cocktail)
特点:
多功能—适合从新鲜的哺乳动物组织和培养细胞中提取蛋白,提取的蛋白纯度高且保持天
然活性,绝少交叉污染。
快速方便—不到两小时就能纯化出非变性的活性蛋白质。
兼容性好—适用于各种下游检测,包括蛋白质印迹、凝胶转移检测、蛋白质分析、报告基因检测和酶活性检测等。
蛋白质分离提取效果展示:
使用α-tubulin内参抗体(A01080)分别检测胞浆蛋白与核蛋白提取物。
使用Histone H3内参抗体(A01070)分别检测胞浆蛋白与核蛋白提取物。
*C : Cytoplasmic ,胞浆蛋白;N : Nuclear ,核蛋白。
细胞核与细胞浆蛋白提取提到细胞核和细胞浆的蛋白提取,大家肯定会有点懵,想:这不就是一些化学实验吗?其实这还真是个有意思的活儿,虽然听上去复杂,但说起来其实没那么难。
咱们先从头开始,聊聊细胞吧。
细胞就像是一个小工厂,里面有很多部件,分工明确。
有些部分负责制造能源,有些负责合成蛋白质,还有些则在幕后默默支持。
今天,我们要搞的事情就是提取这工厂里头的蛋白质——特别是细胞核和细胞浆中的蛋白质。
听着是不是有点意思?好啦,不说废话了。
首先要明确的一点就是,细胞里其实有好几种不同的蛋白,细胞核里的和细胞浆里的可不是一个模样。
这俩就像是你厨房和客厅的锅碗瓢盆,一样的工具但功能完全不同。
细胞核里面的蛋白,主要是负责控制细胞的活动,像个超级忙碌的总指挥。
而细胞浆里的蛋白呢,主要负责细胞内部的各种小活儿,比如支撑、运输,甚至处理细胞内的废物。
要把这俩地方的蛋白提取出来,做个实验研究,那可得有点技巧。
得分个清楚,咱们做的不是开玩笑的事。
要提取蛋白,第一步就是得打破细胞。
这可不是用锤子砸,咱们要小心翼翼地处理。
你想啊,细胞膜就像是个坚固的门,门外的细胞浆和门内的细胞核是完全不一样的区域,要提取蛋白,首先得“破门而入”。
所以,科学家们通常使用一种叫做“裂解缓冲液”的东西,这玩意儿就像是细胞膜的“拆迁队”,可以轻松把细胞膜弄开,释放出细胞内部的成分。
然后,大家要知道,细胞中有很多成分,除了咱们要的蛋白,还有一些小分子和其他杂七杂八的东西。
为了分离出想要的蛋白,科学家们会用离心机。
这个机器就像是个疯狂的洗衣机,转得又快又狠。
它的作用就是利用不同的沉淀速度,把细胞膜碎片、核酸、脂类等一一甩出去,最后把咱们需要的蛋白留下来。
说起来很简单,但实际上,控制好时间和速度很关键。
万一离心的时间过长或过短,结果可能就是“事倍功半”,要么提取不全,要么杂质太多。
细胞核和细胞浆里的蛋白怎么分开呢?这就是细胞提取蛋白的大诀窍!离心后,咱们会得到两种不同的液体,一个是上层的液体,叫做“细胞浆”,另一个则是下沉的固体部分,包含了细胞核。
凯基核蛋白和胞浆蛋白提取试剂盒Cat Number:For Research Use OnlyStore at -20℃ for one yearExpire date:一、 试剂盒说明本试剂盒用于从哺乳动物组织和培养细胞中提取核蛋白和/或胞浆蛋白,提取制备过程简便。
制备的核蛋白和胞浆蛋白能保持天然活性,并且纯度较高。
提取的蛋白可用于进一步的转录因子活性分析、凝胶阻滞实验(gel shift assay)、免疫共沉淀、Western Blotting、酶活性测定等后续蛋白质研究。
二、 试剂盒组份组份 KGP150 (50 test) KGP1100 (100 test) 储存温度Buffer A 25 mL 25 mL ×2 4℃Buffer B 1.5 mL 3.0 mL 4℃Buffer C 12.5 mL 25 mL 4℃DTT 50μL 100μL -20℃蛋白酶抑制剂 250μL 500μL -20℃PMSF(100mM)400μL 800μL -20℃三、操作步骤Ⅰ 实体组织蛋白的提取1、组织样本,将组织剪切成小块,加入适量的冰冷PBS均浆后,静置5 min ,弃沉淀,小心吸取上清转移至另一离心管中;2、上清4℃离心500×g,3 min,弃上清,估计细胞压积PCV(离心后的紧实细胞体积);3、每20μL细胞压积中,加入200μL预冷的Buffer A【使用前每mL Buffer A加入1μL DTT,5μL 100mM PMSF,5μL蛋白酶抑制剂】,最大转速涡旋剧烈振荡15s,放置冰上10~15min;4、加入11μL冷Buffer B,最大转速涡旋剧烈振荡5s,放置冰上1min;5、再次最大转速涡旋剧烈振荡5s后, 4℃离心,16000×g,5min;6、尽快将上清转入另一预冷的洁净微量离心管,置于冰上,即得胞浆蛋白;7、在离心沉淀物(细胞核)中加入100μL预冷的Buffer C (使用前每mL Buffer C加入1μL DTT,5μL 100mM PMSF,5μL蛋白酶抑制剂),最大转速涡旋剧烈振荡15s,放置冰上40min,每间隔10 min涡旋剧烈振荡15 seconds;8、4℃离心,16000×g,,10min,尽快将上清转入一预冷的洁净微量离心管,即得核蛋白;9、上述提取的胞浆蛋白和核蛋白进行蛋白定量(Braford法或BCA法),分装并保存于-80℃,避免反复冻融。
家畜病理学:是兽医科学的基础理论学科之一,是以辨证唯物主义哲学思想为指导,通过研究疾病的病因、发病机理和患病机体内所呈现的代谢、机能和形态结构的变化,来阐明疾病发生、发展及其转归的规律,为疾病的诊断和防治提供理论依据。
尸体剖检:是家畜病理学最基本的研究方法,它运用病理学有关技术和知识检查死亡动物尸体的各种变化,来研究疾病发生和发展的规律。
动物实验:在人为条件下,实验复制动物疾病的模型,并对其研究的方法。
主要用于动物疾病病因、发病机制以及发展过程的研究。
临床病理学研究:对自然发生疾病的动物,进行系统检查、实验室检查,以了解其疾病发生、发展过程的分析。
本研究方法是临床常见的研究方法。
活体组织检查:运用切除或穿刺的方法,从活体采取病变组织进行检查。
常用于肿瘤的诊断、某些病变性质的确定等。
组织培养和细胞培养:运用培养基,创造人为的细胞、组织生长条件,来研究选定细胞、组织的生长情况以及某些条件对细胞生长、代谢、形态变化的影响。
常见的有:病毒对细胞的作用研究、吞噬作用的研究等。
大体观察:用肉眼并辅以放大镜、量尺和衡器等对尸体、器官和组织中病变的大小、形状、重量、色泽、质度、分布、切面性状等进行观察和检测。
组织学观察:运用组织学方法(组织切片、染色技术、显微镜技术等)观察组织、细胞的病理变化。
常用的组织切片技术是石蜡切片、染色方法是苏木素-伊红染色法、主要运用光学显微镜。
细胞学观察:运用细胞涂片技术,对脱落的细胞、穿刺的细胞以及积液中的细胞进行染色、显微镜观察的过程。
临床较多见的是血液细胞涂片;细胞分析系统的运用(测定特定细胞的截面积、周长、直径、光密度等)。
组织化学和细胞化学观察:对组织切片运用化学的原理,采用化学试剂等与组织中的某些成分,发生化学反应,在局部形成特殊的有颜色的物质,以了解细胞的物质代谢变化。
超微结构观察:运用电子显微镜、超薄切片技术或金属镀膜技术对细胞内部(透射电镜技术)或表面微细结构(扫描电镜技术)进行观察的方法。
细胞核RNA提取引言细胞核RNA提取是一种常用的实验操作,在分子生物学研究和基因表达调控研究中具有重要意义。
本文将详细介绍细胞核RNA提取的原理、常用方法以及操作步骤,并讨论该技术在研究中的应用和局限性。
原理细胞核RNA提取是从细胞内分离纯化细胞核中的RNA,以便进行进一步的分析和研究。
细胞核RNA主要包括前体mRNA、原核转录产物、小核RNA等,其提取可以帮助我们了解转录和基因表达的调控机制。
细胞核RNA提取的原理基于细胞核在细胞破碎后形成颗粒状结构,并通过差速离心法或物理化学方法进行分离。
分离纯化后的核RNA可用于RT-PCR、Northern blot、RNA测序等分子生物学实验。
常用方法方案一:酚酸提取法1.将细胞破碎并离心沉淀,得到胞浆和细胞核沉淀。
2.使用三氯醋酸溶解胞浆并进行离心,得到核酸上清液。
3.将核酸上清液与等体积的酚-氯仿混合,并离心分离上清液。
4.将上清液与异丙醇混合,离心分离沉淀。
5.清洗沉淀,溶解并纯化核RNA。
方案二:柱式纯化法1.经过细胞破碎离心后,得到细胞核沉淀。
2.将细胞核沉淀溶解,加入酚酸盐缓冲液并离心。
3.将上清液通过RNA结合柱,使RNA与柱上的固相基质结合。
4.以适当的缓冲液洗脱杂质,再用低盐缓冲液提取纯化RNA。
5.温和的洗脱RNA,最终得到核RNA。
操作步骤下面将详细介绍酚酸提取法的操作步骤:1.获得培养细胞的离心培养物。
2.用PBS洗涤细胞,以去除培养物的残余。
3.加入适量的细胞裂解缓冲液,使细胞破裂并释放细胞核。
4.加入核酸酸性酚醛,溶解细胞膜。
5.用等体积的酚和氯仿混合,离心来分离核酸上清液。
6.将上清液与等体积的异丙醇混合,产生沉淀。
7.离心沉淀,去除上清液。
8.用70%乙醇洗涤沉淀,去除杂质。
9.用去酶水溶解RNA沉淀,得到纯化的细胞核RNA。
应用细胞核RNA提取技术在许多研究中起着重要作用,具有以下几个应用:1.基因表达调控研究:通过提取细胞核RNA,可以研究基因转录和调控机制,深入了解转录因子、启动子和增强子等与基因表达相关的元件。
内参选择Western Blot内参的选择,⽼司机都不知道这些窍门每⽇⽣物评论2017-01-31 21:15:13内参即是内部参照(Internal Control),对于哺乳动物细胞来说⼀般是指由管家基因编码表达的蛋⽩(Housekeeping Proteins),它们在各组织和细胞中的表达相对恒定,在检测蛋⽩的表达⽔平变化时常⽤它来做参照物。
⼀、为什么要使⽤内参呢?Western blot除了能证明某样品含有某种蛋⽩之外,其最为重要的作⽤是⽐较不同条件下或者不同组织中,⽬的蛋⽩表达量的相对多少。
即为蛋⽩表达⽔平最直接的证据。
要衡量蛋⽩的表达⽔平,前提条件就是等量的上样量。
然⽽如果仅将蛋⽩浓度测定作为规范需相互⽐较的各种样品间上样量等同的唯⼀⽅法,显然是不可取的。
⾸先各种蛋⽩质浓度定量⽅法都存在局限性,不能完全准确的确定各种样品的蛋⽩浓度。
如UV法直接定量,适合测试较纯净、成分相对单⼀的蛋⽩质,相对于⽐⾊法来说,操作简单,但是容易受到平⾏物质如DNA的⼲扰,且敏感度低,要求蛋⽩的浓度较⾼。
⽐⾊法测定蛋⽩浓度⼀般有BCA、Bradford、Lowry等⼏种⽅法。
BCA法与Lowry法都容易受到蛋⽩质之间以及去污剂的⼲扰。
Bradford法敏感度最⾼,且与⼀些列⼲扰Lowry、BCA反应的还原剂(如DTT、巯基⼄醇)相溶,但是对去污剂依然是敏感的,其最主要的缺点是不同的标准品会导致同⼀样品的结果差异较⼤,⽆可⽐性。
另外,蛋⽩质定量以后进⾏电泳时需要等量上样,此步骤也存在操作误差。
在Western Blot实验时使⽤内参,即可简便地对定量和上样步骤产⽣的误差进⾏校正。
在Western Blot中使⽤内参其实就是在WB过程中另外⽤内参对应的抗体检测内参,这样在检测⽬的产物的同时可以检测内参的表达,由于内参在各组织和细胞中的表达相对恒定,借助检测每个样品内参的量就可以⽤于校正上样误差,这样半定量的结果才更为可信。
胞浆/胞核提取(细胞)
一、胞浆蛋白的提取
1、估计细胞的量
5*1051*1065*106
Cytosol Extraction Buffer A(ul) 25 50-100 300-500 Cytosol Extraction Buffer B(ul) 1.2-1.5 3-6 18-30
Nuclear Extraction Buffer (ul) 5-10 20 100
2、每个培养皿PBS洗两次,吸干PBS(冰上操作)
3、每个培养皿加入150ul CEB-A,把细胞刮下,每个皿刮80次,直到无滑腻感,说明细胞全部刮下,将细胞转入EP管,注射器抽吸10次左右,充分裂解细胞
4、冰上孵育20min,每5min震荡10s
5、离心1000*g,4℃,5min,把上清液吸入新EP管内,为胞浆蛋白,沉淀物包含粗制核蛋白(尽量把上清吸干净)
一、细胞胞核蛋白的提取
1、粗制核蛋白由上述步骤5得到,去除膜成分,用100ul CEB-A加入5ul CEB-B,漩涡震荡10s,冰上孵育1min,在低温离心机中以1000*g,4℃,5min,倒上清,并收集细胞碎片
2、用100ul CEB-A清洗细胞核碎片,1000*g,4℃,5min,去上清
3、加入70-100ul 冰的NEB转移到粗制细胞核中涡旋
4、将EP管放到冰上孵育30min,并间隔震荡5次
5、1200*g,4℃,5min
6、将含有核蛋白的上清液转移到新的离心管中,-20℃保存。