31514 细菌胞质蛋白的提取方法
- 格式:pdf
- 大小:253.15 KB
- 文档页数:5
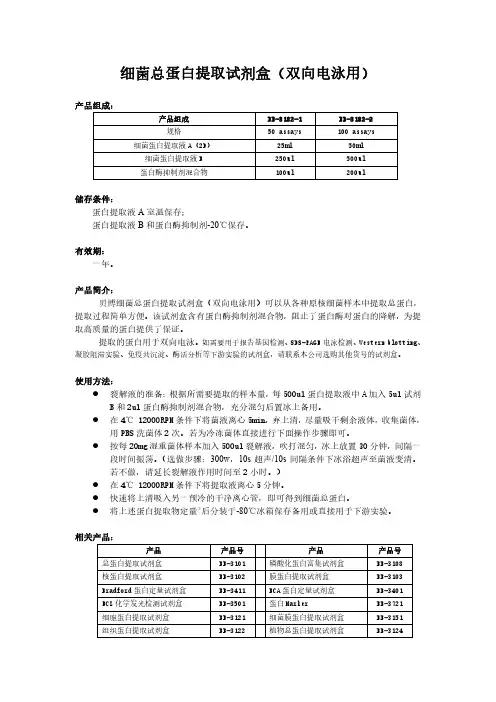

细菌总蛋白和膜蛋白提取方法一、从新鲜样品中提取总蛋白(简易法)1、自配裂解液(pH ):50 mM Tris-HCl,2 mM EDTA, 100 mM NaCl,% Triton X-100,调pH 值至备用;用前加入100 μg/ml 溶菌酶,1μl/ml 的蛋白酶抑制剂PMSF。
该裂解液用量为10-50ml 裂解液/1g湿菌体。
2、将40ml 菌液在12000g,4℃下离心15分钟收集菌体,沉淀用PBS悬浮洗涤2遍,沉淀加入1ml裂解液悬浮菌体。
3、超声粉碎,采用300w,10s超声/10s间隔,超声20min,反复冻融超声3次至菌液变清或者变色。
4、1000g离心去掉大碎片,上清可直接变性后PAGE电泳检测,或者用1% SDS溶液透析后冻存。
缺点:Western blotting结果表明,疏水性跨膜蛋白提取效率有限。
二、从Trizol裂解液中分离总蛋白1、Trizol溶解的样品研磨破碎后,加氯仿分层,2-8℃下10000g离心15min,上层水相用于RNA提取,体积约为总体积的60%。
2、用乙醇沉淀中间层和有机相中的DNA。
每使用1ml Trizol加入无水乙醇混匀,室温放置3min,2-8℃不超过2000g离心5min。
3、将上清移至新的EP管中,用异丙醇沉淀蛋白质。
每使用1ml Trizol加入异丙醇,室温放置10min,2-8℃下12000g离心10min,弃上清。
4、用含有0.3M 盐酸胍的95%乙醇洗涤。
每1ml Trizol加入2ml洗液,室温放置20min,2-8℃下7500g离心5min,弃上清,重复洗涤2次。
最后加入2ml无水乙醇,涡旋后室温放置20min,2-8℃下7500g离心5min,弃上清。
5、冷冻干燥5-10min,1%SDS溶液溶解,反复吹打,50℃温浴使其完全溶解,2-8℃下10000g 离心10min去除不溶物。
6、替代方案:将3中的酚醇上清液移至小分子量透析袋中,在2-8℃的1% SDS溶液中透析3次,1000g离心10min去除沉淀,上清可直接用于蛋白实验。

细菌总蛋白和膜蛋白提取方法一、从新鲜样品中提取总蛋白(简易法)1、自配裂解液(pH 8.5-9.0):50 mM Tris-HCl,2 mM EDTA, 100 mM NaCl,0.5% Triton X-100,调pH值至8.5-9.0备用;用前加入100 μg/ml 溶菌酶,1μl/ml 的蛋白酶抑制剂PMSF。
该裂解液用量为10-50ml 裂解液/1g湿菌体。
2、将40ml 菌液在12000g,4℃下离心15分钟收集菌体,沉淀用PBS悬浮洗涤2遍,沉淀加入1ml裂解液悬浮菌体。
3、超声粉碎,采用300w,10s超声/10s间隔,超声20min,反复冻融超声3次至菌液变清或者变色。
4、1000g离心去掉大碎片,上清可直接变性后PAGE电泳检测,或者用1% SDS溶液透析后冻存。
缺点:Western blotting结果表明,疏水性跨膜蛋白提取效率有限。
二、从Trizol裂解液中分离总蛋白1、Trizol溶解的样品研磨破碎后,加氯仿分层,2-8℃下10000g离心15min,上层水相用于RNA提取,体积约为总体积的60%。
2、用乙醇沉淀中间层和有机相中的DNA。
每使用1ml Trizol加入0.3ml无水乙醇混匀,室温放置3min,2-8℃不超过2000g离心5min。
3、将上清移至新的EP管中,用异丙醇沉淀蛋白质。
每使用1ml Trizol加入1.5ml异丙醇,室温放置10min,2-8℃下12000g离心10min,弃上清。
4、用含有0.3M 盐酸胍的95%乙醇洗涤。
每1ml Trizol加入2ml洗液,室温放置20min, 2-8℃下7500g离心5min,弃上清,重复洗涤2次。
最后加入2ml无水乙醇,涡旋后室温放置20min,2-8℃下7500g离心5min,弃上清。
5、冷冻干燥5-10min,1%SDS溶液溶解,反复吹打,50℃温浴使其完全溶解,2-8℃下10000g 离心10min去除不溶物。
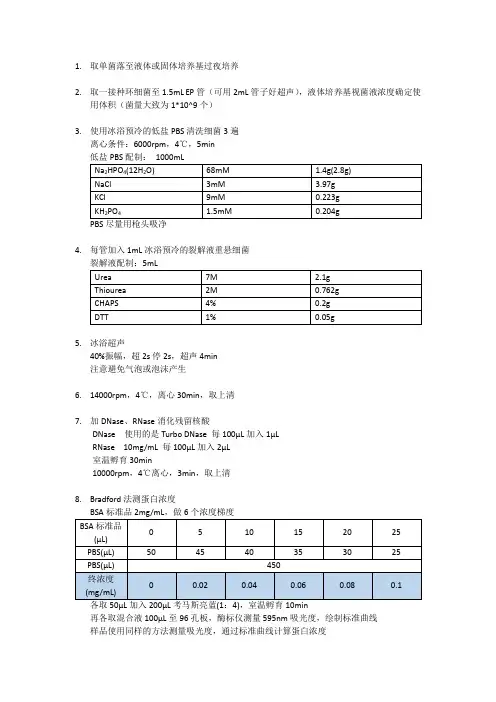
1.取单菌落至液体或固体培养基过夜培养
2.取一接种环细菌至1.5mL EP管(可用2mL管子好超声),液体培养基视菌液浓度确定使
用体积(菌量大致为1*10^9个)
3.使用冰浴预冷的低盐PBS清洗细菌3遍
离心条件:6000rpm,4℃,5min
PBS尽量用枪头吸净
4.每管加入1mL冰浴预冷的裂解液重悬细菌
5.冰浴超声
40%振幅,超2s停2s,超声4min
注意避免气泡或泡沫产生
6.14000rpm,4℃,离心30min,取上清
7.加DNase、RNase消化残留核酸
DNase使用的是Turbo DNase每100μL加入1μL
RNase 10mg/mL每100μL加入2μL
室温孵育30min
10000rpm,4℃离心,3min,取上清
8.Bradford法测蛋白浓度
各取50μL加入200μL考马斯亮蓝(1:4),室温孵育10min
再各取混合液100μL至96孔板,酶标仪测量595nm吸光度,绘制标准曲线
样品使用同样的方法测量吸光度,通过标准曲线计算蛋白浓度。

细菌总蛋白和膜蛋白提取方法一、从新鲜样品中提取总蛋白(简易法)1、自配裂解液( pH 8.5-9.0):50 mM Tris-HC,l 2 mM EDTA, 100 mM NaC,l 0.5% Triton X-10Q调pH值至8.5-9.0备用;用前加入100卩g/m溶菌酶,1卩l/ml 的蛋白酶抑制剂PMSF。
该裂解液用量为10-50ml 裂解液/1g 湿菌体。
2、将40ml菌液在12000g, 4C下离心15分钟收集菌体,沉淀用PBS悬浮洗涤 2 遍,沉淀加入1ml 裂解液悬浮菌体。
3、超声粉碎,采用300w, 10s超声/10s间隔,超声20min,反复冻融超声3 次至菌液变清或者变色。
4、1000g离心去掉大碎片,上清可直接变性后PAGE电泳检测,或者用1%SDS溶液透析后冻存。
缺点:Western blotting 结果表明,疏水性跨膜蛋白提取效率有限。
二、从Trizol 裂解液中分离总蛋白1、Trizol溶解的样品研磨破碎后,加氯仿分层,2-8C下10000g离心15min,上层水相用于RNA提取,体积约为总体积的60%2、用乙醇沉淀中间层和有机相中的DNA。
每使用1mlTrizol加入0.3ml无水乙醇混匀,室温放置3min, 28C不超过2000g离心5min。
3、将上清移至新的EP管中,用异丙醇沉淀蛋白质。
每使用1ml Trizol加入1.5ml异丙醇,室温放置10min, 28C下12000g离心10min,弃上清。
4、用含有0.3M 盐酸胍的95%乙醇洗涤。
每1ml Trizol 加入2ml 洗液,室温放置20min, 2-8C下7500g离心5min,弃上清,重复洗涤2次。
最后加入2ml 无水乙醇,涡旋后室温放置20min, 2-8C下7500g离心5min,弃上清。
5、冷冻干燥5-10min, 1%SDS容液溶解,反复吹打,50C温浴使其完全溶解,2-8C下10000g离心10min去除不溶物。

细菌总蛋白和膜蛋白提取方法一、从新鲜样品中提取总蛋白(简易法)1、自配裂解液(pH 8.5-9.0):50 mM Tris-HCl,2 mM EDTA, 100 mM NaCl,0.5% Triton X-100,调pH值至8.5-9.0备用;用前加入100 μg/ml 溶菌酶,1μl/ml 的蛋白酶抑制剂PMSF。
该裂解液用量为10-50ml 裂解液/1g湿菌体。
2、将40ml 菌液在12000g,4℃下离心15分钟收集菌体,沉淀用PBS悬浮洗涤2遍,沉淀加入1ml裂解液悬浮菌体。
3、超声粉碎,采用300w,10s超声/10s间隔,超声20min,反复冻融超声3次至菌液变清或者变色。
4、1000g离心去掉大碎片,上清可直接变性后PAGE电泳检测,或者用1% SDS溶液透析后冻存。
缺点:Western blotting结果表明,疏水性跨膜蛋白提取效率有限。
二、从Trizol裂解液中分离总蛋白1、Trizol溶解的样品研磨破碎后,加氯仿分层,2-8℃下10000g离心15min,上层水相用于RNA提取,体积约为总体积的60%。
2、用乙醇沉淀中间层和有机相中的DNA。
每使用1ml Trizol加入0.3ml无水乙醇混匀,室温放置3min,2-8℃不超过2000g离心5min。
3、将上清移至新的EP管中,用异丙醇沉淀蛋白质。
每使用1ml Trizol加入1.5ml异丙醇,室温放置10min,2-8℃下12000g离心10min,弃上清。
4、用含有0.3M 盐酸胍的95%乙醇洗涤。
每1ml Trizol加入2ml洗液,室温放置20min, 2-8℃下7500g离心5min,弃上清,重复洗涤2次。
最后加入2ml无水乙醇,涡旋后室温放置20min,2-8℃下7500g离心5min,弃上清。
5、冷冻干燥5-10min,1%SDS溶液溶解,反复吹打,50℃温浴使其完全溶解,2-8℃下10000g 离心10min去除不溶物。

提取菌体全蛋白
菌体活化,培养,离心后用PBS洗3次,加入裂解液进行悬浮,超声破碎(约400W,工作10s,间歇10s,30个循环,共3-4次),12000r离心20min,取上清,加丙酮,丙酮:裂解液约为4-5:1,可置于冰箱4o C过夜,去上清,取沉淀,然后再用预冷丙酮洗3次,前两次为100%丙酮,第3次为90%丙酮,然后采用氮吹或者放置去丙酮,待沉淀中丙酮挥发完全后即为提取的粗蛋白。
裂解液配方:6M尿素,2M硫脲,65mM DTT,Bio-lyte 1mL,4%CHAPS,40mM Trisbase,加超纯水至终体积20mL。
注:新鲜配制或-20o C冻存,使用时加入cocktail蛋白酶抑制剂和DTT存储液至DTT终浓度为1%,例如,200uL裂解液中加入13uL 15.5×的DTT存储液。
注意事项:
一、如何判断是否超声完全:
1、外观判断:超声前菌悬液是浑浊的,超声完全后变的透明,清澈。
2、液体的粘滞性:超声后菌液从枪头滴下不粘连。
3、高速离心:离心之后的沉淀是未破碎或破碎不完全的菌体。
二、一些需要注意的问题:
1、丙酮要提前至于-20o C预冷。
2、如果超声出现黑色沉淀,说明超声功率太强,可适当减小功率。
3、超声时间不宜过长,否则会对蛋白活性有影响。
4、尽量防止泡沫的产生。
5、超声过程中,要将菌体至于冰浴条件下,防止超声过程中温度过高对蛋白产生影响。

1,弃去培养基用PBS洗2次后,加入冷的裂解液,裂解液配方:50 mM Hepes, 150 mM NaCl, 3 mM MgCl2, 调整pH至7.5, 根据需要加入蛋白酶抑制剂,有钱可以买pierce的蛋白酶抑制剂鸡尾酒(英文好像是cocktail)。
2,在裂解液中用细胞刮子收集所有细胞,转移裂解液至EP管,用21号针头反复吹打裂解细胞。
3,1000g*3min离心,将上清转移至另一EP管(A管),沉淀用适量含1%SDS的裂解液(上述裂解液加入SDS)溶解即可得到核蛋白。
4,将A管上清21460g*1h 4 °C离心,即可得到胞浆蛋白(上清)和胞膜/骨架蛋白(沉淀)。
对于沉淀根据需要有两种处理,
A, 将沉淀用含SDS的裂解液溶解,即可得到溶于SDS的胞膜/骨架蛋白。
B, 将沉淀用含TritonX-100裂解液(100 mM phosphate buffer, 150 mM NaCl, measured pH 8, 1.5% TritonX-100, 10% glycerol, plus inhibitors)溶解,即可得到溶于Triton X-100(Sol)的胞膜/骨架蛋白,转移上清后剩下沉淀使用含SDS裂解液溶解,即可得到不溶于Triton X-100(Insol)的胞膜/骨架蛋白。

一种大肠杆菌细胞周质蛋白的提取方法大肠杆菌是一种常见的细菌,它在生物学和生物工程领域中被广泛应用。
大肠杆菌细胞周质蛋白是一类重要的蛋白质,它在细菌的细胞结构和代谢过程中扮演着重要角色。
提取大肠杆菌细胞周质蛋白对于研究细菌生长、代谢和相关疾病具有重要意义。
本文将介绍一种用于提取大肠杆菌细胞周质蛋白的方法,并探讨其在研究和应用中的意义。
1. 方法介绍我们需要了解大肠杆菌细胞周质蛋白的特性和结构。
细胞周质蛋白通常位于细菌细胞壁周围,起到维护细胞形状和保护细胞内部免受外界环境的影响。
提取细胞周质蛋白需要一定的技术和方法支持。
在实际操作中,一种常用的提取方法是利用生物化学技术和分离纯化技术相结合。
细胞周质蛋白需要从大肠杆菌的细胞壁中分离出来,这需要利用酶解和化学方法来破坏细胞壁,释放出蛋白质。
随后,通过差速离心、过滤和层析等技术,可以将细胞周质蛋白从其他细胞组分中分离出来,得到纯净的蛋白质样品。
2. 意义和应用提取大肠杆菌细胞周质蛋白的方法在生物工程和医学研究中具有重要应用价值。
利用这些提取的蛋白质样品,可以对细菌的结构和功能进行深入研究,有助于揭示细菌生长和代谢的机制。
另细菌细胞周质蛋白还可以作为药物靶点或疫苗候选物,用于研究和开发抗菌药物或疫苗。
3. 个人观点和理解作为一种重要的蛋白质组分,大肠杆菌细胞周质蛋白的研究和应用具有重要意义。
通过掌握提取方法,可以更好地理解细菌的生物学特性和生理功能。
在未来的研究和应用中,提取方法的改进和创新将为深入探索细菌的奥秘和开发新型药物提供重要支持。
总结和回顾通过本文对一种提取大肠杆菌细胞周质蛋白的方法的介绍,我们对这一重要的生物学研究课题有了基本的了解。
提取方法的掌握对于研究和应用都具有重要的意义,希望未来能够有更多科研人员投入到这一领域,为生物学和医学研究做出更大的贡献。
在本文中,我们深入探讨了提取大肠杆菌细胞周质蛋白的方法及其意义,希望能够为读者提供有益的知识和启发。

蛋白质提取原理
蛋白质是生物体中最重要的大分子有机化合物之一,它在细胞生长、代谢、分化、修复和调节等方面起着重要作用。
因此,研究蛋白质的提取原理对于生物学、医学和食品工业等领域具有重要意义。
蛋白质提取的原理主要包括细胞破碎、蛋白质溶解和分离纯化三个步骤。
首先,细胞破碎是蛋白质提取的第一步。
细胞破碎的方法有多种,包括机械破碎、超声波破碎、高压破碎等。
在细胞破碎的过程中,需要注意保持蛋白质的完整性和活性,避免因过度破碎而导致蛋白质的降解和失活。
其次,蛋白质溶解是蛋白质提取的第二步。
蛋白质通常存在于细胞的不同部位,如细胞质、细胞核、线粒体等,因此需要采用不同的方法来溶解蛋白质。
常用的蛋白质溶解方法包括盐溶解、酸碱溶解、有机溶解等。
在蛋白质溶解的过程中,需要控制溶解条件,如温度、pH值、离子强度等,以保证蛋白质的溶解率和活性。
最后,分离纯化是蛋白质提取的第三步。
蛋白质的分离纯化通常采用离心、过滤、电泳、层析等方法。
在分离纯化的过程中,需要根据蛋白质的特性和目的进行选择合适的分离纯化方法,以获得高纯度和活性的蛋白质。
总之,蛋白质提取的原理是一个系统工程,需要综合运用生物学、化学、物理学等知识,合理选择合适的提取方法和条件,才能获得高质量的蛋白质。
希望本文的介绍能够帮助大家更好地理解蛋白质提取的原理,为相关研究和应用提供参考。
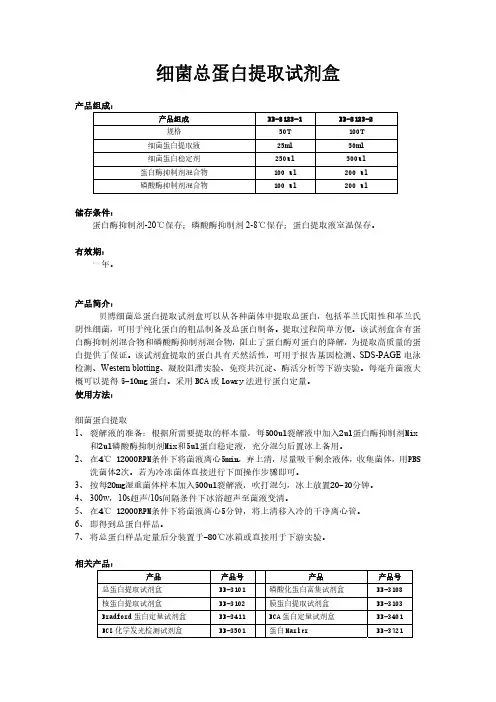
细菌总蛋白的提取方法(总2页) -CAL-FENGHAI.-(YICAI)-Company One1-CAL-本页仅作为文档封面,使用请直接删除细菌总蛋白和膜蛋白提取方法一、从新鲜样品中提取总蛋白(简易法)1、自配裂解液(pH ):50 mM Tris-HCl,2 mM EDTA, 100 mM NaCl,% Triton X-100,调pH值至备用;用前加入100 μg/ml 溶菌酶,1μl/ml 的蛋白酶抑制剂PMSF。
该裂解液用量为10-50ml 裂解液/1g湿菌体。
2、将40ml 菌液在12000g,4℃下离心15分钟收集菌体,沉淀用PBS悬浮洗涤2遍,沉淀加入1ml裂解液悬浮菌体。
3、超声粉碎,采用300w,10s超声/10s间隔,超声20min,反复冻融超声3次至菌液变清或者变色。
4、1000g离心去掉大碎片,上清可直接变性后PAGE电泳检测,或者用1% SDS 溶液透析后冻存。
缺点:Western blotting结果表明,疏水性跨膜蛋白提取效率有限。
二、从Trizol裂解液中分离总蛋白1、Trizol溶解的样品研磨破碎后,加氯仿分层,2-8℃下10000g离心15min,上层水相用于RNA提取,体积约为总体积的60%。
2、用乙醇沉淀中间层和有机相中的DNA。
每使用1ml Trizol加入无水乙醇混匀,室温放置3min,2-8℃不超过2000g离心5min。
3、将上清移至新的EP管中,用异丙醇沉淀蛋白质。
每使用1ml Trizol加入异丙醇,室温放置10min,2-8℃下12000g离心10min,弃上清。
4、用含有盐酸胍的95%乙醇洗涤。
每1ml Trizol加入2ml洗液,室温放置20min, 2-8℃下7500g离心5min,弃上清,重复洗涤2次。
最后加入2ml无水乙醇,涡旋后室温放置20min,2-8℃下7500g离心5min,弃上清。
5、冷冻干燥5-10min,1%SDS溶液溶解,反复吹打,50℃温浴使其完全溶解,2-8℃下10000g离心10min去除不溶物。
蛋白质提取的方法总汇蛋白质提取的方法总汇中国生命科学论坛Ⅰ、植物组织蛋白质提取方法(summer)1、根据样品重量(1g样品加入3.5ml提取液,可根据材料不同适当加入),准备提取液放在冰上。
2、把样品放在研钵中用液氮研磨,研磨后加入提取液中在冰上静置(3-4小时)。
3、用离心机离心8000rpm40min4℃或11100rpm20min4℃4、提取上清夜,样品制备完成。
蛋白质提取液:300ml1、1Mtris-HCl(PH8) 45ml2、甘油(Glycerol)75ml3、聚乙烯吡咯烷酮(Polyvinylpolypyrrordone)6g这种方法针对SDS-PAGE,垂直板电泳!Ⅱ、三氯醋酸—丙酮沉淀法1、在液氮中研磨叶片2、加入样品体积3倍的提取液在-20℃的条件下过夜,然后离心(4℃8000rpm以上1小时)弃上清。
3、加入等体积的冰浴丙酮(含0.07%的β-巯基乙醇),摇匀后离心(4℃8000rpm以上1小时),然后真空干燥沉淀,备用。
4、上样前加入裂解液,室温放置30分钟,使蛋白充分溶于裂解液中,然后离心(15℃8000rpm以上1小时或更长时间以没有沉淀为标准),可临时保存在4℃待用。
5、用Brandford法定量蛋白,然后可分装放入-80℃备用。
药品:提取液:含10%TCA和0.07%的β-巯基乙醇的丙酮裂解液:2.7g尿素0.2gCHAPS溶于3ml灭菌的去离子水中(终体积为5ml),使用前再加入1M的DTT65ul/ml。
这种方法针对双向电泳,杂质少,离子浓度小的特点!当然单向电泳也同样适用,只是电泳的条带会减少!Ⅲ、组织:肠黏膜(newinbio)目的:WESTERN BLOT检测凋亡相关蛋白的表达应用TRIPURE提取蛋白质步骤:1.含蛋白质上清液中加入异丙醇:(1.5ml每1mlTRIPURE用量)2.倒转混匀,置室温10min3.离心:12000 g,10min,4度,弃上清4.加入0.3M盐酸胍/95%乙醇:(2ml每1mlTRIPURE用量)5.振荡,置室温20min6.离心: 7500g,5 min,4度,弃上清7.重复0.3M盐酸胍/95%乙醇步2次8.沉淀中加入100%乙醇 2ml9.充分振荡混匀,置室温20 min10.离心: 7500g,5min,4度,弃上清吹干沉淀11.1%SDS溶解沉淀12.离心:10000g,10min,4度13.取上清-20度保存(或可直接用于WESTERN BLOT)存在的问题:加入1%SDS后沉淀不溶解,还是很大的一块,4度离心后又多了白色沉定,SDS结晶?测浓度,含量才1mg/ml左右。
细菌总蛋白和膜蛋白提取方法一、从新鲜样品中提取总蛋白(简易法)1、自配裂解液(pH 8.5-9.0):50 mM Tris-HCl,2 mM EDTA, 100 mM NaCl,0.5% Triton X-100,调pH值至8.5-9.0备用;用前加入100 μg/ml 溶菌酶,1μl/ml 的蛋白酶抑制剂PMSF。
该裂解液用量为10-50ml 裂解液/1g湿菌体。
2、将40ml 菌液在12000g,4℃下离心15分钟收集菌体,沉淀用PBS悬浮洗涤2遍,沉淀加入1ml裂解液悬浮菌体。
3、超声粉碎,采用300w,10s超声/10s间隔,超声20min,反复冻融超声3次至菌液变清或者变色。
4、1000g离心去掉大碎片,上清可直接变性后PAGE电泳检测,或者用1% SDS溶液透析后冻存。
缺点:Western blotting结果表明,疏水性跨膜蛋白提取效率有限。
二、从Trizol裂解液中分离总蛋白1、Trizol溶解的样品研磨破碎后,加氯仿分层,2-8℃下10000g离心15min,上层水相用于RNA提取,体积约为总体积的60%。
2、用乙醇沉淀中间层和有机相中的DNA。
每使用1ml Trizol加入0.3ml无水乙醇混匀,室温放置3min,2-8℃不超过2000g离心5min。
3、将上清移至新的EP管中,用异丙醇沉淀蛋白质。
每使用1ml Trizol加入1.5ml异丙醇,室温放置10min,2-8℃下12000g离心10min,弃上清。
4、用含有0.3M 盐酸胍的95%乙醇洗涤。
每1ml Trizol加入2ml洗液,室温放置20min,2-8℃下7500g离心5min,弃上清,重复洗涤2次。
最后加入2ml无水乙醇,涡旋后室温放置20min,2-8℃下7500g离心5min,弃上清。
5、冷冻干燥5-10min,1%SDS溶液溶解,反复吹打,50℃温浴使其完全溶解,2-8℃下10000g 离心10min去除不溶物。
利用渗透休克法提取大肠杆菌周质蛋白的机制1. 引言大肠杆菌(Escherichia coli)是一种常见的革兰氏阴性杆菌,存在于许多生物体的肠道中。
大肠杆菌周质蛋白是一类与菌体外环境密切相关的蛋白质,研究其机制对于深入了解大肠杆菌的生物学特性和与宿主的相互作用具有重要意义。
渗透休克法是一种常用的蛋白提取方法,通过利用渗透压的变化来破坏细胞膜,释放出细胞内蛋白质。
本文将探讨利用渗透休克法提取大肠杆菌周质蛋白的机制。
2. 渗透休克法的基本原理渗透休克法是一种通过改变细胞周围环境的渗透压来破坏细胞膜而释放细胞内物质的方法。
其基本原理如下:1.建立高渗透环境:通过向培养基中添加高浓度的溶质(如聚乙二醇),增加培养基的渗透压,使得培养基的渗透压高于细胞内的渗透压。
2.细胞膜破裂:高渗透环境下,细胞外溶质浓度高于细胞内溶质浓度,导致水分子从细胞内向细胞外流动,细胞内的渗透压降低。
由于渗透压差,细胞膜受到张力的作用,最终破裂,使得细胞内的物质释放出来。
3.蛋白提取:细胞膜破裂后,细胞内的蛋白质会释放到培养基中,可以通过离心等方式将其分离出来,从而实现蛋白质的提取。
3. 渗透休克法提取大肠杆菌周质蛋白的步骤利用渗透休克法提取大肠杆菌周质蛋白可以按照以下步骤进行:3.1 培养大肠杆菌在培养基中培养大肠杆菌,可以选择适合大肠杆菌生长的培养基(如Luria-Bertani(LB)培养基)。
确保菌体生长到适当的密度,一般为光密度值(OD600)在0.6左右。
3.2 采集菌体用无菌工具(如无菌吸管)或离心机采集大肠杆菌的菌体。
将菌体转移到无菌离心管中。
3.3 制备高渗透培养基准备含有高浓度溶质(如聚乙二醇)的培养基,增加培养基的渗透压。
确保高渗透培养基的渗透压高于大肠杆菌的细胞内渗透压。
3.4 渗透休克处理将采集到的大肠杆菌菌体转移到高渗透培养基中,使细胞受到高渗透环境的刺激。
可以通过搅拌、振荡等方式加强渗透作用。
处理时间一般为几分钟至数十分钟。