甘氨酸锌螯合物的合成及锌含量的测定开放性实验实验报告
- 格式:doc
- 大小:467.50 KB
- 文档页数:6

甘氨酸微量元素化合物的室温固相合成及检测的开题报告摘要:甘氨酸是一种重要的氨基酸,它含有丰富的亲水性官能团和活性官能团。
在生物和医药领域中具有重要的应用价值。
但是,由于甘氨酸在许多有机溶剂中的溶解度很差,因此它的制备和使用存在一定的限制。
因此,开发一种可行、简单、高效的方法来获得甘氨酸及其微量元素化合物是十分必要的。
本研究旨在通过室温固相合成法合成含有甘氨酸和微量元素的化合物,并建立检测方法,为相关领域的研究提供一个新的方法。
关键词:甘氨酸,微量元素,室温固相合成,检测方法引言:甘氨酸在生物和医药领域中有着广泛的应用价值,如用作生物纪录剂、药物中间体和食品添加剂。
其中,微量元素对生命过程有着重要的影响,因此含有微量元素的甘氨酸化合物也备受关注。
目前,已有多种方法可用于甘氨酸的制备,但大多数方法都存在一些问题,如产率低、环境污染等。
固相合成法是一种可行的合成方法,它具有高效、可控、简单、易于操作、产率高等优点,已经成为化学合成中的一种重要方法。
此外,室温固相合成法还可以减少溶剂的使用,从而降低对环境的污染。
在本研究中,我们将使用室温固相合成法来制备含有甘氨酸和微量元素的化合物,并建立相应的检测方法。
这将为相关领域的研究提供一个新的方法和途径。
研究内容:1. 合成各种含有甘氨酸和微量元素的化合物,并对其进行表征分析。
2. 优化反应条件,确定最佳反应温度、时间和物质比例,提高产率。
3. 建立检测方法,如红外光谱、核磁共振等。
预期成果:1. 完成室温固相合成法制备含有甘氨酸和微量元素的化合物。
2. 确定反应条件,提高产率,并建立相应的检测方法。
3. 探究甘氨酸和微量元素化合物的性质和应用价值,为相关领域的研究提供参考。
结论:甘氨酸和微量元素化合物的合成是一个复杂的过程,需要在反应条件、物质比例等方面进行优化。
本研究提出了一种室温固相合成法来制备含有甘氨酸和微量元素的化合物,并建立相应的检测方法。
该方法具有高效、可控、简单、易于操作、产率高等优点,可以为相关领域的研究提供一个新的方法和途径。

化学实验测定某种药物中锌含量某种药物中锌的化学实验测定一、实验目的本实验旨在通过化学方法,测定某种药物中锌的含量。
二、实验原理锌的测定常采用比色法。
锌离子与特定试剂(如Zincon)发生螯合反应,形成紫色络合物,其吸光度与锌的浓度呈线性关系。
通过测定紫色络合物的吸光度,并通过标准曲线法计算锌的含量。
三、实验器材和试剂1. 器材:分析天平、移液管、比色皿、分光光度计等。
2. 试剂:某种药物样品、硫酸、硝酸、Zincon试剂等。
四、实验步骤1. 样品的前处理:a. 将某种药物样品取出适量,用分析天平称量。
b. 将样品溶解在适量的硫酸中。
c. 将溶解后的样品加热,使其浓缩。
d. 冷却后,加入适量的硝酸,使样品溶液呈现透明状态。
e. 用去离子水稀释,使样品溶液体积达到一定范围。
2. 样品中锌的测定:a. 取一定体积的稀释后的样品溶液,并加入适量的Zincon试剂。
b. 搅拌均匀后,静置片刻,使出现紫色络合物。
c. 使用分光光度计,设置在特定波长下,测定紫色络合物的吸光度值。
d. 利用已知浓度锌标准溶液,绘制锌的标准曲线。
五、数据处理1. 通过比对样品溶液在标准曲线上的吸光度值,确定样品中锌的含量。
2. 根据实验记录,计算样品的平均锌含量以及相对标准偏差。
六、实验注意事项1. 操作过程中需佩戴安全眼镜、实验手套等个人防护装备。
2. 实验器材和试剂需严格按照化学实验常规进行管理和操作。
3. 比色皿等实验容器应保持清洁,以避免污染和误差产生。
七、实验安全提示1. 实验期间要注意身体姿势,避免意外溅溶液或受热等情况发生。
2. 实验后将废弃物品妥善处理,以防止对环境造成污染。
3. 如有实验不慎损伤或其他紧急情况,应及时寻求专业人员的帮助。
八、实验结果及讨论根据实验记录的数据和计算,得出某种药物中锌的含量为X mg/L,并计算出相对标准偏差为X%。
对于该实验结果,可以进一步分析药物的质量控制和相关标准要求。
九、实验结论本实验通过化学比色法测定某种药物中锌的含量,得到了X mg/L的结果,并计算出相对标准偏差为X%。

实验11 甘氨酸锌螯合物的合成与表征一、实验目的1. 掌握氨基酸金属配合物的合成方法,巩固有关分离提纯方法。
2. 熟悉配合物的组成测定和结构表征方法。
二、实验原理锌是人和动物必需的微量元素,它具有加速生长发育、改善味觉、调节肌体免疫、防止感染和促进伤口愈合等功能,缺锌会产生多种疾病。
补锌的药物有硫酸锌、甘草酸锌、乳酸锌、葡萄糖酸锌等。
由于氨基酸所特有的生理功能,氨基酸与锌的螯合物可直接由肠道消化吸收,具有吸收快、利用率高等优点,还具有双重营养性和治疗作用,是一种理想的补锌制剂。
甘氨酸锌为白色针状晶体,熔点282~284 ℃,易溶于水,不溶于醇、醚等有机溶剂,水溶液呈微碱性。
其合成方法有多种,本实验以甘氨酸和碱式碳酸锌为原料,固液相反应法合成甘氨酸锌螯合物,通过元素分析、IR、DSC-TG、XRD等方法进行组成和结构表征。
三、主要仪器与试剂1.仪器抽滤瓶,布氏漏斗,烧杯,蒸发皿,量筒,台秤,水浴锅,恒温磁力搅拌器,元素分析仪,X射线粉末衍射仪,红外光谱仪,综合热分析仪。
2.试剂甘氨酸(分析纯),碱式碳酸锌 (分析纯),乙醇(分析纯)。
四、实验步骤1.甘氨酸锌的制备6.0 g (80 mmol)甘氨酸溶于100 mL水中,加入6.3 g (28 mmol)碱式碳酸锌,95℃下加热搅拌反应4 h,趁热过滤,滤液于水浴上缓慢加热浓缩至晶膜出现,冷却,析出大量白色晶体,抽滤,用乙醇洗涤,晶体于P2O5干燥器中干燥,得产品甘氨酸锌,称重,并计算产率。
2.甘氨酸锌的表征将样品于500 ℃灰化后用EDTA配位滴定法测定螯合物中锌的含量,C、H、N含量用元素分析仪测定。
根据元素分析结果,推断配合物的组成。
用KBr压片法测定甘氨酸锌在400~4000 cm-1的红外光谱。
在综合热分析仪上以Al2O3为参比物在空气中测定配合物的DSC-TG 曲线,升温速度为10 ℃·min-1,并分析其热分解过程。
测定该配合物的X射线粉末衍射图谱,并进行物相分析。


饲料添加剂甘氨酸锌1 范围本标准规定了饲料添加剂甘氨酸锌的要求、实验方式、查验规那么、标签、包装、贮存、运输和保质期。
本标准适用于我省以甘氨酸、硫酸锌为原料,经化学合成制得的饲料添加剂甘氨酸锌的生产、销售与查验。
分子式:C4H30N2O22S2Zn2。
相对分子质量:(按2005年国际相对原子质量)。
化学结构简式:〔Zn(C2H5NO2)2SO4•4H2O〕•〔ZnSO4•6H2O〕。
2 标准性引用文件以下文件关于本文件的应用是必不可少的。
凡是注日期的引用文件,仅注日期的版本适用于本文件。
凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/T 601 化学试剂标准滴定溶液的制备GB/T 饲料粉碎粒度测定两层筛筛分法GB/T 6432 饲料中粗蛋白的测定方式GB/T 6682 分析实验室用水规格和实验方式GB 10648 饲料标签GB/T 13079 饲料中总砷的测定GB/T 13080 饲料中铅的测定原子吸收光谱法GB/T 饲料采样GB/T 18823 饲料检测结果判定的许诺误差3 要求外观和性状本品为白色结晶或结晶性粉末,无结块,易潮解,易溶于水。
技术指标技术指标见表1。
表1 技术指标干燥失重干燥失重应≤10%。
粉碎粒度95%通过(20目)分析筛。
4 实验方式除还有说明外,所用试剂为分析纯,实验室用水应符合GB /T 6682中三级水的规定。
外观和性状感官检测。
锌的检测4.2.1 试剂和溶液4.2.1.1(1+10)盐酸溶液:取100mL浓盐酸缓缓加入到1000mL水中,即得。
4.2.1.2 (1+1)氨水溶液:取水100mL加入到100mL浓氨水中,即得。
4.2.1.3250g/L硫酸钠溶液:取硫酸钠25g,加水使溶解成100mL,即得。
4.2.1.410g/L双硫腙四氯化碳溶液:取双硫脘1g加四氯化碳使其溶解至100mL,即得,利用期为两周。
4.2.1.5三氯甲烷。
4.2.1.6 (1+3)盐酸溶液:取250mL浓盐酸缓缓加入到750mL水中,即得。

一、实验目的1. 学习甘氨酸的提取和鉴定方法;2. 掌握分光光度法测定甘氨酸含量的原理和操作步骤;3. 提高实验操作技能,培养严谨的科学态度。
二、实验原理甘氨酸(Gly)是一种氨基酸,具有两性性质,在酸性条件下,甘氨酸会发生两性离解,生成甘氨酸正离子和氢离子。
在特定波长下,甘氨酸正离子与显色剂反应,形成有颜色的配合物。
根据配合物的吸光度与甘氨酸浓度成正比的关系,可以测定甘氨酸的含量。
三、实验仪器与试剂1. 仪器:紫外-可见分光光度计、移液器、容量瓶、试管、烧杯等。
2. 试剂:甘氨酸标准溶液、盐酸、氢氧化钠、显色剂、蒸馏水等。
四、实验步骤1. 标准曲线绘制(1)配制一系列不同浓度的甘氨酸标准溶液,浓度为0、0.2、0.4、0.6、0.8、1.0、1.2 mg/mL。
(2)取适量甘氨酸标准溶液于试管中,加入一定量的盐酸,使溶液pH值调至6.5。
(3)加入显色剂,混匀,室温下放置5分钟。
(4)以蒸馏水为空白,在特定波长下测定吸光度。
(5)以甘氨酸浓度为横坐标,吸光度为纵坐标,绘制标准曲线。
2. 样品测定(1)准确称取一定量的样品,加入适量盐酸,使溶液pH值调至6.5。
(2)加入显色剂,混匀,室温下放置5分钟。
(3)以蒸馏水为空白,在特定波长下测定吸光度。
(4)根据标准曲线,计算样品中甘氨酸的含量。
五、实验结果与分析1. 标准曲线绘制以甘氨酸浓度为横坐标,吸光度为纵坐标,绘制标准曲线。
根据线性回归方程,得到标准曲线的方程为:y = 0.0176x + 0.0068,相关系数R² = 0.997。
2. 样品测定根据标准曲线,计算样品中甘氨酸的含量。
设样品中甘氨酸浓度为x mg/mL,根据标准曲线方程,有:x = (y - 0.0068) / 0.0176计算得到样品中甘氨酸浓度为0.9 mg/mL。
六、实验结论通过本实验,成功绘制了甘氨酸标准曲线,并测定了样品中甘氨酸的含量。
实验结果表明,本实验方法操作简便、准确度高,适用于甘氨酸的测定。
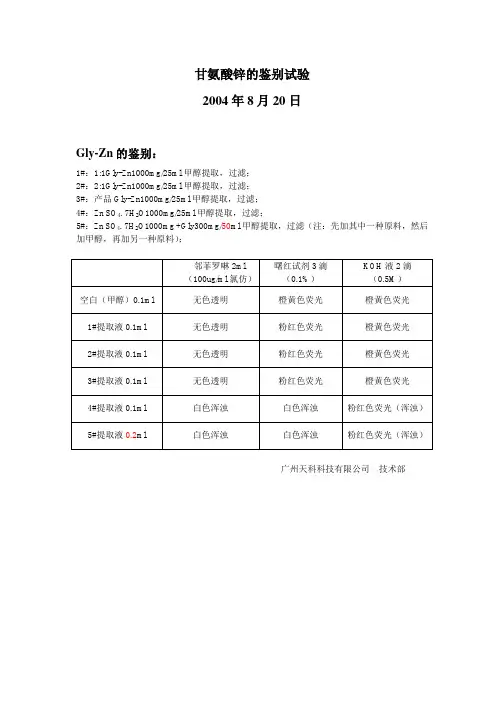
甘氨酸锌的鉴别试验
2004年8月20日
Gly-Zn的鉴别:
1#:1:1Gly-Zn1000mg/25ml甲醇提取,过滤;
2#:2:1Gly-Zn1000mg/25ml甲醇提取,过滤;
3#:产品Gly-Zn1000mg/25ml甲醇提取,过滤;
4#:Zn SO4. 7H2O1000mg/25ml甲醇提取,过滤;
5#:Zn SO4. 7H2O1000mg +Gly300mg/50ml甲醇提取,过滤(注:先加其中一种原料,然后加甲醇,再加另一种原料);
邻菲罗啉2ml (100ug/ml氯仿)曙红试剂3滴
(0.1%)
KOH液2滴
(0.5M)
空白(甲醇)0.1ml 无色透明橙黄色荧光橙黄色荧光
1#提取液0.1ml 无色透明粉红色荧光橙黄色荧光
2#提取液0.1ml 无色透明粉红色荧光橙黄色荧光
3#提取液0.1ml 无色透明粉红色荧光橙黄色荧光
4#提取液0.1ml 白色浑浊白色浑浊粉红色荧光(浑浊)5#提取液0.2ml 白色浑浊白色浑浊粉红色荧光(浑浊)
广州天科科技有限公司技术部。

甘氨酸锌螯合物的合成与结构表征钟国清【期刊名称】《精细化工》【年(卷),期】2001(18)7【摘要】以甘氨酸和碱式碳酸锌为原料合成了甘氨酸锌螯合物 ,最佳工艺条件为 :n (甘氨酸)∶n(碱式碳酸锌) =1 0 0∶0 35 ,温度95℃ ,反应时间 8h ,产率≥ 92 %。
用元素分析、红外光谱、热重差热分析、X射线粉末衍射对螯合物进行了表征 ,其组成为[Zn(NH2 CH2 COO) 2 ]·H2 O。
X射线粉末衍射数据指标化结果表明所合成的螯合物属于单斜晶系 ,晶胞参数为 :a =0 76 42nm ,b =1 182 7nm ,c =1 6 46 5nm ,β=81 75° ,V =1 472 7nm3 。
【总页数】3页(P391-393)【关键词】药物;甘氨酸锌螯合物;碱式碳酸锌;X射线粉末衍射数据指标化;合成;结构表征【作者】钟国清【作者单位】四川畜牧兽医学院基础部【正文语种】中文【中图分类】TQ462.24【相关文献】1.蝎型螯合过渡金属配合物的研究(Ⅱ)含多吡唑硼酸盐配体的锌/镉(Ⅱ)蝎合物的合成、表征及晶体结构 [J], 邓元;王如骥;孙素琴;冯玉萍;丁廷桢2.蝎型螯合过渡金属配合物的研究(Ⅰ)──氢三(3-对甲氧基苯基吡唑-1)硼酸铜(Ⅱ)配合物的合成、表征及晶体结构 [J], 邓元;王如骥;李勇;孙素琴;丁廷桢3.一水合甘氨酸锌螯合物的合成及其表征 [J], 管海跃;崔艳丽;毛建卫4.甘氨酸锌类螯合物GZC的合成和用作PVC热稳定剂的研究 [J], 蔡海军;吕立新5.超声辅助水相合成甘氨酸锌螯合物 [J], 刘培杰;黄桂田;凌绍明因版权原因,仅展示原文概要,查看原文内容请购买。

甘氨酸微量元素螯合物的合成与表征研究的开题报告
标题:甘氨酸微量元素螯合物的合成与表征研究
一、研究背景和意义
微量元素是生物体中非常重要的化学元素,常常以螯合物的形式出现。
甘氨酸是一种天然氨基酸,在人体中有多种生理功能,如抗氧化、改善心血管健康、增强免疫功能等。
因此,甘氨酸与微量元素的螯合物可能对人体健康产生重要的影响。
本研究旨在合成甘氨酸与微量元素的螯合物并对其进行表征,以期探究其生物活性和潜在的医学应用价值。
二、研究目的
1. 合成甘氨酸与微量元素的螯合物。
2. 对合成产物进行结构分析。
3. 考察螯合物的生物活性和潜在医学应用价值。
三、研究方法
1. 合成甘氨酸与微量元素的螯合物。
根据文献报道的方法,以甘氨酸和对应的微量元素盐为原料,通过一定的反应条件(如温度、pH值等)制备螯合物。
2. 对合成产物进行结构分析。
利用红外光谱、紫外光谱、核磁共振等手段对螯合物的结构进行分析。
3. 考察螯合物的生物活性和应用价值。
通过细胞实验、动物实验等方法考察螯合物的生物活性和潜在医学应用价值。
四、预期成果
1. 成功合成甘氨酸与微量元素的螯合物。
2. 通过分析螯合物的结构,揭示其化学性质和稳定性。
3. 获得螯合物的生物活性数据,探究其在医学上的应用潜力。
五、研究进度
本研究已完成对文献的调研,初步确定了实验方案和方法,正在进行具体的实验操作。
预计在6个月内完成实验,并撰写出一份完整的论文。
![一种甘氨酸锌螯合物的制备方法[发明专利]](https://uimg.taocdn.com/ce47199ddc3383c4bb4cf7ec4afe04a1b071b008.webp)
(10)申请公布号 (43)申请公布日 2014.07.16C N 103922954A (21)申请号 201410131404.4(22)申请日 2014.04.02C07C 229/76(2006.01)C07C 229/08(2006.01)C07C 227/18(2006.01)(71)申请人哈尔滨德邦鼎立生物科技有限公司地址150039 黑龙江省哈尔滨市香坊区成高子镇和平村成环路19号(72)发明人邓志刚 许甲平(74)专利代理机构北京轻创知识产权代理有限公司 11212代理人杨立(54)发明名称一种甘氨酸锌螯合物的制备方法(57)摘要本发明涉及一种甘氨酸锌螯合物的制备方法,包括:步骤1,配制锌盐水溶液、甘氨酸水溶液和氢氧化钠水溶液;步骤2,将锌盐水溶液和氢氢氧化钠水溶液同时滴加到甘氨酸水溶液中,调整氢氢氧化钠水溶液的滴加速度,控制反应溶液的pH 值为5~7,反应得到白色沉淀物,将白色沉淀物在反应溶液中陈化8h ~15h ;步骤3,将步骤2所得的白色沉淀物和反应溶液形成的混合物依次进行减压抽滤和干燥处理,得到板状的白色晶体。
本发明方法由于反应是由可溶性锌盐和甘氨酸在水溶液中进行,具有反应速度快,产品纯度高的特点。
同时,本方法可在常温下进行,具有耗能低的优点。
此外,采用本方法制备的甘氨酸锌呈现板状的几何外形。
(51)Int.Cl.权利要求书1页 说明书4页 附图1页(19)中华人民共和国国家知识产权局(12)发明专利申请权利要求书1页 说明书4页 附图1页(10)申请公布号CN 103922954 A1/1页1.一种甘氨酸锌螯合物的制备方法,所述方法包括以下步骤:步骤1,配制锌盐水溶液、甘氨酸水溶液和氢氧化钠水溶液;步骤2,将锌盐水溶液和氢氢氧化钠水溶液同时滴加到甘氨酸水溶液中,调整氢氢氧化钠水溶液的滴加速度,控制反应溶液的pH 值为5~7,反应得到白色沉淀物,将白色沉淀物在反应溶液中陈化8h ~15h ;步骤3,将步骤2所得的白色沉淀物和反应溶液形成的混合物进行减压抽滤和干燥处理,得到板状的白色晶体。

题目甘氨酸锌螯合物的合成及锌含量的测定学院医药化工学生姓名谢尚杰班级20011级化学制药(2)班学号1132220057指导教师李芳甘氨酸锌螯合物的合成及锌含量的测定医药化工学院化学制药学生:谢尚杰指导老师:李芳摘要:本实验是以碱式碳酸锌和甘氨酸为原料制备甘氨酸锌螯合物。
在95℃条件现加热搅拌合成产物产率稳定且反应条件易控制。
得到产品灰化后得到ZnO,用标准浓度的EDTA滴定其盐溶液,经换算得到锌的含量。
关键词:碱式碳酸锌;甘氨酸锌螯合物;EDTA1.前言1.1锌的作用1.1.1是人体中100多种酶的组成部分。
这些酶在组织呼吸和蛋白质、脂肪、糖、核酸等代谢中起重要作用。
1.1.2锌是DNA聚合酶的必需组成部分,缺锌时蛋白质合成障碍。
可导致侏儒症、损伤组织愈合困难、胎儿发育受影响。
1.1.3锌参加唾液蛋白构成,锌缺乏可导致味觉迟钝,食欲减退。
1.1.4锌参加维生素A还原酶和视黄醇结合蛋白的合成。
1.1.5促进性器官正常发育保持正常的性功能。
缺锌导致性成熟迟缓,性器官发育不全,性功能降低,性冷淡,精子减少,月经不正常。
1.1.6保护皮肤健康。
缺锌时皮肤粗糙、干燥、上皮角化和食道类角化;伤口愈合缓慢,易受感染。
1.1.7维护免疫功能。
根据锌在DNA合成中的作用,缺锌时导致免疫细胞增殖减少,胸腺活力降低。
由于锌在抗氧化生化酶中的作用,缺锌导致细胞表面受体发生变化。
1.1.8其他功能:锌有助于清除体内胆固醇,防治动脉粥样硬化症;锌有助于抑制癌症的发生等。
锌的来源可以是锌单质、氧化锌、氯化锌、硫酸锌、碳酸锌、碱式碳酸锌等,在自然界中有较多的含量。
但大部分的锌不能,或较难被人体吸收。
有些还有着严重的副作用。
因此发现良好的补锌药剂是我们探索的目标。
现在市面上的补锌药剂有葡萄糖酸锌、醋酸锌、氨基酸锌。
1.1.2葡萄糖酸锌葡萄糖酸锌的制备有多种制备方法。
①复分解反应将硫酸锌溶于近沸的水中,在恒温不断搅拌下,分次加人葡萄糖酸钙,待反应完成后,滤去沉淀,滤液浓缩结品,得到粗品,经溶解重结晶后得产品一.zJ,其制备反应为:Ca(C6H111O7 ) 2+ZnSO 4= CaSO4+Zn( HO )2该法合成工艺简单,但由于CaSO4 微溶于水,残留于产品中的硫酸根不易除去产品质量不高.②离子交换树脂法等摩尔葡萄糖酸钙与硫酸在9OC反应,制得葡萄糖酸,趁热滤去硫酸钙,再经离子交换树脂后与氧化锌或氢氧化锌反应,生成葡萄糖酸锌产率在85 %以上.若在产品浓缩过程中.加人95% 乙醇作为结晶促进剂,产率将提高达91.2%,此法较上述方法产品质量高,但合成路线较长,且有副产物生成.③空气催化氧化法在催化剂Pd(Pt)c存在下.葡萄糖经空气氧化成葡萄糖睦.分次加人理论量的氢氧化钠生成葡萄糖酸钠,瑞经过离子交换树脂,得葡萄糖酸.进一步与氧化锌作用得到葡萄糖酸锌,经浓缩.结晶、重结晶后,即得产品.该法氧化反应时间长达15h,方能使转化中的葡萄糖下降到5% 下,本法的技术关键是制备高活性的催化剂,并有效地回收贵金属.使生产成本降低,其合成方程式为:C6 H12 O 5= C6H12 O7 NaC6H 12O7 Na+ 2H2O = C6H12O72C6 H12O7十ZnO = Zn(C6H12O7)2+H2O贺必武改进了上述工艺.在氧化过程中.直接加八廉价的石灰乳,只需3 h便可使葡萄糖酸钙收率达9j 以上,生成的葡萄糖酸钙经复分解法转化成酸.再与氧化锌反应,可生产出符合美国药典质量的葡萄糖酸锌.这种工艺大大缩短了催化氧化所需时间,降低了生产成本,是目前催化氧化法中较先进的合成工艺.葡萄酸锌的特性及适用人群属于常用辅助药物。
一、实验目的1. 了解螯合物的基本概念和形成条件。
2. 掌握螯合物形成实验的操作方法。
3. 通过实验观察螯合物形成的现象,加深对螯合物性质的理解。
二、实验原理螯合物是指配位原子通过共价键与中心原子或离子形成的具有环状结构的化合物。
在螯合物中,配位原子与中心原子或离子之间形成多个配位键,使螯合物具有较大的稳定性和特定的几何结构。
本实验通过观察金属离子与配位剂形成螯合物的现象,验证螯合物形成的条件。
三、实验仪器与试剂1. 仪器:烧杯、试管、滴管、移液管、试管架、试管夹、电子天平、磁力搅拌器、酒精灯、酒精、蒸馏水、pH试纸、镊子等。
2. 试剂:NiSO4溶液、KSCN溶液、HCl溶液、EDTA溶液、NaOH溶液、NaCl溶液、硫酸铜溶液、氨水、无水乙醇、氯仿等。
四、实验步骤1. 配制NiSO4溶液:准确称取0.1g NiSO4·7H2O,加入50mL蒸馏水溶解,配制成0.2mol/L的NiSO4溶液。
2. 配制KSCN溶液:准确称取0.1g KSCN,加入50mL蒸馏水溶解,配制成0.2mol/L的KSCN溶液。
3. 配制EDTA溶液:准确称取0.1g EDTA,加入50mL蒸馏水溶解,配制成0.2mol/L的EDTA溶液。
4. 配制HCl溶液:用移液管准确量取浓HCl 5mL,加入95mL蒸馏水,配制成0.5mol/L的HCl溶液。
5. 配制NaOH溶液:用移液管准确量取浓NaOH 5mL,加入95mL蒸馏水,配制成0.5mol/L的NaOH溶液。
6. 配制NaCl溶液:用移液管准确量取NaCl 0.5g,加入50mL蒸馏水溶解,配制成1mol/L的NaCl溶液。
7. 配制硫酸铜溶液:用移液管准确量取硫酸铜晶体0.1g,加入50mL蒸馏水溶解,配制成0.2mol/L的硫酸铜溶液。
8. 配制氨水:用移液管准确量取浓氨水5mL,加入95mL蒸馏水,配制成0.5mol/L 的氨水溶液。
9. 实验操作:(1)取一支试管,加入2mL NiSO4溶液,滴加几滴KSCN溶液,观察现象。
实验报告甘氨酸的含量测定
摘要:本文介绍了甘氨酸含量测定的常规试验方法,其基本过程为:
样品的前处理,滴定反应,滴定终点检测。
实验中,使用大孔吸附管柱把
样品复现前的特征分子分离,然后通过紫外分光光度法进行定量检测,来
测定样品中的甘氨酸含量。
实验结果表明,当样品浓度在20mg·L-1与
500mg·L-1之间时,相关系数R2均大于0.999,精密度RSD小于3%,回
收率范围在90.9%~104.1%,说明所测结果可靠准确,可满足测定要求。
关键词:甘氨酸;大孔吸附管柱;紫外分光光度法;滴定
1引言
甘氨酸是衡量蛋白质质量的重要指标,同时也是人体重要的必需氨基酸。
甘氨酸作为抗生素的原料,对改善人体免疫力、促进细胞代谢有重要
的作用,是生命活动不可缺少的一部分。
由于甘氨酸具有丰富的生物活性,使得其进入到药物和食品领域,成为一种重要的营养补充剂。
甘氨酸在食
品中的含量测定,不仅有助于食品行业的检测与研究,还可以为食品安全
监测提供参考依据。
实验报告甘氨酸的含量测定一、实验目的:本实验旨在通过紫外分光光度法测定一系列甘氨酸溶液中甘氨酸的含量,并通过实验得到的数据来建立甘氨酸浓度与吸光度之间的标准曲线。
二、实验原理:1.原理简介紫外分光光度法是利用物质在紫外可见光区域内吸收光的特性对其浓度进行分析的方法。
其基本原理是:当物质溶液通过一个具有连续或非连续频谱的紫外光源时,溶液中的物质会吸收一部分波长范围内的光,而未被吸收的光会通过检测器。
根据比尔-朗伯定律,溶液中物质的吸光度与其浓度之间存在一个线性关系,可以用来建立浓度与吸光度之间的标准曲线,从而通过吸光度的测定来计算溶液中物质的浓度。
2.背景知识甘氨酸(glycine)是一种非必需氨基酸,常用于制备缓冲溶液和生物技术中。
甘氨酸的分子式为C2H5NO2,摩尔质量为75.07 g/mol。
3.实验步骤和条件(1) 准备一系列甘氨酸的浓度为10.0-100.0 mg/L的标准溶液;(2) 使用紫外可见分光光度计在219 nm波长下选择最佳检测波长;(3)分别测定标准溶液的吸光度,获得浓度与吸光度之间的线性关系;(4)测定未知样品的吸光度,并利用标准曲线计算其浓度。
三、实验步骤:1.实验器材准备:(1) 甘氨酸标准溶液:分别称取10.0, 20.0, 30.0, 40.0, 50.0 mg 的甘氨酸溶解于100 mL 的蒸馏水中,得到10.0-100.0 mg/L 的标准溶液;(2)pH7.0的磷酸盐缓冲液;(3)紫外可见分光光度计;(4)紫外可见比色皿。
2.实验步骤:(1)在紫外光源下选择最佳检测波长,记录波长;(2)分别量取不同浓度的甘氨酸标准溶液,置于比色皿中;(3)使用紫外可见分光光度计测定各标准溶液的吸光度,并记录;(4)绘制标准曲线,将吸光度与甘氨酸的浓度绘制在同一坐标系中,进行线性拟合;(5)测定未知样品的吸光度,并利用标准曲线计算出甘氨酸的浓度。
四、实验结果与分析:本实验选择了219 nm的检测波长。
题目甘氨酸锌螯合物的合成及锌含量的测定学院医药化工
学生姓名谢尚杰
班级20011级化学制药(2)班
学号1132220057
指导教师李芳
甘氨酸锌螯合物的合成及锌含量的测定
医药化工学院化学制药学生:谢尚杰指导老师:李芳
摘要:本实验是以碱式碳酸锌和甘氨酸为原料制备甘氨酸锌螯合物。
在95℃条件现加热搅拌合成产物产率稳定且反应条件易控制。
得到产品灰化后得到ZnO,用标准浓度的EDTA滴定其盐溶液,经换算得到锌的含量。
关键词:碱式碳酸锌;甘氨酸锌螯合物;EDTA
1.前言
1.1锌的作用
1.1.1是人体中100多种酶的组成部分。
这些酶在组织呼吸和蛋白质、脂肪、糖、核酸等代谢中起重要作用。
1.1.2锌是DNA聚合酶的必需组成部分,缺锌时蛋白质合成障碍。
可导致侏儒症、损伤组织愈合困难、胎儿发育受影响。
1.1.3锌参加唾液蛋白构成,锌缺乏可导致味觉迟钝,食欲减退。
1.1.4锌参加维生素A还原酶和视黄醇结合蛋白的合成。
1.1.5促进性器官正常发育保持正常的性功能。
缺锌导致性成熟迟缓,性器官发育不全,性功能降低,性冷淡,精子减少,月经不正常。
1.1.6保护皮肤健康。
缺锌时皮肤粗糙、干燥、上皮角化和食道类角化;伤口愈合缓慢,易受感染。
1.1.7维护免疫功能。
根据锌在DNA合成中的作用,缺锌时导致免疫细胞增殖减少,胸腺活力降低。
由于锌在抗氧化生化酶中的作用,缺锌导致细胞表面受体发生变化。
1.1.8其他功能:锌有助于清除体内胆固醇,防治动脉粥样硬化症;锌有助于抑制癌症的发生等。
锌的来源可以是锌单质、氧化锌、氯化锌、硫酸锌、碳酸锌、碱式碳酸锌等,在自然界中有较多的含量。
但大部分的锌不能,或较难被人体吸收。
有些还有着严重的副作用。
因此发现良好的补锌药剂是我们探索的目标。
现在市面上的补锌药剂有葡萄糖酸锌、醋酸锌、氨基酸锌。
1.1.2葡萄糖酸锌
葡萄糖酸锌的制备有多种制备方法。
①复分解反应
将硫酸锌溶于近沸的水中,在恒温不断搅拌下,分次加人葡萄糖酸钙,待反应完成后,滤去沉淀,滤液浓缩结品,得到粗品,经溶解重结晶后得产品一.zJ,其制备反应为:
Ca(C6H111O7 ) 2+ZnSO 4= CaSO4+Zn( HO )2
该法合成工艺简单,但由于CaSO4 微溶于水,残留于产品中的硫酸根不易除去产品质量不高.②离子交换树脂法
等摩尔葡萄糖酸钙与硫酸在9O
C反应,制得葡萄糖酸,趁热滤去硫酸钙,再经离子交换树脂后与氧化锌或氢氧化锌反应,生成葡萄糖酸锌产率在85 %以上.若在产品浓缩过程中.加人95% 乙醇作为结晶促进剂,产率将提高达91.2%,此法较上述方法产品质量高,但合成路线较长,且有副产物生成.
③空气催化氧化法
在催化剂Pd(Pt)c存在下.葡萄糖经空气氧化成葡萄糖睦.分次加人理论量的氢氧化钠生成葡萄糖酸钠,瑞经过离子交换树脂,得葡萄糖酸.进一步与氧化锌作用得到葡萄糖酸锌,经浓缩.结晶、重结晶后,即得产品.该法氧化反应时间长达15h,方能使转化中的葡萄糖下降到5% 下,本法的技术关键是制备高活性的催化剂,并有效地回收贵金属.使生产成本降低,其合成方程式为:
C6 H12 O 5= C6H12 O7 Na
C6H 12O7 Na+ 2H2O = C6H12O7
2C6 H12O7十ZnO = Zn(C6H12O7)2+H2O
贺必武改进了上述工艺.在氧化过程中.直接加八廉价的石灰乳,只需3 h便可使葡萄糖
酸钙收率达9j 以上,生成的葡萄糖酸钙经复分解法转化成酸.再与氧化锌反应,可生产出符合美国药典质量的葡萄糖酸锌.这种工艺大大缩短了催化氧化所需时间,降低了生产成本,是目前催化氧化法中较先进的合成工艺.
葡萄酸锌的特性及适用人群
属于常用辅助药物。
(性状与稳定性)葡萄糖酸锌为白色结晶或颗粒状粉末;易溶于水,不溶于乙醇,氯仿乙醚。
本品制剂要求遮光,密闭保存。
主要用于婴儿及老年,妊娠妇女因缺锌
引起的生长发育迟缓,营养不良,厌食症,复发性口腔溃疡,皮肤痤疮等症。
1.1.2氨基酸锌
氨基酸锌的制备方法
①原始制备方法
不同的氨基酸,对应锌的配比不同。
例如:赖氨酸比锌离子在3:1情况下平均螯合度最高。
甘氨酸在2:1情况下最高。
此反应要调节pH,大致在6.5左右最适。
②、微波辅助合成各种氨基酸锌螯合物
微波固相法制备氨基酸螯合物的工艺大致是将反应物充分混合后将混合物放进反应容器中,用微量进样器加入引发剂(一般为水和乙醇等),然后进行微波催化合成,反应后进行洗涤和干燥即可。
▲氨基酸螯合锌
原料(氨基酸和锌源)一微波催化一螯合一提纯一干燥一产品
▲肽螯合锌
蛋白原料粉碎—酶解分离和纯化—肽产品—微博催化螯合—提纯—干燥—肽螯合锌产品
由于固相和半固相合成排污量小,反应迅速,采用新的工艺路线不仅有利于无害化生产环境,而且降低成本,显示出巨大的优越性。
采用微波技术辐射合成有机微量元素螯合物,使螫合率提高,制备过程由1 h缩短为l一5 min,并减少大量废液;有利于进一步萃取和提纯。
甘氨酸锌螯合物为乳白色粉末状固体,无异味,在潮湿空气中会潮解。
,能溶于水,难溶于乙醇,在丙酮等有机溶剂及室温下稳定存在。
赖氨酸锌螯合物为淡黄色粉末状固体,不易潮解,能溶于水难溶于有机溶剂。
室温下稳定存在。
氨基酸锌产品既含有氨基酸,又有锌元素,可以同时补充给人体,对于缺锌及需要补充氨
基酸的人群适用。
2.实验部分
2.1实验仪器及试剂
2.1.1仪器:烧杯、回流装置一套、蒸发皿、量筒、台秤、电子天平、恒温水浴锅、循环水真空泵、抽滤瓶、布氏漏斗、P2O5恒温磁力搅拌机、酸式滴定管、锥形瓶。
2.1.2试剂:甘氨酸、碱式碳酸锌,95%乙醇,二甲酚橙,1:1氨水,六亚甲基四胺,EDTA(S)。
2.2 实验过程
2.2.1碱式碳酸锌的制备
称取5.0gZnSO4和3.0gNaHCO3于烧杯中,搅拌10分钟后,抽滤,用蒸馏水洗涤沉淀至洗涤液与BaCl2溶液反应不浑浊。
得到碱式碳酸锌晶体,干燥。
2.2.2甘氨酸锌螯合物的制备
称取3.0g碱式碳酸锌和6.0g甘氨酸晶体于三口烧瓶中,将三口烧瓶置于P2O5恒温磁力搅拌机上,搭好回流装置在95℃下加热回流3h后。
浓缩至液体表面出现晶膜,冷却结晶,抽滤后用无水乙醇洗涤。
干燥得到甘氨酸锌螯合物。
计算产率。
2.2.3锌含量的测定
将0.3g甘氨酸锌螯合物于坩埚中灰化,溶于10mL0.1mol/L HcL中,转移至250mL容量瓶中并稀释至刻度,摇匀。
准确吸取50mL上溶液于250mL锥形瓶中,加入25mL蒸馏水,滴加3滴二甲酚橙指示剂。
用1:1氨水调节溶液呈橙红色,然后滴加六亚甲基四胺至溶液呈紫红色后,再多加3mL。
用0.1mol/h的EDTA溶液滴定,当溶液由紫红色变为黄色时,即为终点。
记录所用体积。
用同样方法平行测定三次。
3 数据记录与处理
3.1配合物的产率计算
3.2配合物中锌的质量分数。