氢原子的结构
- 格式:ppt
- 大小:4.38 MB
- 文档页数:56


氢原子能级氢原子是最简单的原子系统之一,由一个质子和一个电子组成。
其电子围绕核心运动,而不同的电子轨道对应着不同的能级。
本文将介绍氢原子的能级结构,探讨其特性和相关的物理概念。
数据建模我们首先可以通过数学方法对氢原子的能级进行建模。
根据量子力学理论,氢原子的能级可以用以下方程表示:\[ E_n = -\frac{m_e e^4 Z^2}{2 \hbar^2 n^2} \]其中,\(E_n\) 表示第 n 能级的能量,\(m_e\) 是电子的质量,\(e\) 是基本电荷,\(Z\) 是原子序数(对于氢原子为1),\(\hbar\) 是约化普朗克常数,\(n\) 表示能级。
能级结构根据上述能量公式,我们可以计算出不同能级的能量值。
氢原子的能级是离散的,且具有以下特点:1.能级间距递减:氢原子的能级间距随着能级增加而减小。
这表现为不同能级之间的差值按照 \(~\frac{1}{n^2}\) 的比例递减。
2.基态能级:最低的能级称为基态,即 n=1 时的能级。
这是电子最稳定的状态,也是氢原子最常见的状态。
3.激发态:当电子受到外部能量激发时,它可以跳跃到更高的能级,形成激发态。
这些态相对不稳定,电子常常会回到基态释放能量。
能级转变氢原子的能级转变是物质吸收或发射光线时的基础。
当电子从高能级跃迁到低能级时,会释放光子能量。
反之,吸收光子能量的过程也与能级转变有关。
在氢原子中,能级转变的典型过程包括:1.吸收辐射:电子从低能级跃迁至高能级时吸收能量,这种现象通常用于激发原子。
2.自发辐射:电子自发跃迁至低能级时释放能量,导致光子的辐射。
3.受激辐射:当光子刺激原子跃迁时,光子与原子交换能量,导致受激辐射的发生。
应用与研究氢原子能级结构的研究对于光谱学、量子力学等领域有着重要意义。
科学家们通过对氢原子的能级分析,深入了解了原子内部结构和电子行为。
此外,氢原子的能级结构也在实际应用中有所体现,例如光谱分析、原子钟精度计算等都与氢原子的能级相关。



氢原子电离需要的能量以氢原子电离需要的能量为题,我们将探讨氢原子电离的过程以及所需的能量。
让我们回顾一下氢原子的基本结构。
氢原子由一个质子和一个电子组成,质子位于原子核中心,而电子绕着原子核运动。
电子的运动轨道可以分为不同的能级,每个能级都对应着一定的能量。
当氢原子被外部能量激发时,电子会从低能级跃迁到高能级。
这个过程需要吸收能量,且能量的大小与电子所跃迁的能级差有关。
当电子从高能级回到低能级时,会释放出之前吸收的能量,这就是我们常见的光谱现象。
然而,当外部能量足够大时,电子也可以跃迁到无穷远处,也就是完全离开氢原子。
这个过程称为氢原子的电离。
那么,氢原子电离所需的能量究竟是多少呢?答案是13.6电子伏特(eV)。
这个数值是由普朗克常数、光速以及元电荷等物理常数计算得出的。
换句话说,当外部能量大于或等于13.6eV时,氢原子就会被电离。
那么,我们如何理解这个数值呢?首先,电子与质子之间存在一个静电吸引力,使得电子绕着原子核运动。
这个吸引力可以用库仑定律来描述,而氢原子的能级结构可以用量子力学的理论来解释。
在氢原子的第一能级(基态)中,电子与质子之间的静电力与电子的运动能量达到平衡。
当外部能量大于13.6eV时,电子的运动能量超过了静电力的束缚,电子就能够从氢原子中脱离。
这个能量数值的大小也是由氢原子的质量、电荷以及普朗克常数等因素决定的。
如果我们考虑其他原子或分子的电离能量,就需要考虑它们的构成粒子以及结构等因素。
氢原子电离所需的能量是13.6eV,这个数值是由普朗克常数、光速以及元电荷等物理常数计算得出的。
当外部能量大于或等于这个数值时,氢原子的电子就能够脱离原子核,发生电离现象。
这个能量数值的大小取决于氢原子的结构以及物理常数的数值。
希望本文能够帮助读者更好地理解氢原子电离的能量需求。

氢原子标准模型
氢原子标准模型是一种描述氢原子结构和行为的理论模型。
这个模型基于量子力学和电磁学原理,能够解释氢原子光谱的线系、能级跃迁以及其他相关现象。
在氢原子标准模型中,氢原子由一个质子和一个电子组成,它们之间通过库仑力相互吸引。
电子在氢原子中绕核运动,其轨道是量子化的,即只能取特定的、离散的轨道半径。
这些轨道半径满足玻尔半径公式,即r_n = n^2 * a_0,其中n 是主量子数,a_0 是玻尔半径,约为0.529 ×10^-10 米。
电子在不同的轨道上运动时,具有不同的能量,这些能量值也是量子化的。
氢原子的能级可以由巴耳末公式来描述,即E_n = -R_H / n^2,其中R_H 是里德伯常量,n 是主量子数。
电子只能在特定的能级之间跃迁,吸收或发射特定波长的光子,这使得氢原子光谱呈现出特定的线系。
除了电子的轨道和能级是量子化的之外,氢原子还具有一些其他的量子化性质,如自旋、磁矩等。
这些性质使得氢原子在磁场中表现出特定的行为,例如塞曼效应等。
总的来说,氢原子标准模型是一种基于量子力学和电磁学原理的理论模型,能够准确描述氢原子的结构和行为,为我们理解原子结构和量子力学提供了重要的基础。


大学化学1999年8月第14卷 第4期氢 的 新 键 型周 公 度(北京大学化学与分子工程学院 北京100871)1 氢原子结构和氢的成键形式 氢是元素周期表中的第一个元素,核中质子数为1,核外只有1个电子,基态时该电子处在1s轨道上,没有内层轨道和电子。
H原子可以失去1个电子成H+,很像ⅠA族元素;可以获得1个电子成H-,使价层轨道全充满,又像ⅦA族元素;可以看作价层轨道为半充满的原子,如ⅣA族元素。
由于这个原因,H在元素周期表中的位置可以放在ⅠA,ⅣA和ⅦA族的第一个位置上,并以此来了解它的成键形式。
虽然H原子只有1个1s轨道和1个电子参加成键,但在近20年来,由于合成化学和结构化学的发展,已经阐明H原子在不同的化合物中可以形成多种形式的化学键,如下所列[1,2]。
(1)共价单键 H原子常以共价单键和其他非金属原子形成多种多样的化合物。
H原子的共价单键半径为32pm。
(2)离子键 H原子可获得1个电子形成H-离子,再和其他高正电性的离子形成盐型氢化物,H-离子的半径在130~150pm之间。
H原子丢失1个电子形成H+离子,因其半径极小(~010015pm),除气态离子束外,H+必定和其他分子或离子结合形成H3O+,H5O+2,N H+4等离子,再和其他异号离子通过离子键结合成化合物。
(3)金属键 在非常高的压力和很低温度下,例如250GPa和77K条件下,H2分子转变成直线型氢原子链H n,使固态分子氢转变成金属相,在其中H原子间通过金属键相互结合在一起。
H2能被许多种金属和合金大量吸附,以原子状态存在于金属原子间的空隙之中,以金属键和金属相结合。
(4)氢键 氢键以X—H…Y表示,其中X和Y都是电负性较高的原子,如F、O、N等,Cl 和C在某些条件下也参与形成氢键。
在这体系中,X—H键的一对成键电子和Y原子的一对孤对电子参加成键,所以氢键是三中心四电子(3c24e)键。
(5)氢分子配键 在一些过渡金属配位化合物中,氢分子(H2)能和金属原子(M)从侧面配位成键,如下所示:HMH (6)缺电子多中心氢桥键 在硼烷等化合物中,H原子可和硼原子等形成三中心二电子(3c 22e )缺电子多中心键:HB B (7)过渡金属氢化物中的M —H 键 在过渡金属氢化物中,H 原子能以多种形式和金属原子M 成键,如:M H H M M H M MM (8)C —H _M 桥键 这种键的英文名称为agostic bond ,“agostic ”来源于拉丁文,意思是抓住使其靠在近旁。

氢原子吸收光谱氢原子的吸收光谱是指氢原子在吸收外部能量后发生能级跃迁时所产生的光谱。
氢原子的吸收光谱提供了深入了解氢原子内部结构和能级之间的跃迁过程的重要信息。
下面是关于氢原子吸收光谱的一般性信息:1. 氢原子能级结构:氢原子的能级结构是由一系列电子能级组成的,这些能级包括基态(最低能级)和激发态(高能级)。
电子可以通过吸收或发射光子来从一个能级跃迁到另一个能级。
2. 玻尔模型:尼尔斯·玻尔提出的玻尔模型是描述氢原子能级的经典模型。
根据这个模型,氢原子的能级与电子的轨道半径有关,而电子在这些轨道上只能具有特定的能量。
3. 布喇格方程:布喇格方程描述了波的性质,包括电子波函数。
通过求解布喇格方程,可以得到氢原子的允许能级。
4. 吸收光谱的产生:当氢原子吸收外部能量时(例如光子),电子会从低能级跃迁到高能级。
这个跃迁的过程伴随着光的吸收,产生吸收光谱。
5. 巴尔末系列:氢原子的巴尔末系列是指电子从高能级跃迁到第二能级(n=2)时产生的谱线。
巴尔末系列包括巴尔末α、巴尔末β等。
6. 朗道-卢瑟福散射:朗道-卢瑟福散射是研究原子结构的重要实验方法。
通过测量散射光的角度和能量,可以推断出原子的内部结构。
7. 量子力学描述:量子力学提供了对氢原子能级和电子跃迁的更精确描述。
薛定谔方程是描述氢原子体系的基本方程。
8. 氢光谱学的应用:氢光谱学的研究不仅提供了对氢原子内部结构的理解,还为分析其他原子和分子的光谱学提供了基础。
结论:氢原子吸收光谱的研究对于理解原子结构、光谱学基础和量子力学等领域都有重要的意义。
通过分析吸收光谱,科学家们能够深入探讨原子内部的能级跃迁过程,为量子理论的发展和实验技术的进步提供了关键信息。
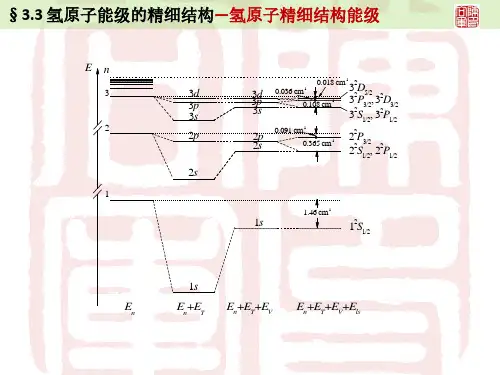

氢原子的能级结构,能级公式咱先来说说氢原子这玩意儿,氢原子在物理学里那可是相当重要的角色。
就像一个神秘的小宇宙,藏着好多奇妙的秘密。
你知道吗?氢原子的能级结构就像是它内部的“楼层”,每层都有自己特定的能量值。
这些“楼层”可不是随便分的,而是遵循着一定的规律。
氢原子的能级公式,就像是打开这个神秘世界的钥匙。
这个公式告诉我们,氢原子的能量和一些关键的物理量有着紧密的联系。
比如说,电子绕核运动的轨道半径。
想象一下,你在一个大大的操场上,有一个小朋友在那里转着圈跑。
他跑的轨迹就像是电子绕着氢原子核运动的轨道。
而这个小朋友跑的速度、跑的范围,就决定了他所具有的能量。
就像我之前在课堂上给学生们讲这个的时候,有个小家伙瞪着大眼睛,一脸疑惑地问我:“老师,那氢原子里的电子是不是就像个调皮的小精灵,在不同的楼层上跳来跳去呀?”我笑着回答他:“对呀,这个小精灵可调皮了,它的跳跃可是有规律的哦!”咱再深入聊聊氢原子的能级结构。
它就像是一个精心设计的阶梯,每个阶梯的高度都代表着一种特定的能量状态。
从低能级到高能级,就像是爬山一样,需要吸收能量;而从高能级回到低能级,就会释放出能量,就像从山上滑下来一样。
比如说,当氢原子中的电子从高能级跃迁到低能级时,会发出特定频率的光子。
这就好像是电子在“下楼”的时候,一边走一边哼着歌,这个歌就是我们能观测到的光。
而能级公式呢,它能精确地计算出每个能级的能量值。
这就像是一个超级准确的计算器,只要你输入相关的参数,就能得出结果。
在实际的科学研究和应用中,对氢原子能级结构和能级公式的理解那可是至关重要。
比如在激光技术里,就是靠着对氢原子能级的精准控制,才能让激光发挥出强大的作用。
还记得有一次,我带着学生们去实验室做实验,观察氢原子的光谱。
当那些美丽的光谱线出现在屏幕上的时候,学生们都兴奋得不得了。
那一刻,我深深地感受到,让孩子们真正理解这些知识,看到科学的神奇,是多么有意义的事情。
总之,氢原子的能级结构和能级公式,虽然看起来有点复杂,但只要我们用心去探索,就会发现其中无尽的乐趣和奥秘。
氢元素化学符号
氢元素是元素周期表中第一种元素,符号为“H”。
它是宇宙中最常见的原子,也是最活跃的原子。
它被广泛用于生物、无机、医学、工业、药物和其他科学领域。
氢元素符号被用于表示氢原子的化学组成、分子结构和有关的反应机制。
氢原子的化学组成是H,其在元素周期表中的原子序数为1,它的重量Pnumber也是1。
氢原子的结构由一个核和一个电子组成,电子位于氢原子的外层。
氢元素的原子半径是最小的,而氘原子的原子半径则最大。
氢元素符号用于表示一种特定的分子结构,其中一种是单原子氢分子,表示为H2,也称为氢气。
另一种构型是氢氨分子,由一个氢原子和一个氨原子组成,表示为NH3,也称为氨气。
此外,还有一种含有三个氢原子的分子,表示为H3O,即水。
有时,氢元素的符号也被用于表示氢的化合物,如氢氧化物(H2O)或硫酸根(HSO4)。
氢元素的符号也被用于表示化学反应机制。
例如,氢化物通常是以氢原子为活性物质,它们与另一种物质发生反应,从而产生氢原子的物质,并可能会形成复杂的化合物。
氢元素具有独特的物理性质,它是一种稳定元素,原子结构非常简单,由一个质子和一个电子组成。
氢元素的稳定性使它成为非常重要的原子,它在许多科学领域中被广泛使用,而且是地球上最重要的能源来源之一。
综上所述,氢元素是元素周期表中最重要的元素之一,其化学组
成是H,符号也是H,它的原子半径最小,也是宇宙中最常见的原子。
它的符号被用于表示氢原子的化学组成、分子结构和相关的反应机制,同时也是重要的能源来源。
氢的质子数氢是一种罕见的元素,是宇宙中最轻的物质。
它的质子数是1,原子结构表明它只有一个质子。
氢的原子结构使它成为宇宙中独一无二的元素。
氢是天文学研究中重要的元素,由于它的质子数只有一个,因此它是宇宙中最普遍的元素。
很多研究者指出,氢的质子数为1,是宇宙中构成大部分物质的最基本的元素,也是制造宇宙中其他元素的原料。
在物理中,氢原子有一个质子和一个中子,它们以及由它们构成的原子核正是氢的质子数为1的原因。
氢原子的质子和中子本质上是相同的,只是各自有不同的电荷。
一个氢原子的质子有一个正电荷,而中子没有电荷。
由此可见,氢原子的质子数为1,只有一个质子和一个中子。
众所周知,质子是由重子和中微子组成的,而中微子在氢中是没有的。
氢的质子数决定了它在原子内部的结构。
在氢原子核中,质子与中子形成奥德赛架构,即质子和中子对称排列着形成一个球形结构。
中子受到质子和电子的屏蔽力,只有当它们接近时才能够相互作用,因此中子不受外部电场的影响,但质子则极其稳定。
此外,氢的质子数也决定了它的电性质,因为如果氢中有多个质子,那么它将变成一种具有不同电性质的元素。
此外,氢的质子数为1,也影响了它的化学性质。
由于氢只有一个质子,与质子和原子核之间的中微子相比,质子和原子核之间的电荷状态要大得多。
因此,氢原子正负电荷不平衡,这就使它具有单价性,具有电子可以容易移动的性质,所以它常常和其他元素结合,形成氢键。
因此,从上述信息可以清楚地看出,氢的质子数为1,对宇宙中的物质结构和物理特性有着重要的影响。
它的质子数决定了它的物理结构,也决定了它的电性质和化学性质。
最重要的是,氢的质子数为1,也是它与其他元素结合形成氢键的原因之一。
最终,氢的质子数为1,也是宇宙最轻的物质,也是构成宇宙大部分物质的重要元素,也是制造宇宙中其他元素的原料。
一级氢原子一级氢原子是指只有一个电子的氢原子。
它是化学元素中最简单的原子之一,在宇宙中广泛存在。
一级氢原子的结构和性质对于我们理解化学、物理以及宇宙起源都具有重要意义。
一级氢原子的结构可以从三个方面来描述:核、电子和能级。
一级氢原子的核心是一个质子,质子的质量约为1.67×10^-27千克,带有一个正电荷。
质子的数目决定了氢原子的原子序数,也就是化学元素中的“氢”的位置。
围绕着核心的是一个电子。
电子是一个质量极小的粒子,质量只有质子的约1/1836。
电子带有一个负电荷,与质子的正电荷相互吸引,使得电子能够绕核心运动。
一级氢原子的能级结构是非常有趣的。
根据量子力学理论,电子在原子中的运动是量子化的,只能存在于特定的能级上。
一级氢原子的能级结构由一系列离散的能级组成,这些能级分为不同的主量子数。
当电子处于最低的能级时,它处于最稳定的状态,这被称为基态。
当电子吸收能量,跃迁到更高的能级时,它处于激发态。
当电子回到基态时,会释放出能量,通常以光的形式。
一级氢原子的性质也是非常独特的。
首先,一级氢原子是化学反应中最活泼的元素之一。
由于它只有一个电子,这个电子的位置可以被其他原子的电子轻易影响,从而参与各种反应。
其次,一级氢原子是宇宙中最丰富的元素之一。
在宇宙中,氢原子以巨大的数量存在于星云、恒星和行星等地方。
它们的存在对于宇宙的形成和演化起着重要作用。
在化学和物理学中,一级氢原子也被广泛应用。
例如,它是理论计算和实验研究的重要对象,可以用来模拟和研究其他复杂原子或分子的性质。
此外,一级氢原子还可以用作氢气的制备和储存,以及燃料电池等能源技术的研究。
一级氢原子作为化学元素中最简单的原子之一,其结构和性质对于我们理解化学、物理以及宇宙起源都具有重要意义。
通过研究一级氢原子,我们可以深入了解原子的基本结构和量子力学的规律。
同时,一级氢原子的应用也推动了科学技术的发展,为我们创造更美好的未来提供了可能性。