有机化学-二烯烃 共轭体系-2018年
- 格式:pptx
- 大小:1.94 MB
- 文档页数:55






第四章 二烯烃和共轭体系思考题习题4.1 下列化合物有无顺反异构体?若有,写出其构型式并命名。
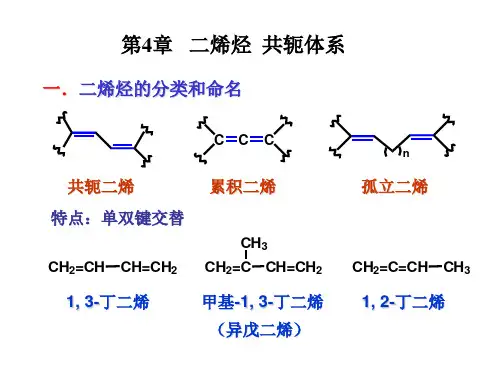
(P119)(1) 1,3-戊二烯 C H 2=C H C H =C H C H 3解:有2个顺反异构体!C =C C H 3HC H 2=C HHC =CHC H 3C H 2=C HH(Z)- 1,3-戊二烯 (E)- 1,3-戊二烯(2) 2,4,6-辛三烯 C H 3C H =C H C H =C H C H =C H C H 3 解:有6个顺反异构体!C =CC =CHC =CHHC H 3HH C H 3HC =CC =CHC =CHC H 3HHH C H 3HC =CC =CHC =CHC H3H C H 3H HH(Z,Z,Z)- 2,4,6-辛三烯 (Z,Z,E)- 2,4,6-辛三烯 (E,Z,E)- 2,4,6-辛三烯C =C C =CC =CHHHH C H 3C H 3HHC =CC =CC =CHHC H 3HHHHC H 3C =CC =CC =CHHC H 3HHC H 3HH(E,E,E)- 2,4,6-辛三烯 (E,E,Z)- 2,4,6-辛三烯(Z,E,Z)- 2,4,6-辛三烯习题4.2 下列各组化合物或碳正离子或自由基哪个较稳定?为什么?(P126)(1) 3-甲基-2,5-庚二烯 和 5-甲基-2,4-庚二烯√C H 3C H =C C H 2C H =C H C H 3C H 3C H 3C H =C H C H =C C H 2C H 3C H 3π-π共轭无π-π共轭有(2)(C H 3)2C =C H CH 2C H 3C H =C H C H 2C H 2=C H C H 2、和(C H 3)2C =C H C H 2C H 3C H =C H C H 2C H 2=C H C H 26个超共轭σ-H 3个超共轭σ-H 0个超共轭σ-H 稳定性:>>(3)(C H 3)2C H C H C H =C H 2(C H 3)2C C H 2C H =C H 2(C H 3)2C C H 2C H 3、和(C H 3)2C H C H C H =C H 2(C H 3)2C C H 2C H =C H 2(C H 3)2C C H 2C H 3稳定性:>>有p -π共轭p -π共轭无p -π共轭无给电子性:C H 3C H =C H 2>(4)、和C H 2C H =C H C H =C H 2C H 2C H =C H C H 2C H 3C H 3C H C H 2C H =C H 2稳定性:>>有π-π共轭C H 2C H =C H C H =C H 2C H 2C H =C H C H 2C H 3C H 3C H C H 2C H =C H 2p -π有共轭π-π无共轭π-π无共轭p -π有共轭p -π共轭无(5) C H 3 , (C H 3)2C H C H 2 , C H 3C H C H 2C H 3 和 (C H 3)3C 甲基自由基 一级自由基 二级自由基 三级自由基(6)(C H 2C H =C H )2C H , C H 2=C H C H 2 和 C H 3C H =CH5个sp 2杂化碳共轭 3个sp 2杂化碳共轭 成单电子不在p 轨道上,不参与共轭共轭程度更大共轭程度相对较小习题4.3 解释下列事实:(P126)(1) C H 3C H 2C H =C H C H 3C H 3C H 2C H 2C H C H 3C l C H 3C H 2C H C H 2C H 3C lH C l+(主)(次)稳定性:>C H 3C H 2C H C H 2C H 3C H 3C H 2C H 2C H C H 3(2)C H 3C H =C C H 3C H 3C H 3C H 2C C H 3C H 3C l C H 3C H C H C H 3C H 3C l+H C l(主)(次)稳定性:>C H 3C H 2C C H 3C H 3C H 3C H C H C H 3C H 3(3) +H B r , 过氧化苯甲酰o(96%)(4%)C H 3C H =C H 2C H 3C H 2C H 2B r C H 3C H C H 3B r>稳定性:C H 3C H C H 2B r C H 3C H C H 2B rC H 3C H =C H 2C H 3C H C H 2B r C H 3C H C H 2B rP h C O O H + B rP h C O O+(过氧化苯甲酰)2P h C O OP h C O O C P h OO机理:... ...习题4.4 什么是极限结构?什么是共振杂化体?一个化合物可以写出的极限结构式增多标志着什么?(P130)解:极限结构——对真实结构有贡献,但不能完全代表真实结构的经典结构式;共振杂化体——由若干个极限结构式表示的该化合物的真实结构。