高中化学第4章材料家族中的元素本章总结教案鲁科版必修1
- 格式:doc
- 大小:221.50 KB
- 文档页数:4
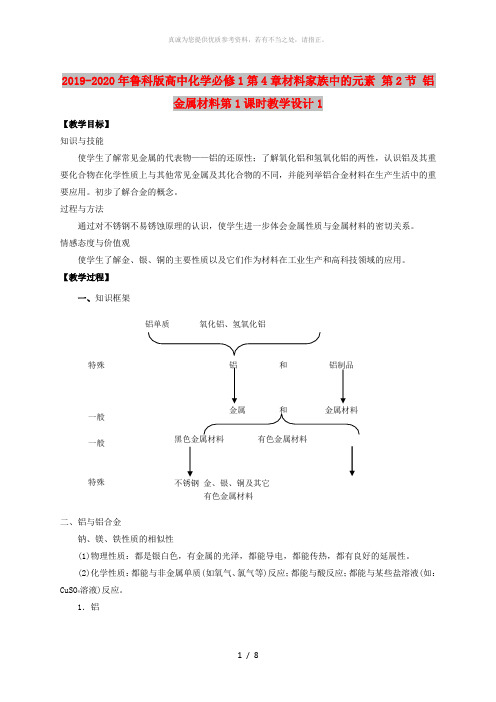
2019-2020年鲁科版高中化学必修1第4章材料家族中的元素 第2节 铝金属材料第1课时教学设计1【教学目标】知识与技能使学生了解常见金属的代表物——铝的还原性;了解氧化铝和氢氧化铝的两性,认识铝及其重要化合物在化学性质上与其他常见金属及其化合物的不同,并能列举铝合金材料在生产生活中的重要应用。
初步了解合金的概念。
过程与方法通过对不锈钢不易锈蚀原理的认识,使学生进一步体会金属性质与金属材料的密切关系。
情感态度与价值观使学生了解金、银、铜的主要性质以及它们作为材料在工业生产和高科技领域的应用。
【教学过程】一、知识框架二、铝与铝合金钠、镁、铁性质的相似性(1)物理性质:都是银白色,有金属的光泽,都能导电,都能传热,都有良好的延展性。
(2)化学性质:都能与非金属单质(如氧气、氯气等)反应;都能与酸反应;都能与某些盐溶液(如:CuSO 4溶液)反应。
1.铝特殊一般一般特殊想一想你在日常生活中见到过哪些铝制品?【投影展示】(1)物理性质:硬度较小,银白色质轻,密度为2.7g/cm,具有一定的耐磨性,有很好的延展性和导电性,熔点低(666.4℃),沸点高(2467℃)。
(2)化学性质①与非金属反应a 与氧气反应:常温下,铝被空气中的氧气氧化,表面生成一层致密的氧化物薄膜,失去金属光泽。
点燃时,金属铝可以在氧气中燃烧:4Al+ 3O2 2Al2O3说明:该反应放出大量热和耀眼的白光,因而铝可用于制造燃烧弹、信号弹、火箭推进剂等。
【知识·链接】英阿马岛战争中英方的一艘现代化驱逐舰被阿方导弹击中后,燃起滔天大火,无法扑灭,导致舰艇沉没,这是怎么回事呢?原来,驱逐舰夹板上大量使用铝,铝在高温下发生了燃烧,生成氧化铝。
b. 与氯气、硫等非金属反应2Al+3Cl2 2AlCl34Al+3S 2Al2S3②与酸的反应a.与非氧化酸(盐酸、稀硫酸)反应,有氢气生成:b.2Al+6H+=2Al3++3H2↑。
c.与氧化酸(硝酸,浓硫酸)反应,无氢气生成:d.Al+4HNO3 (稀)=A l(N O3)3+NO↑+2H2O注意:Al遇冷的浓硫酸、浓硝酸会钝化,但加热可反应。


第4章 材料家族中的元素本章复习课一、材料家族中的元素⎩⎪⎪⎪⎪⎪⎪⎪⎨⎪⎪⎪⎪⎪⎪⎪⎧硅 无机非金属材料⎩⎪⎪⎨⎪⎪⎧硅及其化合物⎩⎪⎨⎪⎧硅的性质:常温下与F 2、HF 、强碱溶液反应,加热时可与Cl 2、O 2等反应SiO 2是酸性氧化物且SiO 2与HF 反应硅酸盐——Na 2SiO3无机非金属材料⎩⎪⎨⎪⎧传统无机非金属材料:玻璃、水泥、陶瓷新型无机非金属材料:高温结构陶瓷、生物陶瓷、压电陶瓷铝和金属材料⎩⎪⎨⎪⎧铝及其化合物⎩⎪⎨⎪⎧铝的还原性:与强酸、强碱反应产生H 2Al 2O 3、Al (OH )3是两性化合物(既与强酸反应又与强碱反应)金属材料⎩⎪⎨⎪⎧ 黑色金属材料——铁、铬、锰有色金属材料——金、银、铜等复合材料⎩⎪⎨⎪⎧复合材料的含义复合材料的组成⎩⎪⎨⎪⎧ 基体:起黏结作用增强体:起骨架作用常见的复合材料:玻璃钢、碳纤维增强复合材料,航空、航天复合材料(隔热陶瓷瓦)二、硅及其化合物之间的转化关系三、铝及其化合物之间的转化关系四、铜及其化合物之间的转化关系1.复合材料的优点是()①强度高②质量轻③耐高温④耐腐蚀A.仅①②B.仅②③C.仅③④D.全部2.随着社会的发展,复合材料是一种新型的有发展前途的材料。
目前最主要的应用领域是() A.高分子分离膜B.人类的人工器官C.宇宙航空工业D.新型药物3.关于硅的化学性质的叙述中,正确的是()A.常温时不与任何酸反应B.常温时不与强碱溶液反应C.硅比碳的还原性强D.硅比碳的氧化性强4.下列物质中能与二氧化硅起化学反应的是()①浓HNO3②水③氢氟酸④KOH溶液A.①②B.②④C.①④D.③④5.下列物质中,不属于合金的是()A.硬铝B.黄铜C.钢铁D.水银6.向一定量的下列物质中逐滴加入NaOH溶液,先生成白色沉淀,后沉淀逐渐溶解。
这种物质是() A.MgSO4B.Na [Al(OH)4]C.AlCl3D.FeCl37.某溶液既能溶解Al(OH)3,又能溶解H2SiO3,在该溶液中可以大量共存的离子组是()A.K+、Na+、HCO-3、NO-3B.Na+、SO2-4、Cl-、ClO-C.H+、Mg2+、SO2-4、NO-3D.Ag+、K+、NO-3、Na+8.下列离子方程式正确的是()A.铝溶解在NaOH溶液中:2Al+2OH-+6H2O===2[Al(OH)4]-+3H2↑B.氨水滴入AlCl3溶液中:Al3++3OH-===Al(OH)3↓C.MgO溶于稀盐酸中:O2-+2H+===H2OD.Al(OH)3溶于稀硫酸中:OH-+H+===H2O9.下列有关材料的说法中,不正确的是()A.传统的无机非金属材料主要是指硅酸盐材料B.新型无机非金属材料主要包括高温结构陶瓷、生物陶瓷、压电陶瓷等C.碳纤维是多种复合材料的增强体D.作为宇航用的复合材料中,常用做基体的金属是铝、镁、钛等黑色轻金属10.向含1 mol KAl(SO4)2的溶液中加入适量的Ba(OH)2溶液,使溶液中的SO2-4恰好完全沉淀,则最后生成Al(OH)3的物质的量为()A.1 mol B.1.33 molC.0.667 mol D.0 mol11.某同学用含有Ag+、Al3+、Ca2+、Mg2+4种阳离子的溶液,做如下实验,试填空并按要求写出反应的离子方程式。

第3节 复合材料一、认识复合材料1.概念将______________________________的材料经____________而制成的材料。
2.组成复合材料⎩⎪⎨⎪⎧基体:起 作用 :起 作用 3.优点既保持了__________的特点,又使各组分之间____________,形成了______原材料的特性。
4.分类二、形形色色的复合材料1.生产生活中常用的复合材料(1)玻璃钢:是一种以__________作增强体、__________作基体的复合材料。
玻璃钢的强度可达到甚至超过合金钢的强度,而密度只有钢铁的1/5左右;同时保持着较好的耐化学腐蚀性、电绝缘性和机械加工性能。
(2)目前制造高尔夫球杆、网球拍、羽毛球拍、钓鱼竿、赛车、赛艇、滑雪板和冲浪板等体育用品,采用的大多是____________复合材料。
这种复合材料是在__________的基体中加入了__________作增强体,有韧性好、强度高而质轻的特点。
2.航空、航天领域中的复合材料(1)飞机、火箭的机翼和机身以及导弹的壳体、尾翼中的复合材料,大多是以______为增强体、______为基体的复合材料。
这些材料具有耐高温、强度高、导电性好、导热性好、不吸湿和不易老化等优点。
作为增强体的纤维是__________、__________、__________和____________等耐热性能好的纤维,其中应用最广泛的是__________;作为基体的金属用得较多的是____、____、____等密度小的轻金属。
(2)航天飞机机身上使用的隔热陶瓷瓦是由______和______复合而成的材料制成的。
在这种复合材料中,增强体多为__________、________或____________,基体的主要成分有____________、MgO·Al 2O 3陶瓷、____________、Al 2O 3·ZrO 2陶瓷、Si 3N 4陶瓷、________等。

第1课时 铝与铝合金[学习目标] 1.能从物质类别,元素化合价的角度,依据复分解反应规律和氧化还原反应原理,预测铝及其化合物的性质及物质之间的转化,设计实验进行初步验证,并能分析、解释有关实验现象,设计制备、分离、检验等简单任务的方案。
2.了解Al 、Al 2O 3、Al(OH)3的主要性质和用途。
一、铝与铝合金 1.铝的存在铝在地壳中的含量仅次于□01氧和□02硅,居第三位。
在自然界中铝元素以□03化合态存在。
2.铝的性质(1)物理性质:□04银白色固体,质□05软,密度□06小,导电性仅次于 金、□07银和□08铜。
(2)化学性质 ①铝与非金属的反应铝与O 2反应:铝在氧气中燃烧的化学方程式为□094Al +3O 2=====点燃2Al 2O 3。
该反应的现象为:□10发出耀眼的白光、放出大量的热。
②铝与酸的反应与非氧化性酸:如盐酸、稀硫酸等反应,离子方程式为□112Al +6H +===2Al 3++3H 2↑。
与氧化性酸:如Al 常温下遇冷的浓硫酸、浓硝酸会发生□12钝化。
③铝与强碱溶液反应铝与氢氧化钠溶液反应的化学方程式为□132Al +2NaOH + 6H 2O===2Na[Al(OH)4]+3H 2↑,离子方程式:□142Al +2OH -+ 6H 2O===2[Al(OH)4]-+3H 2↑。
④铝热反应Al 在高温下与Fe 2O 3反应的方程式为□152Al +Fe 2O 3=====高温2Fe +Al 2O 3。
该反应常用于□16焊接钢轨、冶炼难熔的金属等。
3.铝合金及其制品(1)形成:铝中加入其他元素(如铜、镁、硅、锌、锂等)熔合而形成铝合金。
(2)性能:密度□17小、强度□18高、塑性□19好、易于成型、制造工艺简单、成本低廉等。
二、铝的重要化合物1.氢氧化铝[Al(OH)3]——两性氢氧化物 (1)物理性质①色态:□01白色胶状固体物质。
②溶解性:几乎□02不溶于水。

第四章元素与材料世界第一节硅无机非金属材料一、教材分析(一)知识脉络本节教材以无机非金属材料和硅单质及其化合物的性质两条线索相互交叉而展开,介绍了硅、二氧化硅的性质,硅单质的制法,硅、二氧化硅在计算机及通信等高技术领域的应用,常见的硅酸盐材料玻璃、水泥、陶瓷和新型无机硅酸盐材料的主要成分和用途。
与旧教材相比,本教材加大了各种材料在社会日常生活中应用介绍的力度。
(二)知识框架1.半导体材料与单质硅①单质硅的物理性质:②硅的化学性质:常温下不活泼,除氟气、氢氟酸和强碱外,一般不与其他物质反应。
加热条件下,可与氧气反应。
Si + O2加热===== SiO2 Si + 2F2 === SiF4 Si + 4HF === SiF4↑+ 2H2↑③硅的工业制法:工业上,用焦炭在电炉中还原SiO2得到含有少量杂质的粗硅后再提纯。
SiO2 + 2C 高温===== Si + 2CO↑④硅的主要用途:作半导体材料;制造太阳能电池;制造硅合金等。
2.二氧化硅与光导纤维①物理性质②化学性质SiO2 + 2NaOH == Na2SiO3 + H2O SiO2 + CaO 高温===== CaSiO3SiO2 + 4HF == SiF4↑ + 2H2O③二氧化硅的用途:制造电子元器件、光学仪器、精密仪器轴承、光导纤维、石英钟、工艺品、玻璃等。
3.硅酸盐与无机非金属材料①玻璃、水泥玻璃水泥原料纯碱(Na2CO3)石灰石(CaCO3)石英(SiO2)主要原料石灰石粘土辅助原料适量的石膏等原理高温下复杂物理化学变化高温下复杂物理化学变化化学方程式Na2CO3+SiO2Na2SiO3+CO2 CaCO3+SiO2CaSiO3+CO2主要成分及特性普通玻璃钠玻璃(Na2O·CaO·6SiO2)玻璃是非晶体,称为玻璃态物质无固定熔点,在某一温度范围内软化可加工成制品3CaO·SiO2硅酸三钙、2CaO·SiO2硅酸二钙、3CaO·Al2O3铝酸三钙②无机非金属材料:高温结构陶瓷、生物陶瓷、压电陶瓷等二、教学目标1、知识技能目标掌握硅、二氧化硅的物理化学性质,粗硅的制法。
2019-2020年鲁科版高中化学必修1第4章材料家族中的元素第2节铝金属材料第2课时教学设计1【教学目标】1.了解金属材料及金属的通性。
2.掌握铜及其重要化合物的性质。
【教学过程】一、金属与金属材料1.金属的分类(1)冶金工业黑色金属:Fe、Cr、Mn(黑色金属的颜色不一定是黑色,如纯净的铁、铬的颜色是银白色) 有色金属:除Fe、Cr、Mn以外的所有金属(2)按密度轻金属:密度<4.5g/cm3(如钠、镁、铝)重金属:密度>4.5g/cm3(如铁、铜、W)(3)按自然界中的含量常见金属:如铁(4.75%) 铝(7.7%) 钙(3.45%)等稀有金属:如锆、铌、钼等2.金属的通性:有金属光泽、有延展性,是电和热的良导体,具有还原性。
二、【联想·发散】金属之最:在生活生产中使用最广泛的金属是铁;地壳中含量最多的金属元素是铝(Al);最稳定的金属单质,延展性最好的都是金(Au);导电性能最好的是银(Ag);自然界中最活泼的金属是铯(Cs);最硬的金属单质是铬(Cr);熔点最高的金属单质是钨(3413℃)(W);熔点最低的金属单质是汞(-39℃)(Hg);密度最大的是锇(22.57g/cm3)。
1.钢铁(1)生铁:含碳量2%-4.3%,硬度大,但较脆且不易机械加工。
(2)普通钢:含碳量0.03%-2%,增加了铁锰等元素,改善了铁的性能,但易锈蚀。
(3)不锈钢:在普通钢基础上,加入铬镍等元素,含铬在一般在12%以上,在空气中能保持金属光泽,且有不生锈的特性。
说明:由于铬元素的加入,能使钢材表面形成致密且坚固的氧化膜,防止内部铁与外界物质接触。
镍元素的加入,使不锈钢在酸碱盐的水溶液中也能具有很好的化学稳定性和耐腐蚀性。
2.金、银、铜等金属材料(1)物理性质①特性:金是黄色金属;银是白色金属;铜是紫红色金属。
②共性:硬度较小,熔点较高,密度较大,具有金属光泽、良好的延展性、导电性和导热性。
(2)化学性质:金、银、铜都属于不活泼金属,相对而言,其活泼程度依次增强。
鲁教版化学1(必修)第四章材料家族中的元素第二节铝金属材料(2课时)一、学习任务概述通过本节课的学习,认识到一个新的金属元素---铝,并了解其性质以及同族金属的性质。
二、学习对象特征分析(一)教学对象高一年级学生,经过初中的学习已经有了一定的化学基础知识,掌握了一定的化学学习方法,有一定的分析以及总结归纳能力,但是对抽象的概念的理解可能还是会有困难。
(二)教学背景本课是高中一年级的一堂化学基础知识课,本节课主要是学习有关金属及其化合物的一些知识,根据幻灯片展示出的一系列以前接触的实例。
(三)知识基础本节课是主要介绍金属铝及其化合物,学生在学习了金属之后,通过具体实例来学习金属材料,并通过练习与小组同学进行讨论总结出金属铝及其化合物的性质(四)能力基础1. 学生思维活跃,不怕困难,遇到不会的问题时,先要自己思考一下,如果不能想出解决问题的方法,再去请教别人。
2. 在教师给予一定的指导下,学生具有一定的分析能力和相互合作的能力,归纳总结得出结论。
(五)学习风格分析1. 对新鲜事物有强烈的好奇感,并积极去探索新事物,发现新现象。
2. 和别人的比较,得出强有力的结论有强烈的争强好胜心,推动学习。
3. 想得到老师的好评,对化学产生浓厚的兴趣。
(六)情感态度1. 学生能够认识到金属的历史,并对化学产生浓厚的兴趣,对金属基础知识之间的联系做出合理的解释。
2. 学生要利用网络资源进行学习,去了解更多的新知识。
三、本节教材分析材料包括合成高分子材料、无机非金属材料、金属材料和各种复合材料。
本章的第一节学习了硅及无机非金属材料在生产、生活中的应用,前面的章节中陆续学习了Na、Mg、Fe等金属的性质,从学生的认知结构来看,学习金属材料是学生认知结构发展的需要。
本节教材是从以下两条线索展开:一是以铝及其化合物为代表的金属及其化合物的性质线索,这为学生学习元素周期律奠定了基础;二是铝合金及金属材料的应用线索,重点介绍铝合金、钢铁及常见金属金、银、铜等的应用,给学生认识物质世界提供了一个更广阔的空间。
第四单元材料家族中的元素单元测试题一、选择题1.下列说法不正确的是( )A.硅是非金属元素,但它的单质是灰黑色有金属光泽的固体。
B.当加热到一定程度时,硅能与氧气、氢气等非金属反应。
C.二氧化硅既是酸性氧化物,又是碱性氧化物。
D.硅的导电性能介于金属和绝缘体之间,是良好的半导体材料。
2.石英玻璃是将石英在1600℃高温下熔化,冷却后形成玻璃,关于石英玻璃的结构和性质描述正确的是( )A.石英玻璃属于原子晶体。
B.石英玻璃的结构类似于液体。
C.石英玻璃耐高温且能抵抗一切酸的腐蚀。
D.石英玻璃能经受温度剧变且能抵抗碱的腐蚀。
3.用等物质的量的金属钠进行下列实验,产生氢气最多的是( )A.将钠放入足量的稀盐酸中B.将钠放入足量的稀硫酸中C.将钠放入足量的硫酸铝钾溶液中D.将那用铝箔包好,并刺穿一些小孔,放入足量的水中4.镁铝合金因坚硬、轻巧、美观、洁净、易于加工,而成为新型建筑装潢材料,主要用于制作窗框、卷帘门、防护栏等。
下列与这些用途无关的性质是( )A.不易生锈B.导电性好C.密度小D.强度高5.铝制品比铁制品在空气中不易被锈蚀,原因是( )A.铝的金属活动性比铁弱。
B.铝的密度比铁的密度小。
C.铝在空气中易于氧气形成一层氧化物保护膜。
D.铝不跟氧气发生化学反应。
6. 下列溶液可以盛放在玻璃瓶中,但不能用磨口玻璃塞的是( )A.硫酸钠溶液B.氢氟酸C.氢氧化钠溶液D.氯化钠溶液7.已知Ba[Al(OH)4]2可溶于水。
右图表示的是向A12(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加人Ba(OH)2的物质的量x的关系。
下列有关叙述正确的是( )A.a—b时沉淀的物质的量:A1(OH)3比BaSO4多B.c—d时溶液中离子的物质的量:[Al(OH)4]-比Ba2+多C.C点溶液中离子的物质的量OH-等于Ba2+的2倍D.d—e时溶液中离子的物质的量:Ba2+可能等于OH-8.等体积、等物质的量浓度的硫酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加等质量的铝,生成氢气的体积比为5:6,则甲、乙两烧杯中的反应情况可能分别是( )A.甲、乙中都是铝过量。
高中化学第4章材料家族中的元素本章总结教案鲁科版必修1
热点专题突破
REDIANZHUANTITUPO
专题无机推断题中的突破点及方法归纳
1.突破点
(1)特殊颜色
①焰色反应:Na +(黄色)、K +(紫色,透过蓝色钴玻璃).
②有色溶液:Fe 2+(浅绿色)、Fe 3+(黄色)、Cu 2+(蓝色)、MnO -4(紫色). ③有色固体
红色:Cu ;红棕色:Fe 2O 3;红褐色:Fe(OH)3;绿色:Cu 2(OH)2CO 3、FeSO 4·7H 2O ;蓝色:Cu(OH)2、CuSO 4·5H 2O ;黑色:CuO 、FeO 、MnO 2、炭、Fe 3O 4;淡黄色:Na 2O 2、AgBr 、S ;白色:Fe(OH)2、CaCO 3、BaSO 4、AgCl 、Al(OH)3、Mg(OH)2.
(2)特殊性质
①在一定条件下能漂白有色物质的淡黄色固体只有Na 2O 2. ②遇SCN -
显红色的只有Fe 3+
.
③常见的可溶于强碱溶液的白色沉淀是Al(OH)3、H 2SiO 3,可溶于强碱溶液的金属氧化物是Al 2O 3.
(3)特征反应
①能与强酸反应产生气体的物质:活泼金属,如Na 、Al 、Zn 等;部分弱酸盐或弱酸的酸式盐,如碳酸盐、碳酸氢盐等.
②能与强碱反应产生气体的物质:单质,如Al 、Si 等;盐类,如铵盐等.
③既能与强酸又能与强碱溶液反应的物质:金属单质,如Al 等;两性氧化物,如Al 2O 3
等;两性氢氧化物,如Al(OH)3等;弱酸的铵盐,如NH 4HCO 3、(NH 4)2CO 3等;弱酸的酸式盐,如NaHCO 3等.
④能与水反应产生气体的物质:活泼的金属单质,如Na 、K 、Mg(加热)、Fe(高温生成Fe 3O 4)等;金属过氧化物,如Na 2O 2等.
(4)特殊的转换关系
①特征转换:A ――→O 2B ――→O 2C ――→H 2O (酸或碱) 如Na ――→O 2Na 2O ――→O 2Na 2O 2――→H 2O NaOH ②三角转换
2.规律方法
无机物推断题主要分为三类:选择型推断题、文字叙述型推断题、框图型推断题.
此类题目的常见解题思路:(1)抓突破口,如特殊性质、特殊现象、特殊转化关系等;(2)猜想验证,假设思维模式是由题设条件和转化关系图找出题目突破口,并对有关内容建立假设,然后将假设结果代入题中验证判断.假设模式的思维途径可表示为:
例下图是中学化学中常见物质间的转化关系,其中C、D、G为单质,且G是目前世界年产量最高的金属,其余为化合物.A是地球上最多的液态氧化物,反应
E +F―→G+H是工业冶炼G的主要反应原理,F与H的组成元素相同.J不溶于水,是常见的重要的建筑材料(反应条件、部分反应物和生成物均已略去).
请回答下列问题:
(1)写出有关物质的化学式:B________;D________.
(2)C―→F的方程式为____________________,基本反应类型是________.
(3)写出E+F―→G+H的化学方程式: _______________________________.
[解析] (1)G是单质,且G是目前世界年产量最高的金属,所以G是Fe;A是地球上最多的液态氧化物,所以A是H
2
O;F与H的组成元素相同,且反应E+F―→G+H是工业冶炼铁
的主要反应原理,所以F为CO,H为CO
2,E为Fe
2
O
3
;J不溶于水,且是常见的重要的建筑材
料,所以J为CaCO
3;I和CO
2
反应生成CaCO
3
和H
2
O,所以I为Ca(OH)
2
;B和水反应生成Ca(OH)
2
,
所以B为CaO;H
2O分解生成C和D,C能反应生成CO,Fe可以反应生成D,所以C为O
2
,D为
H
2
.
(2)由上述推断可知C为氧气,F为一氧化碳,碳不完全燃烧生成一氧化碳,两种物质生成一种物质,属于化合反应.
(3)E+F―→G+H为一氧化碳和氧化铁反应生成铁和二氧化碳,化学方程式为3CO+
Fe
2O
3
=====
高温
2Fe+3CO
2
.
[答案] (1)CaO H
2
(2)2C+O
2
=====
点燃
2CO 化合反应
(3)3CO+Fe
2
O
3
=====
高温
2Fe+3CO
2。