化学反应工程第二章答案
- 格式:ppt
- 大小:428.00 KB
- 文档页数:26

化学反应工程第二章习题答案化工103班2-1银催化剂上进行甲醇氧化为甲醛的反应2CH3OHO22HCHO2H2O2CH3OH3O22CO24H2O进入反应器的原料中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),反应后甲醇转化率达72%,甲醛的收率为69.2%,试计算:(1)反应的总选择性;(2)反应器出口组成。
解:根据甲醇:空气:水蒸气=2:4:1.3(摩尔比),以100mol进料为基准设χy分别为HCOH和co2生成量2CH3OHO22HCHO2H2O2CH3OH3O22CO24H2O对上式积分(n1)kct1cn1kcAcn1AOn111cn1n1AcA①0①式为无量纲对数形式可判别出kc的单位molm3n1kt111同理pn1pn1n1kn11ApAp的单位pa02-4在间歇反应器中进行等温二级、一级、零级均相反应,求出转化率由0变为0.9所需的时间,与转化率由0.9变为0.99所需时间之比。
解:等温二级反应111kt1ckt21AcA0cA2cA某A0.9某A0.999t190A0kcA0t1:t21:10等温一级反应ktlncA0cAln10同上解得t1t2kt1:t21:1等温零级反应ktcA0cA同上解得t10.9cA0A0kt20.09ck10:12-5某一反应在间歇反应器中进行,经8min后反应物转化了80%,经过18min后转化了90%,求表达此反应的动力学方程。
解dnrAAVdt积分后:tcA0dcArACcA0dcAcAcAn111n1n1AkcAkn1cA0cAt8min某A180%t18min某A290%28111kn1cn1cn1n1A0A01某A11811kn1cn11n1n1A0cA01某A2n2r2AkcA2-6某一气相一级反应A2RS,在恒温、恒压的实验反应器中进行,原料含75%A及25%惰性气体(摩尔比),经8min后其体积增加一倍。
求此时的转化率及该反应在此温度下的速率常数。

第一章绪论习题1.1 解题思路:(1)可直接由式(1.7)求得其反应的选择性(2)设进入反应器的原料量为100 ,并利用进入原料气比例,求出反应器的进料组成(甲醇、空气、水),如下表:组分摩尔分率摩尔数根据式(1.3)和式(1.5)可得反应器出口甲醇、甲醛和二氧化碳的摩尔数、和。
并根据反应的化学计量式求出水、氧及氮的摩尔数,即可计算出反应器出口气体的组成。
习题答案:(1) 反应选择性(2) 反应器出口气体组成:第二章反应动力学基础习题2.1 解题思路:利用反应时间与组分的浓度变化数据,先作出的关系曲线,用镜面法求得反应时间下的切线,即为水解速率,切线的斜率α。
再由求得水解速率。
习题答案:水解速率习题2.3 解题思路利用式(2.10)及式(2.27)可求得问题的解。
注意题中所给比表面的单位应换算成。
利用下列各式即可求得反应速率常数值。
习题答案:(1)反应体积为基准(2)反应相界面积为基准(3)分压表示物系组成(4)摩尔浓度表示物系组成习题2.9 解题思路:是个平行反应,反应物A的消耗速率为两反应速率之和,即利用式(2.6)积分就可求出反应时间。
习题答案:反应时间习题2.11 解题思路:(1)恒容过程,将反应式简化为:用下式描述其反应速率方程:设为理想气体,首先求出反应物A的初始浓度,然后再计算反应物A的消耗速率亚硝酸乙酯的分解速率即是反应物A的消耗速率,利用化学计量式即可求得乙醇的生成速率。
(2)恒压过程,由于反应前后摩尔数有变化,是个变容过程,由式(2.49)可求得总摩尔数的变化。
这里反应物是纯A,故有:由式(2.52)可求得反应物A的瞬时浓度,进一步可求得反应物的消耗速率由化学计量关系求出乙醇的生成速率。
习题答案:(1)亚硝酸乙酯的分解速率乙醇的生成速率(2)乙醇的生成速率第三章釜式反应器习题3.1 解题思路:(1)首先要确定1级反应的速率方程式,然后利用式(3.8)即可求得反应时间。
(2)理解间歇反应器的反应时间取决于反应状态,即反应物初始浓度、反应温度和转化率,与反应器的体积大小无关习题答案:(1)反应时间t=169.6min.(2)因间歇反应器的反应时间与反应器的体积无关,故反应时间仍为169.6min.习题3.5 解题思路:(1)因为B过量,与速率常数k 合并成,故速率式变为对于恒容过程,反应物A和产物C的速率式可用式(2.6)的形式表示。



化学反应⼯程⼆,三章答案第⼆章习题1.动⼒学⽅程的实验测定时,有采⽤循环反应器的,为什么?答:循环反应器⾏为与全混流反应器相同,可以得到反应速率的点数据,⽽且反应器进出⼝浓度差⽐较⼤,对分析精度要求不很⾼。
2.为什么可逆吸热反应宜选平推流反应器且在⾼温下操作,⽽可逆放热反应却不是?根据可逆放热反应的特点,试问选⽤何种类型反应器适宜?为什么?答:可逆吸热反应的反应速率与化学平衡都随温度的升⾼⽽升⾼,⾼温下操作对⼆者都有利。
可逆放热反应的化学平衡随温度的升⾼向反应物⽅向移动,对达到⾼转化率不利。
对此类反应,可选⽤多段绝热反应器或换热条件较好的管式反应器。
3.⼀级反应A→P,在⼀体积为V P的平推流反应器中进⾏,已知进料温度为150℃,活化能为84kJ·mol-1,如改⽤全混流反应器,其所需体积设为V m,则V m/V p应有何关系?当转化率为0.6时,如果使V m=V p,反应温度应如何变化?如反应级数分别为n=2,1/2,?1时,全混流反应器的体积将怎样改变?解:)1ln()1()exp()1ln()1()1(CSTR )1ln(11d 1)(d PFR )exp()(A A Ap mA A A pm A 0A AA0m A A00AA A00A A A0P A 0A A AAx x x RT ERT E x x k kx V V x k c x F V x kc x x kE k kc r x x ----=---=-=--=-=-=-==-?)1ln()1()1ln()1( IF A A A A A P m m p x x x x x k k x V V T T A---=---==()()K07.43215.42302064.015.423876.234929.015.423876.23exp 6109.0637.115.42315.423314.884000 exp 1)6.01ln(6.016.0exp 10.6and 1IF m m mmmmm m m P m P A Pm =-=--=--=-=-- --===T T T T T T T TT T T T T R E x V V mnn n n kc x F V c V V cAf A0m 1Am1m 2A1m 1m 1AAA0m 2/1A 1m 2/1m 2/1A A A0m A1m 2m 2A A 0A m 1,1,2/11,2====-=======---或4. 在体积V R =0.12m 3的全混流反应器中,进⾏反应S R B A 21+??←?→?+kk,式中k 1=7m 3kmol -1min -1,k 2=3m 3kmol -1min -1,两种物料以等体积加⼊反应器中,⼀种含2.8kmolA ·m -3,另⼀种含1.6kmolA ·m -3。
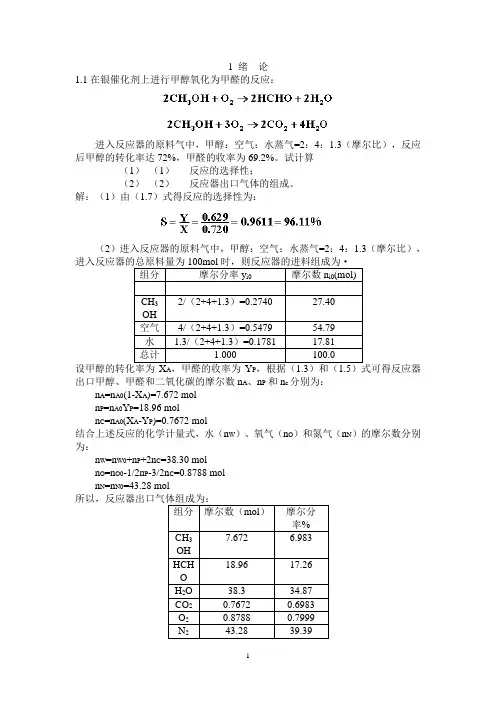
1 绪论1.1在银催化剂上进行甲醇氧化为甲醛的反应:进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),反应后甲醇的转化率达72%,甲醛的收率为69.2%。
试计算(1)(1)反应的选择性;(2)(2)反应器出口气体的组成。
解:(1)由(1.7)式得反应的选择性为:(2)进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),组分摩尔分率y i0 摩尔数n i0(mol)CH32/(2+4+1.3)=0.2740 27.40OH空气4/(2+4+1.3)=0.5479 54.79水 1.3/(2+4+1.3)=0.1781 17.81总计 1.000 100.0A P出口甲醇、甲醛和二氧化碳的摩尔数n A、n P和n c分别为:n A=n A0(1-X A)=7.672 moln P=n A0Y P=18.96 moln C=n A0(X A-Y P)=0.7672 mol结合上述反应的化学计量式,水(n W)、氧气(n O)和氮气(n N)的摩尔数分别为:n W=n W0+n P+2n C=38.30 moln O=n O0-1/2n P-3/2n C=0.8788 moln N=n N0=43.28 mol组分摩尔数(mol)摩尔分率%7.672 6.983CH3OH18.96 17.26HCHOH2O 38.3 34.87CO2 0.7672 0.6983O2 0.8788 0.7999N2 43.28 39.392 反应动力学基础2.4在等温下进行液相反应A+B→C+D,在该条件下的反应速率方程为:若将A和B的初始浓度均为3mol/l的原料混合进行反应,求反应4min时A的转化率。
解:由题中条件知是个等容反应过程,且A和B的初始浓度均相等,即为1.5mol/l,故可把反应速率式简化,得由(2.6)式可知代入速率方程式化简整理得积分得解得X A=82.76%。
2.6下面是两个反应的T-X图,图中AB是平衡曲线,NP是最佳温度曲线,AM是等温线,HB是等转化率线。

第二章 均相反应动力学基础均相反应 均相反应是指参予反应的各物质均处同一个相内进行化学反应。
在一个相中的反应物料是以分子尺度混合的,要求:①必须是均相体系 (微观条件) ②强烈的混合手段 (宏观条件) ③反应速率远小于分子扩散速度一、计量方程反应物计量系数为负,生成物计量系数为正。
计量方程表示物质量之间关系,与实际反应历程无关; 计量系数只有一个公因子;用一个计量方程表示物质量之间关系的体系称为单一反应,反之称为复合反应。
二、化学反应速率单位时间、单位反应容积内组分的物质的量(摩尔数)的变化称之为该组分的反应速率。
反应物:生成物:对于反应三、化学反应速率方程r 是反应物系的组成、温度和压力的函数。
32223NH H N =+032223=--N H NH A A Adn r Vd d t C dt=-=-R R Rdn r Vdt dC dt==A B S R A B S Rαααα+=+SABRABSRr r r r αααα===AA AB r [k (T)][f(C ,C ,)]=有两类;双曲函数型和幂函数型。
k -化学反应速率常数; a(b)-反应级数。
(1)反应级数(i) 反应级数与反应机理无直接的关系,也不等于各组份的计量系数; (ii) 反应级数表明反应速率对各组分浓度的敏感程度;(iii) 反应级数是由实验获得的经验值,只能在获得其值的实验条件范围内加以应用。
(2)反应速率常数k[k]: s -1·(mol/m 3)1-nE :是活化能,把反应分子“激发”到可进行反应的“活化状态”时所需的能量。
E 愈大,通常所需的反应温度亦愈高,反应速率对温度就愈敏感。
k 0 —指前因子,其单位与 反应速率常数相同;E— 化学反应的活化能,J/mol ; R — 气体常数,8.314J/(mol .K)。
a b A A B r kC C=2220.512H Br HBrHBrBr k c c r c k c =+0exp[]E k k RT=-01ln ln E k k R T=-⨯ln klnk 0 slop=-E/R1/T⏹ 反应速率的温度函数关系● 活化能越高,斜率越大,该反应对温度越敏感; ● 对于一定反应,低温时反应速率对温度变化更敏感。


第2章 化学计量学2.3 根据化学计量系数矩阵确定下列体系的独立反应数和独立的反应式:Br 2→2BrBr+H 2→HBr+HH+Br 2→HBr+BrHBr+ H →Br+ H 22Br →Br 2解:5个反应式可写成矩阵形式:⎥⎥⎥⎥⎥⎥⎦⎤⎢⎢⎢⎢⎢⎢⎣⎡=⎥⎥⎥⎥⎥⎥⎦⎤⎢⎢⎢⎢⎢⎢⎣⎡⎥⎥⎥⎥⎥⎥⎦⎤⎢⎢⎢⎢⎢⎢⎣⎡--------00000000211111001111111100002122H HBr H Br Br A A A A A 将系数矩阵第一行加到第五行,得:⎥⎥⎥⎥⎥⎥⎦⎤⎢⎢⎢⎢⎢⎢⎣⎡--------0002111110011111111000021 将系数矩阵第二行加到第四行,得:⎥⎥⎥⎥⎥⎥⎦⎤⎢⎢⎢⎢⎢⎢⎣⎡-----0000000000011111111000021 第一行的(-1)倍加到第三行,并且:⎥⎥⎥⎥⎥⎥⎦⎤⎢⎢⎢⎢⎢⎢⎣⎡----0000000000011101111000021 将第二行的(-1)倍加到第三行,得:⎥⎥⎥⎥⎥⎥⎦⎤⎢⎢⎢⎢⎢⎢⎣⎡----0000000000102001111000021 得到3个线性独立的行向量,故秩k=3,有三个独立反应,矩阵前三行即为所求的独立反应。
2002222=-=+--=-H H H HBr H Br Br Br即:Br Br 22=222H H HBrH H Br =+=+2.6 在银催化剂上进行甲醇氧化得到甲醛,进口气体的成分为CH 3OH :空气:水蒸气=2:4:1.3(物质的量比)。
反应后气体含甲醇、甲醛(HCHO )、水汽、CO 及过剩的空气。
若入口空气含N 279%,O 221%,甲醇的转化率为72%,生成甲醛的选择性为92%。
用原子矩阵法求独立反应和反应器出口气体的组成。
解:(1)先写出其原子矩阵:N 2 H 2O O 2 CH 4OCO CH 2O[]C O H N ji⎥⎥⎥⎥⎦⎤⎢⎢⎢⎢⎣⎡=111000111210204020000002β 对原子矩阵进行初等变换,将矩阵最左的子方阵变换为单位降。

第一章习题1化学反应式与化学计量方程有何异同?化学反应式中计量系数与化学计量方程中的计量系数有何关系?答:化学反应式中计量系数恒为正值,化学计量方程中反应物的计量系数与化学反应式中数值相同,符号相反,对于产物二者相同。
2 何谓基元反应?基元反应的动力学方程中活化能与反应级数的含义是什么?何谓非基元反应?非基元反应的动力学方程中活化能与反应级数含义是什么?答:如果反应物严格按照化学反应式一步直接转化生成产物,该反应是基元反应。
基元反应符合质量作用定律。
基元反应的活化能指1摩尔活化分子的平均能量比普通分子的平均能量的高出值。
基元反应的反应级数是该反应的反应分子数。
一切不符合质量作用定律的反应都是非基元反应。
非基元反应的活化能没有明确的物理意义,仅决定了反应速率对温度的敏感程度。
非基元反应的反应级数是经验数值,决定了反应速率对反应物浓度的敏感程度。
3若将反应速率写成tc rd d AA -=-,有什么条件? 答:化学反应的进行不引起物系体积的变化,即恒容。
4 为什么均相液相反应过程的动力学方程实验测定采用间歇反应器?答:在间歇反应器中可以直接得到反应时间和反应程度的关系,而这种关系仅是动力学方程的直接积分,与反应器大小和投料量无关。
5 现有如下基元反应过程,请写出各组分生成速率与浓度之间关系。
(1)A+2B ↔C A+C ↔ D (2)A+2B ↔C B+C ↔D C+D →E(3)2A+2B ↔CA+C ↔D 解(1)D4C A 3D D 4C A 3C 22BA 1C C22B A 1B D 4C A 3C 22B A 1A 22c k c c k r c k c c k c k c c k r c k c c k r c k c c k c k c c k r -=+--=+-=+-+-=(2)E6D C 5D 4C B 3D E 6D C 5D 4C B 3C 22BA 1C D4C B 3C 22B A 1B C22B A 1A 22c k c c k c k c c k r c k c c k c k c c k c k c c k r c k c c k c k c c k r c k c c k r +--=+-+--=+-+-=+-=(3)D4C A 3D D 4C A 3C 22B2A 1C C22B 2A 1B D 4C A 3C 22B 2A 1A 2222c k c c k r c k c c k c k c c k r c k c c k r c k c c k c k c c k r -=+--=+-=+-+-=6 气相基元反应A+2B →2P 在30℃和常压下的反应速率常数k c =2.65×104m 6kmol -2s -1。

2 反应动力学基础2.1在一体积为4L 的恒容反应器中进行A 的水解反应,反应前 A 的含量为12.23%(重量),混合物的密度为1g/mL ,反应物A 的分子量为88。
在等温常压解:利用反应时间与组分A 的浓度变化数据,作出C A ~t 的关系曲线,用镜面法求得t=3.5h 时该点的切线,即为水解速率。
切线的斜率为0.760.125/.6.1α-==-mol l h由(2.6)式可知反应物的水解速率为 0.125/.-==dC A r mol l h A dt2.2在一管式反应器中常压300℃等温下进行甲烷化反应:2423+→+CO H CH H O催化剂体积为10ml ,原料气中CO 的含量为3%,其余为N 2,H 2气体,改变进口原料气流量Q 0解:是一个流动反应器,其反应速率式可用(2.7)式来表示00000(1)(1)-==-=-=-A A RA A A A A A A AdF r dV F F X Q C X dF Q C dX 故反应速率可表示为:0000(/)==A A A A A R R dX dX rQ C C dV d V Q用X A ~V R /Q 0作图,过V R /Q 0=0.20min 的点作切线,即得该条件下的dX A /d(V R /Q 0)值α。
0.650.04 1.790.34α-==故CO 的转化速率为 40030.10130.03 6.3810/8.31410573--⨯===⨯⨯⨯A A P C mol l RT4300 6.3810 1.79 1.1410/.min (/)--==⨯⨯=⨯A A A R dX r C mol l d V Q2.3已知在Fe-Mg 催化剂上水煤气变换反应的正反应动力学方程为:20.850.4/-=⋅w CO CO r k y y kmol kg h式中y CO 和y C O2为一氧化碳及二氧化碳的瞬间摩尔分率,0.1MPa 压力及700K 时反应速率常数k W 等于0.0535kmol/kg.h 。
《化学反应工程》第三版(陈甘堂著)课后习题答案第二章均相反应动力学基础2-4三级气相反应2NO+O22NO2,在30℃及1kgf/cm2下反应,已知反应速率常数2kC=2.65×104L2/(mol2 s),若以rA=kppApB表示,反应速率常数kp应为何值?解:原速率方程rA=dcA2cB=2.65×104cAdt由气体状态方程有cA=代入式(1)2-5考虑反应A课所以kp=2.65×104×(0.08477×303) 3=1.564后当压力单位为kgf/cm2时,R=0.08477,T=303K。
答p p 2rA=2.65×10 A B =2.65×104(RT) 3pApBRT RTp表示的动力学方程。
解:.因,wwnAp=A,微分得RTVdaw案24网pAp,cB=BRTRT3P,其动力学方程为( rA)=dnAn=kA。
试推导:在恒容下以总压VdtVδA=3 1=21dnA1dpA=VdtRTdt代入原动力学方程整理得wdpA=kpAdt设初始原料为纯A,yA0=1,总量为n0=nA0。
反应过程中总摩尔数根据膨胀因子定义δA=n n0nA0 nA若侵犯了您的版权利益,敬请来信通知我们!Y http://.cn.co(1)mol/[L s (kgf/cm2) 3]m(1)则nA=nA01(n n0)δA1(P P0)δA(2)恒容下上式可转换为pA=P0所以将式(2)和式(3)代入式(1)整理得2-6在700℃及3kgf/cm2恒压下发生下列反应:C4H10发生变化,试求下列各项的变化速率。
(1)乙烯分压;(2)H2的物质的量,mol;(3)丁烷的摩尔分数。
解:P=3kgf/cm2,(1)课MC4H10=58,(2)w.krC2H4=2( rC4H10)=2×2.4=4.8kgf/(cm2 s)PC4H10=PyC4H101 dpC4H10= P dt2.4-1==0.8 s 3w(3)nC4H10=nyC4H10=n0(1+δC4H10yC4H10,0xC4H10)yC4H10dnH2dtdnH2dt=hdaw后n0=nC4H10,0=δC4H10rC4H10=反应开始时,系统中含C4H*****kg,当反应完成50%时,丁烷分压以2.4kgf/(cm2 s)的速率dyC4H10dt答1rCH=2.4224wdnC4H10dt案116×1000=2000mol582+1 1==21网dyC4H10=n0(1+δC4H10yC4H10,0xC4H10) dt=2000×(1+2×1×0.5)×0.8=3200 mol/s若侵犯了您的版权利益,敬请来信通知我们!Y http://.cno2C2H4+H2,dP=k[(δA+1)P0 P]=k(3P0 P)dtm(3)dpA1dP= dtδAdt2-9反应APS,( r1)=k1cA , ( r2)=k2cp,已知t=0时,cA=cA0 ,cp0=cS0=0, k1/k2=0.2。
化⼯反应⼯程答案第⼆章2 反应动⼒学基础2.1在⼀体积为4L的恒容反应器中进⾏A的⽔解反应,反应前 A的含量为12.23%(重量),混合物的密度为1g/mL,反应物A的分⼦量为88。
在等温常压下不断解:利⽤反应时间与组分A的浓度变化数据,作出C~t的关系曲线,⽤镜A⾯法求得t=3.5h时该点的切线,即为⽔解速率。
切线的斜率为0.760.125mol/l.h 6.1)式可知反应物的⽔解速率为由(2.6?dCA?0.125mol/lr?.h Adt2.2在⼀管式反应器中常压300℃等温下进⾏甲烷化反应:CO?3H?CH?HO242⽓体,改变进⼝原10ml催化剂体积为,原料⽓中CO的含量为3%,其余为N,H22料⽓流量Q进⾏实验,测得出⼝CO的转化率为:022.2 38.5 29.4 83.3 67.6 50.0 Q(ml/min) 07060 40 20 30 50 X(%)的转化速率。
50ml/min时CO试求当进⼝原料⽓体流量为解:是⼀个流动反应器,其反应速率式可⽤(2.7)式来表⽰?dF A?r A dV R F?F(1?X)?QC(1?X)AAAA000A dF??QCdX AA00A故反应速率可表⽰为:dXdX AA r?QC?C A00AA0dVd(V/Q)0RR)作图,过V⽤X~/QV/Q的点作切线,即得该条件下的=0.20mindX/d(V/Q0RA0RA0Rα。
值0.45 0.20 0.26 0.34 0.148 min V/Q0.12 0R70.020.0 % X30.0 60.0 40.0 50.0 A0.65?0.04??1.79?0.34 CO故的转化速率为P0.030.1013?4?0A??10lmol/C??6.380A RT?3??8.31410573dX?4?3A mol/l?1.14?10?6.38r?C?10.min1.79?0AA d(V/Q)0R催化剂上⽔煤⽓变换反应的正反应动⼒学⽅程为:Fe-Mg2.3已知在0.40.85?h?kmolr?kyy/kg COwCO2时反700Ky式中y和为⼀氧化碳及⼆氧化碳的瞬间摩尔分率,0.1MPa压⼒及CO2CO2堆密度为/g,0.0535kmol/kg.h。
化学反应工程1-2章答案(华东理工大学张濂版课后习题)第一章1-1 乙苯循环量:46kg/h 补充的新鲜乙苯:100-46=54 kg/h单程转化率=(100-46)/100×100%=54%选择率=(48/105)/(54/107)×100%=90.6%单程摩尔收率=(48/105)/(100/107)×100%=48.9% 单程质量收率=48/100×100%=48% 总摩尔收率=(48/105)/(54/107)×100%=90.6% 总质量收率=48/54×100%=88.9%单耗(摩尔)=1/90.6%=1.104 单耗(质量)=1/88.9%=1.1241-2以100kg进口气体为基准,设甲醛转化量为xkg则:进口出口100kg 100kg甲醛:10kg 1.6kg丁炔二醇:0kg 7.65kg转化率=(10-1.6)/10×100%=84%选择率=(7.65/86)/((10-1.6)/30)×100%=31.76%单程质量收率=7.65/100×100%=7.65%总质量收率=7.65/(10-1.6)×100%=91.07%1-3得到的顺丁烯二酸酐:20.27×34.5%=6.99t质量收率:6.99/7.21×100%=96.9%摩尔收率:(6.99/98)/(7.21/78)×100%=72.7%第二章2-1 化学计量方程式不影响速率表达式,因此以反应物B和产物P表示的反应速率表达式为:(-r B)=k B C B2C p22-2k C=(-r A)/C A n k P=(-r A)/P A nn=0 (-r A)=k C=k P mol/m3﹒hn=1 k C =(-r A)/C A=( mol/m3﹒h)/(mol/L)=(103h)-1k P=(-r A)/P A=( mol/m3﹒h)/Mpa=mol/m3﹒h﹒Mpan=2 k C=(-r A)/C A2=( mol/m3﹒h)/ (mol/L)2=(106h﹒mol)-1k P=(-r A)/P A2=( mol/m3﹒h)/(Mpa)2= mol/m3﹒h﹒Mpa2 2-3 t1=8d=11520min T1=20℃=293Kt2=10min T2=120℃=393Kln(r2/r1)=ln(k2/k1)=E/R(1/T1-1/T2)ln(11520/10)=E/8.314(1/293-1/393)E=67751J/mol2-4 ln(r2/r1)=ln(k2/k1)=E/R(1/T1-1/T2)1)r2/r1=2 T1=473K E1=156.9kJ/molln2=156.9×103 /8.314(1/473-1/T2)T2=482.3K=209.3℃△T=9.3℃2)同1),ln2=104.6×103 /8.314(1/473-1/T2)T2=489K=216℃△T=16℃2-5 ln(r2/r1)=ln(k2/k1)=E/R(1/T1-1/T2)ln2=E1/8.314(1/300-1/310) E1=57616J/mol同理:ln2=E2/8.314(1/400-1/410) E2=94607J/mol ln2=E3/8.314(1/500-1/510) E3=144040J/molln2=E4/8.314(1/600-1/610) E4=208332J/mol。
第一章1. Fogler 《化学反应工程》(英文版)Page 31,P1-11B.解:摩尔衡算:0Vj j j j dN F F r dV dt-+=⎰C :the corn steep liquor ;R :RNA ;P :penicillin.假设细胞为全混釜反应器,C 完全反应,R 不排出反应器,P 全部排出反应器 在非稳态操作条件的摩尔平衡:(质量平衡类似,将各量表示成以质量为基准就行)0C F =,0CdN dt=,00C C F r V += 00R F =,0R F =,R R dN r V dt=0P F =,0CdN dt=,0P P F r V -+=2. Fogler 《化学反应工程》(英文版)Page 33,P1-15B.解:由题目给出的条件可知,对于A B →的反应F A0=5 mol/h ,v 0=10 L/h ,C A0=0.5 mol/L对于CSTR : 摩尔衡算:0A AAF F V r -=- 动力学:(1)A r k -=(2)A A r kC -=(3)2A A r kC -=摩尔流率与浓度关系:000A A F C v =0A A A F C v C v ==浓度为变量的摩尔衡算方程:00000A A A AA AC v C v C C V v r r --==--当消耗99%的组分A 时,00.01A A C C =,代入上式可得:000000.010.99A A A A AC C C V v v r r -==--代入动力学: (1)00000.990.99A A A C C V v v r k==- 代入数据得到:V=99 L (2)000000000.990.990.9999(0.01)A A A A A A C C C v V v v v r kC k C k====- 代入数据得到:V=2750 L (3)000000022000.990.990.999900(0.01)A A A A A A A C C C v V v v v r kC k C kC ====- 代入数据得到:V=66000 L对于PFR : 摩尔衡算:AA dF r dV= 动力学:(1)A r k -=(2)A A r kC -=(3)2A A r kC -=摩尔流率与浓度关系:000A A F C v =0A A A F C v C v ==浓度为变量的摩尔衡算方程:0()A A d C v r dV= 0AAdC dV v r = 00AA C AC AdC V v r =⎰代入动力学: (1)000000000000.99()(0.01)AA A A C C A AA A A A A C C A v v v dC dC V v v C C C C C r k k k k ===-=-=-⎰⎰ 代入数据得到:V=99 L (2)00000000ln ln ln1000.01AA C A A AC A A A v C v C v dC V v kC k C k C k ====-⎰代入数据得到:V=127.9 L (3)000020001111()()0.01AA C A C AA A A A v v dC V v kC k C C k C C ==-=--⎰ 代入数据得到:V=660 L 对于BR : 摩尔衡算:AA dN r V dt= 动力学:(1)A r k -=(2)A A r kC -=(3)2A A r kC -=浓度为变量的摩尔衡算方程:AA C A A C dC dt r =⎰代入动力学: (1)000.001A A C C t k-=代入数据得到:t=9.99h (2)001ln0.001A A C t k C =代入数据得到:t=19.2h (3)00111()0.001A A t k C C =- 代入数据得到:t=666h3. Fogler 《化学反应工程》(中文版)Page 23,P1-12C.解:由题目条件可知,反应A B C →+,在恒体积、等温、完全混合的间歇釜中进行,且V=20 L ,N A0=20 mol ,C A0=N A0/V=1 mol/L (1) 摩尔衡算:AA dN r V dt= 动力学:A A r kC -=物质量与浓度的关系:A A N C V =浓度为变量的摩尔衡算方程:()A A d C V r V dt= A A dC V r V dt=AA dC dt r =0AA C AC AdC t r =⎰代入动力学:001ln AA C A A C A A C dC t kC k C ==-⎰代入数据得:t=7.99 min(2) 摩尔衡算:AA dN r V dt= 动力学:2A A r kC -=物质量与浓度的关系:A A N C V = 浓度为变量的摩尔衡算方程:()A A d C V r V dt= A A dC V r V dt=AA dC dt r =0AA C AC AdC t r =⎰代入动力学:020111()AA C A C AA A dC t kC k C C ==--⎰ 代入数据得:t=9.5 min(3)假设反应气体为理想气体: 状态方程:PV NRT =00208.31440033256000.02N RT P Pa Pa V ⨯⨯=== 408.31440066512000.02t t N RT P Pa Pa V ⨯⨯===第二章1. 在一个恒体积的间歇反应器中进行液相等温不可逆反应:A B →若反应为二级、一级、零级均相反应,分别求出转化率由0至0.9所需时间与转化率由0.9至0.99所需时间之比。