最新化学反应工程第二章
- 格式:doc
- 大小:794.00 KB
- 文档页数:30



化学反应工程第二章习题答案化工103班2-1银催化剂上进行甲醇氧化为甲醛的反应2CH3OHO22HCHO2H2O2CH3OH3O22CO24H2O进入反应器的原料中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),反应后甲醇转化率达72%,甲醛的收率为69.2%,试计算:(1)反应的总选择性;(2)反应器出口组成。
解:根据甲醇:空气:水蒸气=2:4:1.3(摩尔比),以100mol进料为基准设χy分别为HCOH和co2生成量2CH3OHO22HCHO2H2O2CH3OH3O22CO24H2O对上式积分(n1)kct1cn1kcAcn1AOn111cn1n1AcA①0①式为无量纲对数形式可判别出kc的单位molm3n1kt111同理pn1pn1n1kn11ApAp的单位pa02-4在间歇反应器中进行等温二级、一级、零级均相反应,求出转化率由0变为0.9所需的时间,与转化率由0.9变为0.99所需时间之比。
解:等温二级反应111kt1ckt21AcA0cA2cA某A0.9某A0.999t190A0kcA0t1:t21:10等温一级反应ktlncA0cAln10同上解得t1t2kt1:t21:1等温零级反应ktcA0cA同上解得t10.9cA0A0kt20.09ck10:12-5某一反应在间歇反应器中进行,经8min后反应物转化了80%,经过18min后转化了90%,求表达此反应的动力学方程。
解dnrAAVdt积分后:tcA0dcArACcA0dcAcAcAn111n1n1AkcAkn1cA0cAt8min某A180%t18min某A290%28111kn1cn1cn1n1A0A01某A11811kn1cn11n1n1A0cA01某A2n2r2AkcA2-6某一气相一级反应A2RS,在恒温、恒压的实验反应器中进行,原料含75%A及25%惰性气体(摩尔比),经8min后其体积增加一倍。
求此时的转化率及该反应在此温度下的速率常数。


化学反应⼯程⼆,三章答案第⼆章习题1.动⼒学⽅程的实验测定时,有采⽤循环反应器的,为什么?答:循环反应器⾏为与全混流反应器相同,可以得到反应速率的点数据,⽽且反应器进出⼝浓度差⽐较⼤,对分析精度要求不很⾼。
2.为什么可逆吸热反应宜选平推流反应器且在⾼温下操作,⽽可逆放热反应却不是?根据可逆放热反应的特点,试问选⽤何种类型反应器适宜?为什么?答:可逆吸热反应的反应速率与化学平衡都随温度的升⾼⽽升⾼,⾼温下操作对⼆者都有利。
可逆放热反应的化学平衡随温度的升⾼向反应物⽅向移动,对达到⾼转化率不利。
对此类反应,可选⽤多段绝热反应器或换热条件较好的管式反应器。
3.⼀级反应A→P,在⼀体积为V P的平推流反应器中进⾏,已知进料温度为150℃,活化能为84kJ·mol-1,如改⽤全混流反应器,其所需体积设为V m,则V m/V p应有何关系?当转化率为0.6时,如果使V m=V p,反应温度应如何变化?如反应级数分别为n=2,1/2,?1时,全混流反应器的体积将怎样改变?解:)1ln()1()exp()1ln()1()1(CSTR )1ln(11d 1)(d PFR )exp()(A A Ap mA A A pm A 0A AA0m A A00AA A00A A A0P A 0A A AAx x x RT ERT E x x k kx V V x k c x F V x kc x x kE k kc r x x ----=---=-=--=-=-=-==-?)1ln()1()1ln()1( IF A A A A A P m m p x x x x x k k x V V T T A---=---==()()K07.43215.42302064.015.423876.234929.015.423876.23exp 6109.0637.115.42315.423314.884000 exp 1)6.01ln(6.016.0exp 10.6and 1IF m m mmmmm m m P m P A Pm =-=--=--=-=-- --===T T T T T T T TT T T T T R E x V V mnn n n kc x F V c V V cAf A0m 1Am1m 2A1m 1m 1AAA0m 2/1A 1m 2/1m 2/1A A A0m A1m 2m 2A A 0A m 1,1,2/11,2====-=======---或4. 在体积V R =0.12m 3的全混流反应器中,进⾏反应S R B A 21+??←?→?+kk,式中k 1=7m 3kmol -1min -1,k 2=3m 3kmol -1min -1,两种物料以等体积加⼊反应器中,⼀种含2.8kmolA ·m -3,另⼀种含1.6kmolA ·m -3。


第二章 均相反应动力学基础均相反应 均相反应是指参予反应的各物质均处同一个相内进行化学反应。
在一个相中的反应物料是以分子尺度混合的,要求:①必须是均相体系 (微观条件) ②强烈的混合手段 (宏观条件) ③反应速率远小于分子扩散速度一、计量方程反应物计量系数为负,生成物计量系数为正。
计量方程表示物质量之间关系,与实际反应历程无关; 计量系数只有一个公因子;用一个计量方程表示物质量之间关系的体系称为单一反应,反之称为复合反应。
二、化学反应速率单位时间、单位反应容积内组分的物质的量(摩尔数)的变化称之为该组分的反应速率。
反应物:生成物:对于反应三、化学反应速率方程r 是反应物系的组成、温度和压力的函数。
32223NH H N =+032223=--N H NH A A Adn r Vd d t C dt=-=-R R Rdn r Vdt dC dt==A B S R A B S Rαααα+=+SABRABSRr r r r αααα===AA AB r [k (T)][f(C ,C ,)]=有两类;双曲函数型和幂函数型。
k -化学反应速率常数; a(b)-反应级数。
(1)反应级数(i) 反应级数与反应机理无直接的关系,也不等于各组份的计量系数; (ii) 反应级数表明反应速率对各组分浓度的敏感程度;(iii) 反应级数是由实验获得的经验值,只能在获得其值的实验条件范围内加以应用。
(2)反应速率常数k[k]: s -1·(mol/m 3)1-nE :是活化能,把反应分子“激发”到可进行反应的“活化状态”时所需的能量。
E 愈大,通常所需的反应温度亦愈高,反应速率对温度就愈敏感。
k 0 —指前因子,其单位与 反应速率常数相同;E— 化学反应的活化能,J/mol ; R — 气体常数,8.314J/(mol .K)。
a b A A B r kC C=2220.512H Br HBrHBrBr k c c r c k c =+0exp[]E k k RT=-01ln ln E k k R T=-⨯ln klnk 0 slop=-E/R1/T⏹ 反应速率的温度函数关系● 活化能越高,斜率越大,该反应对温度越敏感; ● 对于一定反应,低温时反应速率对温度变化更敏感。



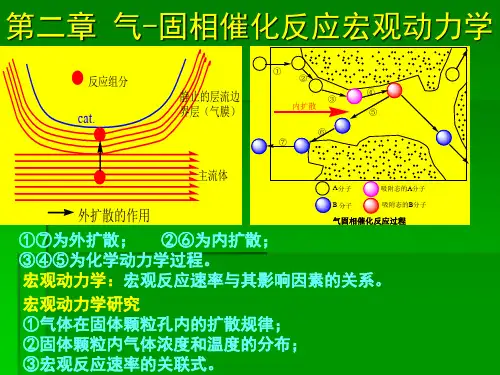
化学反应工程第二章第二章 气-固相催化反应宏观动力学 概述在化工生产中,有许多重要的反应都是气-固相催化反应。
42223323322222233332322CH H O CO H CH OH +0.5O HCHO+H OCO H CH OHCH CHCH NH O CH CHCN H ON H NH +++=++=++从上述反应可以得出气-固相催化反应的特点。
1. 反应特点2. 1)反应物和产物均为气体;3. 2)使用固体催化剂,具有惊人的内表面;4. 3)反应区在催化剂颗粒内表面。
5. 反应步骤反应区在颗粒内部,整个反应过程是由物理过程和化学反应过程组成的,反应分5步进行。
1)反应物从气相主体扩散到颗粒外表面——外扩散;2)反应物从颗粒外表面扩散进入颗粒内部的微孔道——内扩散; 3)反应物在孔道的内表面进行化学反应,反应分三步串联而成: 反应物在活性位上被吸附; 活性吸附态组分进行化学反应; 吸附态产物的脱附4)反应产物从内表面上扩散到颗粒外表面; 5)反应产物从颗粒外表面扩散到气相主体。
第1、5步称为外扩散过程,第2、4步称为内扩散过程,第3步称为本征动力学过程。
在颗粒内表面上发生的内扩散和本征动力学是同时进行的,相互交织在一起,因此称为扩散-反应过程。
6.宏观动力学气-固相催化反应速率,是反应物和反应产物在气相主体、固体颗粒外表面和内表面上进行物理过程和化学过程速率的“总和”,称之为总体速率。
气-固相催化反应动力学包含了物理过程和化学反应过程,称之为宏观动力学,其速率称为总体速率。
7.本章主要内容8.讨论气-固相催化反应宏观动力学的基本理论,主要内容有以下几方面。
9.1)催化剂颗粒内气体的扩散;10.2)催化剂颗粒内扩散-反应过程的关联方法——内扩散有效因子;11.3)宏观动力学方程,或称之为总体速率方程的建立。
第一节气-固相催化反应的宏观过程2-1 气-固相催化反应过程中反应组分的浓度分布设某反应的关键组分为A;催化剂为球形,关径R p;颗粒内活性组分均匀分布;颗粒外表面有滞流边界层;A在气相主体、颗粒外表面、内表面的浓度分别为C Ag 、C As、C Ac;平衡浓度为C A*。
1.外扩散过程2.扩散推动力:C Ag -C As3.C A 是直线分布4.扩散-反应过程5.C A为内扩散过程和反应过程的表观浓度,是一条曲线。
在以后的学习过程中会得到证明。
2-2 内扩散有效因子与总体速率1.内扩散有效因子ζ2.在催化剂颗粒内部,反应物的内扩散过程和化学反应过程同时进行,扩散-反应过程的表观结果是使A的浓度下降,A的浓度分布见图2-13.当为等温过程,即整个颗粒上温度是均匀的,颗粒外表面的浓度比颗粒内部任一点的都要大,所以按颗粒外表面浓度计算的反应速率最大,越到颗粒内部越小。
4.ζ的定义:单颗粒催化剂上实际反应速率和按颗粒外表面浓度C As计算的理论反应速率之比值,称之为内扩散有效因子,或内表面利用率,记作ζ。
5.()ζ=()is ASs As ik f C dsk f C S式中,k s 为按单位内表面积计算的催化反应速率常数;f( )为动力学方程中的浓度函数,C A 随径向距离而变化;S i 为单位体积催化床中催化剂的内表面积。
上式中,分子项是催化剂颗粒内各活性点的反应速率的总和,由于不可能建立f(C A )与S 之间的函数关系,分子项是无法解析计算的。
在稳定状态下,反应物由颗粒外表面扩散进入颗粒内部的速率等于反应物在整个颗粒内部的反应速率,因此,ζ可以改写为ζ= 按反应组分外表面浓度梯度计算的反应速率按反应组分外表面浓度计算的反应速率6. 总体速率通式7. 在稳定状态下,反应组分A 从气相主体扩散通过滞流边界层到达颗粒外表面的速率和整个催化剂颗粒的实际反应速率相等,即总体速率的通式如下: 8. g ()= ()ζ=()A s As i G e Ag As r k f C S k S C C式中:g ()A r 为总体速率;G k 为外扩散传质系数;e S 为单位床层体积颗粒的外表面积。
上式又称为气-固相催化反应宏观动力学方程通式。
9. 一级可逆反应的总体速率方程10. 颗粒的本征动力学方程若为一级可逆反应,则有下式:g ()() ()=()= ζA AA s A s AA G e Ag As s As i f C C r k f C k C r k S C C k C S ===-****g () ()()()=()= ()ζA A A A A s A s A A A G e Ag As s As A i f C C C C r k f C k C C r k S C C k C C S =-==---——平衡浓度于是得到: *g ()= 11ζAg AA G e s i C C r k S k S -+上式的物理含义为:g ()="A r +过程的总推动力外扩散阻的力内扩散-反应"的阻力如何求出ζ,这是本章学习之重点。
当颗粒的本征动力学方程为一级不可逆反应时,则有下式g ()() ()=()= ζA AA s A s AA G e Ag As s As i f C C r k f C k C r k S C C k C S ===-于是:g ()=11ζAgA G e s i C r k S k S +2-3 催化反应控制阶段的判别 一、判别条件及其速率简化式以一级可逆反应为例,讨论控制阶段的判别条件及其总体速率的简化式。
对于一级可逆反应,其总体速率方程为:*g ()= 11ζAg AA G e s i C C r k S k S -+对应的各项所代表的物理含义为:g ()="A r +过程的总推动力外扩散阻的力内扩散+化学反应"的阻力总体速率方程包含有外扩散阻力、内扩散和化学反应的阻力,这三部份阻力客观存在,但它们之间的相对大小可能是不相上下,也可能是差别很大。
如果它们的相对大小不相上下,则不能忽略各部分阻力。
如果它们的相对差别很大,则就可以忽略某一部分阻力,简化速率方程。
1. 本征动力学控制 2. 1)判别条件 3.111ζ1ζG es i G ek S k S k S →且,略去项 4. 2)速率方程5. *g ()= ()A s Ag A i r k C C S -6. 3)浓度分布7. *Ag As AcAC C C C ≈≈ 8. 内扩散强烈影响 9. 1)判别条件 10.111ζ1ζG es i G ek S k S k S 且,略去项 11. 2)速率方程 12. g ()= ()ζA s As i r k f C S 13. 3)浓度分布 14. *Ag As Ac AC C C C ≈≈15. 外扩散控制 16. 1)判别条件 17.111ζ1ζζG es i s i k S k S k S →且,略去项 18. 2)速率方程19. *g ()= ()A G e Ag A r k S C C -20. 3)浓度分布 21. *Ag As Ac AC C C C ≈≈二、不可逆反应外扩散控制 1.二级不可逆反应若本征动力学方程为二级不可逆反应,则有:22g () ()=()= ζ1(2ζA s A s AA G e Ag As s As i As G e G e s i r k f C k C r k S C C k C S C k S k S k S ==-⎡⎤=-⎣⎦知:所以:g 4()12ζG e A G e Ag s i k S r k S C k S ⎡⎤⎛⎢⎥ ⎢⎥⎝⎣⎦=--1+ 2.n 级不可逆反应若为外扩散控制,则C As =0,则有:g ()=()= A G e Ag As G e Ag r k S C C k S C -当为外扩散控制时,到达颗粒外表面的反应组分在“一瞬间”就全部反应掉,g ()A Ag r C 与成线性关系。
第二节催化剂颗粒内气体的扩散概述气-固相催化反应中的固体催化剂是多孔性的,内部具有许多微孔,孔壁就是反应面。
反应物只有进入颗粒内部才能起反应。
本节研究气体在颗粒内的扩散过程,这是气-固相催化反应宏观动力学的主要内容之一。
颗粒外表面和颗粒内部具有压力差,但由于颗粒较小(一般为d =3~5mm),压力差忽略不计。
在没有压力差的情况下气体进入颗粒内部的传质方式是分子热运动,分子热运动的就是分子扩散。
分子扩散是气体进入颗粒内部的传质方式。
分子扩散的阻力主要来自两方面:1)分子与分子之间的碰撞,使分子改变运动方向;2)分子与孔壁间的碰撞,孔壁是刚性的,更易改变分子的运动方向。
这两种碰撞不断改变分子运动的方向,使分子停不前,这就是分子扩散的阻力。
在颗粒内部存在着扩散阻力,使得越到颗粒中心处,分子数目就越少,反映在浓度上,该组分的浓度就越小。
如果没有扩散阻力,颗粒外表面处和颗粒内部的分子数是相同的,反映在浓度上,C As=C Ac,所以内扩散过程降低了反应物在颗粒内部的反应浓度,使得颗粒内表面没有得到充分的利用,限制了反应的进行,因此,ζ称之为内表面利用率更能说明其含义。
2-4 催化剂中气体扩散的形式目前普遍认为,固体催化剂中气体的扩散形式有:分子扩散、努森扩散、构型扩散和表面扩散。
1.分子扩散设有一单直圆孔,孔半径为2r a。
分子运动的平均自由行程为λ。
当λ/2r a≤10-2时,分子间的碰撞机率大于分子和孔壁的碰撞机率,扩散阻力主要来自分子间的碰撞,这种扩散称之为分子扩散。
分子扩散与孔径无关。
|2.努森扩散当λ/2r a≥10时,分子和孔壁的碰撞机率大于分子间的碰撞机率,扩散阻力主要来自分子和孔壁间的碰撞,这种扩散称之为努森扩散。
分子扩散与孔径有关。
|3.构型扩散当催化剂的孔半径和分子大小的数量级相同时,分子在徽孔中的扩散系数将与分子构型有关,称之为构型扩散。
一般工业催化剂的孔径较大,可以不考虑构型扩散。
4.表面扩散处于研究之中,对于高温下的气-固相催化反应,可不考虑表面扩散。
2-5 分子扩散系数(气体中的分子扩散)一.双组分气体混合物中的分子扩散系数二.设有A、B两组分气体混合物,无流动,作一维扩散。
则A在x方向的扩散通量为:J J A AB A A AB T AD C D C y =-=-或grad grad式中,D AB 为A 在A 、B 混合物中的分子扩散系数;C T 为总浓度; 可以通过①查文献②实验测定③经验公式等途径获得()()1.750.5221/31/3110.001()/A BAB A B T M M D cm s p V V +=⎡⎤+⎢⎥⎣⎦∑∑三. 多组分气体混合物中的分子扩散系数 考虑一维扩散,n 个组分。