基因工程载体
- 格式:doc
- 大小:26.50 KB
- 文档页数:4








第三章基因工程载体体外获得的任一DNA片段,必须插入到可以自我复制的载体内,再转入宿主细胞,才能得到复制和进行表达。
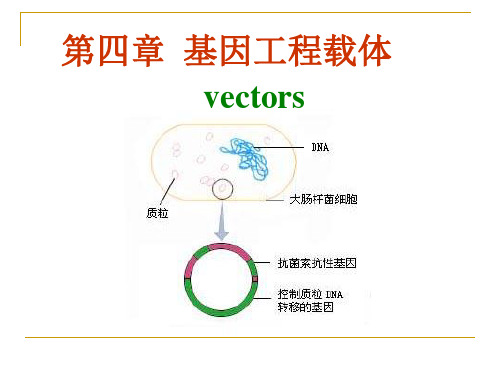
基因工程载体(Vectors)就是携带外源基因进入受体细胞进行繁殖和表达的一种工具。
载体的功能运送外源基因高效转入受体细胞为外源基因提供复制能力或整合能力为外源基因的扩增或表达提供必要的条件基因工程中3种主要类型的载体:1.质粒载体2.噬菌体载体3.柯斯质粒(cosmid)载体基因工程对载体的要求(1)在宿主细胞内能独立复制。
(2)有选择性标记。
(3)有一段多克隆位点。
外源DNA插入其中不影响载体的复制。
(4)分子量小,拷贝数多。
(5)容易从宿主细胞中分离纯化。
第一节质粒(plasmid)载体质粒是一种独立于染色体外的双链闭环的DNA分子,具有自主复制和转录能力,能在子代细胞中保持恒定的拷贝数,并表达所携带的遗传信息。
质粒的复制和转录要依赖于宿主细胞编码的某些酶和蛋白质,如离开宿主细胞则不能存活,而宿主即使没有它们也可以正常存活。
(一)质粒的构形环形双链的质粒DNA在提取过程中通常出现三种不同的构型:①共价闭合环形DNA(cccDNA)②开环DNA(open circular,ocDNA)③线形DNA(linear,lDNA)(二)质粒的转移性指质粒从一个细胞转移到另一个细胞的特性。
接合型质粒:除了带有自我复制所必需的遗传信息外,还带有一套控制细菌配对和质粒接合转移的基因。
如:F质粒(性质粒或F因子)甚至能使寄主染色体上的基因随其一道转移到原先不存在该质粒的受体菌中。
不符合基因工程的安全要求。
非接合型质粒:带有自我复制所必需的遗传信息,但失去了控制细菌配对和质粒接合转移的基因,因而不能从一个细胞转移到另一个细胞。
如R质粒(抗性质粒)、Col质粒(细菌素质粒)。
符合基因工程的安全要求。
R质粒:带有一种或数种抗生素抗性基因,使寄主获得同样的抗生素抗性性状(resistance)。
Col质粒:细菌素通过与敏感细菌细胞壁的结合作用,抑制一种或数种细胞生命过程。

基因工程常用的三种载体载体是基因工程中常用的一种工具,用于将外源基因导入宿主细胞中并进行表达。
常见的载体有质粒、病毒和人工染色体。
本文将分别介绍这三种载体的特点、用途和优缺点。
1. 质粒:质粒是圆形、双链DNA分子,广泛应用于基因工程中。
质粒的构建相对简单,可以通过DNA重组技术来插入外源DNA 片段。
质粒通常包含由宿主细胞识别的来源于细菌或酵母的起源序列,以实现在细胞中的复制和维持。
此外,质粒上还包含选择性标记基因和表达调控元件,以便筛选和调控目标基因的表达。
质粒在基因工程中有着广泛的应用。
首先,质粒载体可以在大肠杆菌等常见细菌中表达外源基因,用于重组蛋白的产生和纯化,或进行功能研究。
此外,质粒也可以构建用于植物和动物细胞的转染,用于基因转导和基因治疗等领域的研究。
质粒的优点在于构建简单,易于操作,并且可以在多种细胞中进行表达。
然而,质粒的转染效率较低,不适合大规模基因转导。
此外,在某些细胞中,质粒的稳定性较差,易丧失外源基因。
2. 病毒:病毒是一类依赖于细胞代谢活动的生物体,可以将外源基因导入宿主细胞并进行复制和表达。
常见的基因工程病毒载体包括腺病毒、逆转录病毒和腱实病毒等。
病毒载体的主要特点是高效的基因转导能力和细胞特异性。
由于病毒依赖于细胞进行复制和表达,因此病毒载体能够实现高效转导和表达目标基因。
此外,病毒载体还可以通过选择性修饰病毒表面蛋白来实现对特定细胞的特异性转染,进一步提高基因转导效率。
病毒载体被广泛应用于基因治疗和基因敲除等研究领域。
在基因治疗中,病毒载体能够将替代基因导入患者细胞中,以治疗某些遗传性疾病。
在基因敲除中,病毒载体则可以导入携带某种特殊序列的DNA片段,进而敲除靶基因。
然而,病毒载体也存在一些限制。
首先,病毒复制过程中可能引起细胞毒性反应,对细胞造成伤害。
其次,病毒载体的构建和生产相对复杂,需要严格的无菌操作和关键的质控步骤。
3. 人工染色体:人工染色体是一种合成的染色体模拟体,可用于将大片段基因组DNA导入宿主细胞中。


基因工程课程论文:基因工程载体的探索学号:A09120248姓名:金文杰班级:生技1203任课教师:任桂萍基因工程载体的探索摘要基因工程是要按人们的意愿去有目的地改造,创建生物遗传性,因此其最基本的工程就是要得到目的基因或核酸序列的克隆。
基因工程载体是基因工程所必需的工具,是能将分离或合成的基因导入细胞的DNA分子,有质粒DNA、病毒DNA、λ噬菌体的衍生物三种主要类型。
植物、动物、微生物所用的质粒可能不同,在不同条件下所需的质粒也不同,所选用的质粒按需要选用。
在基因操作过程中使用载体有两个用途:一是用它作为运载工具,将目的基因转移到宿主细胞中去;二是利用它在宿主细胞内对目的基因进行大量的复制。
较常见的几种载体有:质粒pUC19、M13、科斯载体等。
关键词:载体、质粒、λ噬菌体、病毒DNA一、理想载体要求:对理想的基因工程载体一般至少有以下几点要求;能在宿主细胞中复制繁殖,而且最好要有较高的自主复制能力;容易进入宿主细胞,而且进入效率越高越好;容易插入外来核酸片段,插入后不影响其进入宿主细胞和在细胞中的复制,这就要求载体DNA上要有合适的限制性核酸内切酶位点,且每种酶的切位点最好只有一个;容易从宿主细胞中分离纯化出来,这才便于重组操作;有容易被识别筛选的标志,当其进入宿主细胞、或携带着外来的核酸序列进入宿主细胞都能容易被辨认和分离出来。
这才介于克隆操作。
二、常见质粒1、质粒pUC19最常用的大肠杆菌克隆用质粒pUC19,此质粒的复制起点处序列经过改造,能高频率起动质粒复制,使一个细菌pUC19的拷贝数可达500-700个;质粒携带一个抗氨芐青霉素基因,编码能水解β-内酰胺环,从而被坏氨芐青霉素的酶,当用pUC19转化细菌后放入含氨芐青霉素的培养基中,凡不含pUC19者都不能生长,结果长出的细菌就是都含有pUC19的;pUC19还携带细菌lac操纵元中的lacI和lacZ基因编码,β-半乳糖苷酶N端状146个氨基酸的段落,当培养基中含有诱导物IPTG(isopropyl-thiogalactoside异丙基-硫代半乳糖苷)和Xgal(5-bromo-4- chloro-3-indolyl-β-D-galactopyranoside)时,lacZ ' 基因被诱导表达产生的β-半乳糖苷酶N端肽与宿主菌表达的C端肽互补而具有β-半乳糖苷酶活性(质粒和宿主编码的肽段各自都没有酶活性,两都融为一体而具酶活性,称为α-互补,α-complementation),半乳糖苷酶水解Xgal而使菌落呈现蓝色;在lacZ '中间又插入了一段人工设计合成的DNA序列,其中密集多个常用的限制性核酸内切酶的位点,使外来的基因和序列能很方便地被插入此位置,当外来序列插入后则破坏了lacZ '编码的半乳糖苷酶活性,生长的菌落就呈白色,这种颜色标志的变化就很容易区分和挑选含有和不含有插入序列或基因的转化菌落,称为蓝白筛选法。
根据用途可以对质粒进行改造,例如:根据鼠李糖乳杆菌D- ldhD-乳酸脱氢酶基因序列, 设计扩增同源臂 D1和 D2的引物,扩增同源臂D1的引物为 Lr-d1-H和 Lr-d1-X,扩增同源臂 D2的引物为Lr-d2-E和Lr-d2-A。
分析载体pU C19-CM和D-ldh基因的序列,分别在引物Lr-d1-H和Lr-d1-X的5’端添加H ind 和Xho酶切位点;在引物 Lr-d2-E和Lr-d2-A 的5端添加 EcoR和Apa酶切位点。
利用这2对引物扩增得到的同源臂分别插入到载体pUC19-CMHind和Xho酶切位点、EcoR和Apa酶切位点中,得到自杀质粒 pUC19-CM-D测序确定序列插入的正确性利用引物 Pkd3-cm-1和 Pkd3-cm-2从质粒pKD3上扩增到氯霉素抗性基因CM, 大小为1200bp。
质粒 pUC19和基因CM分别经Pst和Sac内切酶处理后连接, 转入大肠杆菌 JM 109中,PCR酶切鉴定及测序结果表明基因 CM 正确插入到质粒 pU C19中, 载体 pU C19-CM 构建成功。
由同源臂 D1引物 Lr-d1-H和Lr- d1-X扩增长约为180bp左右的基因片段,由同源臂 D2的引物Lr-d2-E和L r-d2-A 扩增出了约237 bp的基因片段。
将2个同源臂片段和 pUC19-CM 载体经酶切处理连接后, 转化至大肠杆菌 JM 109中,PCR酶切鉴定及测序结果表2个同源臂正确插入载体 pUC19-CM的氯霉素基因的两端,自杀质粒pUC19-CM-D构建成功。
自杀质粒的应用是构建基因缺失工程菌的重要手段之一。
自杀质粒的复制需要一种特殊蛋白,大多数细菌不产生这种蛋白质。
因此,当进入寄主细胞时;要么不能复制,被消除;要么被整合入染色体上,和染色体一起复制。
利用自杀质粒的这个特点,该研究中将2个同源臂片断D1 和D2,克隆入自杀载体pUC19-CM 中, 利用缺失基因两端的同源片断,定位自杀质粒的整合位点。
利用同源性 DNA片断可发生重组的原理, 构建精确基因缺失菌株。
在多数情况下, 利用自杀质粒可随心所欲缺失大多数基因的任何部分。
2、M13噬菌体它是一种丝状噬菌体,内有一个环状单链DNA分子,长6407个核苷酸,含DNA复制和噬菌体增殖所需的遗传信息。
M13DNA的复制起始位点定位在基因间隔区内。
但是基因间隔区的有些核苷酸序列即使发生突变、缺失或插入外源DNA片段,也不会影响M13DNA 的复制,这为M13DNA构建克隆载体提供了条件。
M13 噬菌体的生物学 M13 噬菌体颗粒是丝状的,只感染F+(含F质粒,能产生性菌毛)的大肠杆菌。
感染宿主后通常不裂解宿主细胞,而是从感染的细胞中分泌出噬菌体颗粒,宿主细胞仍能继续生长和分裂。
但生长水平比未感染组低。
M13 噬菌体的基因组为单链 DNA (+DNA),由 6407 的碱基组成。
基因组 90% 以上的序列可编码蛋白质,共有 11 个编码基因,基因之间的间隔区多为几个碱基。
较大的间隔位于基因Ⅷ和基因Ⅲ以及基因Ⅱ和基因Ⅳ之间,其间有调节基因表达和 DNA 合成的元件。
M13 噬菌体基因组可编码 3 类蛋白质,包括复制蛋白(基因Ⅱ,Ⅴ和Ⅹ),形态发生蛋白(基因Ⅰ,Ⅳ和Ⅺ),结构蛋白(基因Ⅲ、Ⅵ、Ⅶ、Ⅷ和Ⅸ)。
所有结构蛋白在形态发生之前都插入在宿主细胞的质膜中。
基因组 DNA 为正链,按基因Ⅱ至基因Ⅳ方向合成,与噬菌体的 mRNA 序列同义。
在宿主细胞内,感染性的单链噬菌体 DNA (正链)在宿主酶的作用下转变成环状双链 DNA ,用于 DNA 的复制,因此这种双链 DNA 称为复制型 DNA (replicative form DNA),即RF DNA。
通过θ复制方式,RF DNA 进行扩增,基因的转录也随即开始。
基因组中的任意一个启动子都可以启动基因的转录,单方向地终止于下游的终止子。
启动子和终止子的位置关系使得靠近终止子的基因转录更频繁。
当基因Ⅱ蛋白在亲代RF DNA的正链特定位点上产生一个切口时,便启动噬菌体基因组进行滚环复制。
此时,在大肠杆菌的 DNA聚合酶Ⅰ的作用下,以负链为模板在切口的 3'末端加入核苷酸,并持续 DNA 的合成,用新合成的 DNA 替换原有的正链。
当复制叉环绕模板整整一周时,被取代的正链由基因Ⅱ产物切去,经环化后形成单位长度的噬菌体基因组DNA 。
在感染开始的 15~20 分钟内,这些子代正链在宿主细胞酶的作用下,又转变成RF DNA,然后以之为模板继续转录并继续合成子代正链 DNA 。
当感染细胞内累计有 100-200个RF DNA 时,细胞内也产生了足够的单链 DNA 结合蛋白,即基因Ⅴ蛋白。
该蛋白可以抑制翻译活性,特别是抑制基因Ⅱ mRNA 的翻译,并且强烈地结合在新合成的正链 DNA 上,阻止其转化成 RF DNA。
此时,DNA 的合成几乎只产生子代正链 DNA 。
另外,基因Ⅹ蛋白和基因Ⅴ蛋白也是噬菌体特异 DNA 合成的强力抑制子,从而限制感染细胞内 RF DNA 的数量。
结果,感染细胞内 RF DNA 的数目和子代正链 DNA 的产生速率都能保持适度。
其中M13mp系列对野生型M13加以改造,插入了多克隆位点和LacZ基因,可容纳外源DNA300-400bp,可用于制备DNA测序时用的单链模板和核酸探针。
3、科斯载体美国的Colins等人研制了一种称为科斯质粒(cosmid) 的新型基因载体,它是带有噬菌体 cos 位点的质粒。
噬菌体的环DNA 易于自发地在某一个特定的位点断裂,成为线状分子。
断裂的两端由于存在互补的核普酸,即成粘性末端。
噬菌体的线状DN A 也容易自发地通过粘性末端而重新连接成环状分子。
这个粘性末端,就称为cos 位点。
cos位点还有一个重要的作用,就是能识别噬菌体的外壳蛋白质。
凡具有cos位点的任何DNA分子,只要在长度上符合一定要求,就可以与人外壳蛋白质结合而被包装成类似噬菌体的颗粒。
Colins等人即研制了带有 cos位点的质粒,它作为基因载体,兼有细菌质粒和噬菌体的优点。
一方面可以插入大片段的外源DNA (约4一6万个碱基对),因而有利于研究真核生物的基因(真核基因DNA分子较大;)另一方面,又能像噬菌体那样进行体外包装,并感染大肠杆菌,形成克隆,以制成基因文库(Genelibrary )。
科斯质粒本身的长度约为5一6千个碱基对,能嵌人的外源D NA 近于它本身长度的 10倍。
cos 位点的大小是400个碱基对左右。
应用各种质粒不同长度的片段,接上cos 位点,可制成各种不同长度的科斯质粒,以接受各种不同长度的外源 DNA。
由于又噬菌体蛋白质外壳能包装的DNA长度是一定的,故科斯质粒可接受的外源 DNA长度等于又噬菌体DNA 长度减去科斯质粒本身的长度。
这样, 选用和研制一种特定长度的科斯质粒,就可以接受特定长度的外源 DNA,然后体外包装又噬菌体的蛋白质外壳。
这就很容易根据 DNA 分子的长度来纯化作为目的基因的外源DNA。
4、动物病毒载体质粒和噬菌体载体只能在细菌中繁殖,不能满足真核DNA重组需要。
感染动物的病毒可改造用作动物细胞的载体。
由于动物细胞的培养和操作较复杂、花费也较多,因而病毒载体构建时一般都把细菌质粒复制起始序列放置其中。
使载体及其携带的外来序列能方便地在细菌中繁殖和克隆,然后再引入真核细胞。
目前病毒载体常用者有改造来自猴肾病毒SV40(Simian Virus 40)、逆转录病毒和昆虫杆状病毒等,使用这些病毒载体的目的多为将目的基因或序列放入动物细胞中表达或试验其功能、或作基因治疗等。
发展前景现在,对于原核生物特别是大肠杆菌以及植物基因工程载体的研究已经相当深入,已有多种具有优良特性的载体可用于基因工程。