分析方法验证-实例部分
- 格式:pdf
- 大小:391.35 KB
- 文档页数:50

《化学分析方法验证、确认指南汇编及实例分析》读书随笔目录一、内容描述 (2)二、化学分析方法验证的基本概念与重要性 (3)三、验证前的准备工作 (4)1. 明确验证目的和范围 (5)2. 选择合适的验证方法和技术 (6)3. 建立验证团队和制定工作计划 (7)四、化学分析方法验证的实施 (8)1. 验证试验设计的制定 (10)2. 双重检查的制定与实施 (11)3. 结果评价与偏差分析 (12)4. 纵向和横向的比较 (14)五、化学分析方法确认的具体步骤 (15)1. 确认试验方案的确定 (16)2. 选择性、准确性和精密度的测试 (18)3. 仪器校准与方法的重现性评估 (19)4. 系统适用性测试 (20)六、案例分析 (22)1. 氯化钠中痕量钾的测定 (23)2. 水中硫酸根离子的测定 (24)七、总结与展望 (26)一、内容描述本书首先介绍了化学分析方法验证和确认的基本概念、目的和意义。
阐述了在化学分析过程中,为何需要进行方法的验证和确认,以及它们对于保证分析结果的准确性和可靠性的重要性。
详细阐述了化学分析方法验证和确认的基本流程,包括方法的选择、实验设计、实验操作、数据收集与分析等方面。
这些内容为后续的实践操作和实例分析提供了理论支持和方法指导。
本书汇编了多种化学分析方法的验证和确认指南,这些指南涵盖了从传统的化学分析到现代仪器分析的各种方法,如滴定法、分光光度法、色谱法、质谱法等。
每一种方法的验证和确认指南都详细介绍了具体的操作步骤、注意事项以及可能遇到的问题和解决方案。
这些内容为读者提供了实用的操作指南,使读者能够根据实际需求选择和应用不同的化学分析方法。
本书还通过实例分析的方式,展示了化学分析方法验证和确认的实际应用。
这些实例涉及了不同的领域,如环境监测、食品安全、药品检测等。
通过对这些实例的分析,读者可以更加深入地了解化学分析方法验证和确认的实际操作过程,以及如何解决实际应用中可能遇到的问题。

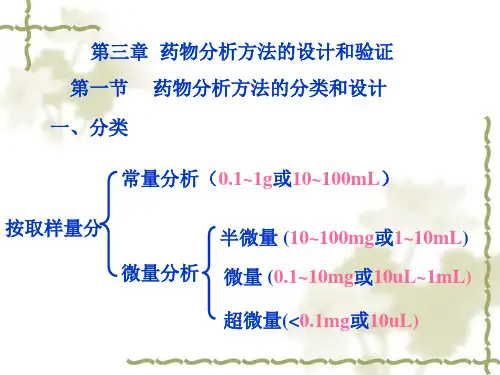
分析方法验证的内容
在进行数据分析时,验证分析方法的准确性和有效性是至关重要的。
只有通过验证,我们才能确保我们所采用的分析方法能够正确地解释数据,并且能够得出可靠的结论。
本文将介绍分析方法验证的相关内容,包括验证的重要性、常用的验证方法以及验证过程中需要注意的问题。
首先,让我们来看看验证分析方法的重要性。
验证分析方法的目的是确保所使用的方法能够准确地反映数据的特征和规律。
如果我们在分析数据时采用了错误的方法,那么得出的结论就会是错误的,这将对决策和预测产生严重的影响。
因此,验证分析方法是确保我们能够做出准确决策的重要步骤。
接下来,我们将介绍一些常用的验证方法。
首先是交叉验证方法,这是一种常用的验证方法,它将数据集划分为训练集和测试集,然后使用训练集来训练模型,再使用测试集来验证模型的准确性。
此外,还有留出法验证、自举法验证等方法,它们都是常用的验证方法,可以帮助我们验证分析方法的准确性和有效性。
在进行验证过程中,我们需要注意一些问题。
首先是样本的选择,样本的选择应该具有代表性,能够充分反映整体的特征。
其次是验证指标的选择,验证指标应该能够准确地评估分析方法的准确性和有效性。
最后是验证结果的解释,验证结果应该能够清晰地反映分析方法的优劣,帮助我们做出正确的决策。
综上所述,验证分析方法的重要性不言而喻,只有通过验证,我们才能确保我们所采用的分析方法是准确的、有效的。
在验证过程中,我们需要选择合适的验证方法,注意样本的选择和验证指标的选择,确保验证结果能够准确地反映分析方法的准确性和有效性。
希望本文能够帮助大家更好地理解分析方法验证的相关内容。

真实案例解析分析⽅法的验证、转移和确认摘要: 分析⽅法验证、转移和确认的⽬的是证明分析⽅法的适⽤性,对保证检测结果的⼀致性、可靠性和准确性具有重要作⽤。
⽅法验证、转移和确认的概念不同,适⽤范围不同,在实际⼯作中存在⼀些模糊概念,⽽分析⽅法验证、转移和确认的⽬的是证明所采⽤的分析⽅法适合于相应检测要求和⽬的,被测样品质量可控,保证得到⼀致、可靠和准确的测定结果,同时也证明检验⼈员有能⼒操作分析⽅法。
⽅法学验证1、⽅法验证、转移和确认相关指导原则法规⽬前国内外和分析⽅法学有关的指导原则和技术⽂件中,⼤部分都是阐述分析⽅法验证的内容,很少有专门阐述分析⽅法转移和确认的⽂件。
美国、欧盟、⽇本、澳⼤利亚、中国等国家和地区的药品监管机构以及化组织( InternationalOrganization forStandardization, ISO) 等国际组织都有专门的关于⽅法学验证的指导原则。
其中美国⾷品药品监督管理局( U.S.Food and DrugAdministration,FDA) 在2000 年和2001布了“⽣物分析⽅法验证指南( guideline onbioanalytical method validation) ”,2012年2 ⽉1 ⽇⽣效,⽤于药代动⼒学和毒代动⼒学研究中⽣物样品定量测定的分析⽅法验证。
ICH 在1995 年和1996 年分别发布了Q2A“分析步骤验证-定义和术语”和Q2B“分析步骤验证-⽅法学”; ISO 17025 于2005 年发布的“检测和校准实验室通⽤要求”第“5.4. 5”章节中对分析⽅法验证提出了⾮常具体的规定和关于⽅法学确认, ISO 17025: 2005 通篇只在“5.4.2”中有⼀⼩段描述: “……在进⾏检测或校准之前,实验室应确认能够正确操作这些标准⽅法。
如果标准⽅法发⽣了变化,应重新进⾏确认”。
最早发布相应技术⽂件专门企业⽽制定的,规定制药企业在制定药品分析⽅法时需要验证哪些参数,⽤于向药品监管机构证明该⽅法可⾏,产品质量可控。


实例分析方法在研究和学术领域中,实例分析方法是一种常用的研究方法,它通过对具体的案例进行观察、分析和解释,以揭示普遍的规律和原则。
实例分析方法在理解和解决实际问题、推动学术研究和学科发展方面具有重要作用。
本文将介绍实例分析方法的基本概念、步骤和优势,并通过具体案例展示其应用。
一、实例分析方法的基本概念实例分析方法,又称为案例研究方法,是一种基于实例的研究方法,通过深入观察和分析个别案例,以获取对整体情况的深入认识。
实例可以是个人、组织、事件或社会现象等,研究者通过对实例的详细观察和细致分析,揭示其中的因果关系、发展趋势和规律性特征。
实例分析方法主要包括以下几个重要要素:1. 个案选择:研究者需要选择具有代表性、典型性和信息丰富度的个案,以确保研究的可信度和适用性。
2. 数据收集:研究者通过多种方法收集个案相关的信息和数据,如观察、访谈、问卷调查等,以获取全面且准确的数据基础。
3. 数据分析:研究者将收集到的数据进行整理、分类和分析,运用适当的分析方法和工具,揭示个案的内在联系和内涵含义。
4. 结论推断:在数据分析的基础上,研究者进行合理推断和解释,从而得出对于普遍性规律和原则的认识。
二、实例分析方法的步骤实例分析方法通常包含以下几个步骤:1. 确定研究目的:研究者需要明确研究目的和科学问题,以指导后续的研究设计和数据分析。
2. 选择个案:在确定研究目的后,研究者需要选择适当的个案,以确保个案的代表性和典型性。
3. 数据收集:研究者通过多种方法和渠道,收集个案相关的信息和数据,如观察、访谈、问卷调查等。
4. 数据分析:研究者将收集到的数据进行整理、分类和分析,运用适当的分析方法和工具,揭示个案的内在联系和内涵含义。
5. 结论推断:在数据分析的基础上,研究者进行合理推断和解释,从而得出对于普遍性规律和原则的认识。
三、实例分析方法的优势实例分析方法具有以下几个优势:1. 研究深入:实例分析方法可以对个案进行深入观察和分析,获得详细和全面的信息,从而对研究对象有更深入的了解。



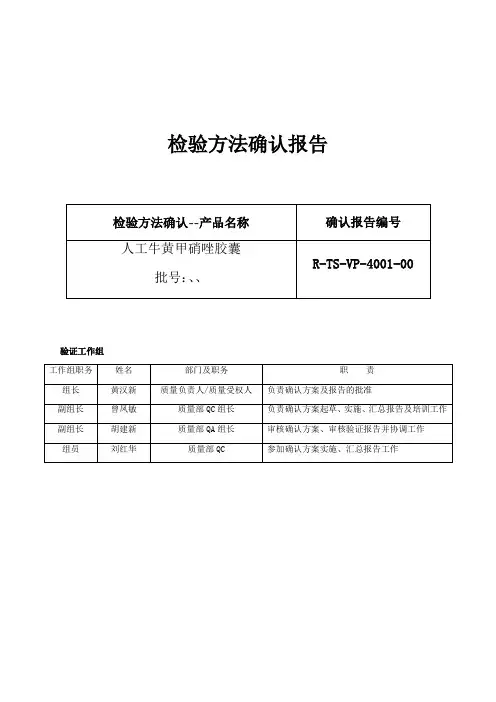
检验方法确认报告验证工作组目录1. 概述2. 确认目的和范围3. 组织及职责4. 确认起止日期5. 方法确认所需要的仪器设备及相关文件的确认6. 方法确认所需要的对照品、原辅料、检验样品的确认7.确认项目和确认方法、确认结果【鉴别(1)】人工牛黄薄层色谱鉴别方法确认【鉴别(2)】甲硝唑紫外光谱鉴别方法确认【鉴别(3)】人工牛黄胆红素液相色谱鉴别方法确认甲硝唑含量测定方法专属性确认甲硝唑含量测定方法线性关系与线性范围确认甲硝唑含量测定方法准确度确认甲硝唑含量测定方法精密度确认甲硝唑含量测定方法耐用性确认胆红素含量测定方法系统适用性确认胆红素含量测定方法专属性确认胆红素含量测定方法线性关系与线性范围确认胆红素含量测定方法准确度确认胆红素含量测定方法精密度确认胆红素含量测定方法耐用性确认8.三批产品按本检验方法检验的结果确认9.偏差与漏项控制10.确认报告会审1. 概述我公司生产的品种人工牛黄甲硝唑胶囊,执行国家药监局颁布的法定药品标准,标准号为:WS-10001-(HD-0204)-2002。
本公司前身(原广东华卫药业有限公司)按该标准生产、检验人工牛黄甲硝唑胶囊已有多年的历史。
根据GMP(2010版)第二百二十三条规定,对收入药典和其它法定标准的分析方法,应通过检验方法确认来证明该方法在本实验室条件下的适用性。
故本公司依照法定标准WS-10001-(HD-0204)-2002以及《中国药典》2015版四部附录9101:药品质量标准分析方法验证指导原则的规定,制定本检验方法确认方案,由质量部按制定的方法进行试验,根据试验结果判断检验方法在本公司是否适用。
本产品的微生物限度检查方法验证,另行制定验证方案进行验证,不包括在本次确认。
2. 确认目的和范围确认该产品的检验方法在本公司检验室的适用性,保证检验结果的可靠性。
本确认方案采用3批按GMP要求组织生产的人工牛黄甲硝唑胶囊,进行检验方法的确认。
确认项目包括【鉴别】、【甲硝唑含量测定】、【胆红素含量测定】等。

方法转移比对性测试实例药物分析杂志Chin J Pharm Anal 2015发表一篇文章“分析方法验证、转移和确认概念解析” (许明哲,黄宝斌,杨青云,田学波,白东亭,王佑春 , 中国食品药品检定研究院)2003年日本藤泽公司申请注册进口他克莫司软膏剂(2种规格:30g∶0.03%·支-1 和30g∶0.1%·支-1 ),用于治疗过敏性皮炎。
笔者所在实验室承担了进口注册质量标准复核工作。
按照要求,藤泽公司报送2个规格各3批样品、空白软膏基质、含量测定和有关物质测定所需标准物质,并提交了质量标准、方法学验证资料及3批样品的出厂检验结果。
鉴于该品种处方和含量测定方法的复杂性,复核实验室决定起草的进口注册质量标准中含量测定方法按照企业方法制定,不做改动。
复核实验室根据企业提供的含量测定方法,对企业提供的2个规格6批样品进行了检验,并将检验结果与企业提供的出厂检验结果进行了比对,见表4。
这个过程就是一个完整的方法转移过程,方法建立实验室是日本藤泽公司研发实验室,方法接收实验室是复核实验室,检验结果的比对结果表明, 2个规格共6批样品,复核实验室的检验结果与企业出厂检验结果之间的误差均在 1.5%之内,满足了预先设定的该品种含量测定方法差异的限度(误差不得过2%),说明复核实验室有能力正确操作方法建立实验室建立的含量测定方法,方法转移成功。
在此基础上,复核实验室根据企业质量标准起草了他克莫司软膏剂含量测定进口复核质量标准,并上报国家食品药品监督管理局批准。
案例分析作者(中国食品药品检定研究院) 说明方法接收实验室需要证明其能够成功地在本实验室操作该方法,最常用的方式就是比对性测试,如果接收实验室采用该方法对样品测定的结果与方法建立实验室测定的结果两者之间比对的结果符合转移之前确定的相关接受标准,就说明方法接收实验室能够和方法建立实验室一样有能力成功地操作此方法,方法转移成功。
验收标准: 复核实验室的检验结果与企业出厂检验结果之间的误差均在 1.5%之内,满足了预先设定的该品种含量测定方法差异的限度 (误差不得过2%)。
实验四LR(1)分析法实验学时:2实验类型:验证实验要求:必修一、实验目的构造LR(1)分析程序,利用它进行语法分析,判断给出的符号串是否为该文法识别的句子,了解LR(K)分析方法是严格的从左向右扫描,和自底向上的语法分析方法。
二、实验内容对下列文法,用LR(1)分析法对任意输入的符号串进行分析:(1)E- E+T(2)E- E—T(3)T- T*F(4)T- T/F(5)F- (E)(6)F- i三、LR(1)分析法实验设计思想及算法(1)总控程序,也可以称为驱动程序。
对所有的LR分析器总控程序都是相同的。
(2)分析表或分析函数,不同的文法分析表将不同,同一个文法采用的LR分析器不同时,分析表将不同,分析表又可以分为动作表(ACTION)和状态转换(GOTO)表两个部分,它们都可用二维数组表示。
(3)分析栈,包括文法符号栈和相应的状态栈,它们均是先进后出栈。
分析器的动作就是由栈顶状态和当前输入符号所决定。
LR分析器由三个部分组成:◆其中:SP为栈指针,S[i]为状态栈,X[i]为文法符号栈。
状态转换表用GOTO[i,X]=j表示,规定当栈顶状态为i,遇到当前文法符号为X时应转向状态j,X为终结符或非终结符。
◆ACTION[i,a]规定了栈顶状态为i时遇到输入符号a应执行。
动作有四种可能:(1)移进:action[i,a]= Sj:状态j移入到状态栈,把a移入到文法符号栈,其中i,j表示状态号。
(2)归约:action[i,a]=rk:当在栈顶形成句柄时,则归约为相应的非终结符A,即文法中有A- B的产生式,若B的长度为R(即|B|=R),则从状态栈和文法符号栈中自顶向下去掉R个符号,即栈指针SP减去R,并把A移入文法符号栈内,j=GOTO[i,A]移进状态栈,其中i为修改指针后的栈顶状态。
(3)接受acc:当归约到文法符号栈中只剩文法的开始符号S时,并且输入符号串已结束即当前输入符是'#',则为分析成功。
理化分析方法的检测限、定量限和耐用性验证及案例检测限和定量限检测限定义为样品中被分析物能够检出但无需准确定量的最低量。
检测限常常与方法的灵敏度相混淆,灵敏度是以响应值对被分析物的浓度或质量作图所得校正曲线的斜率。
定量限(LOQ)定义为能够以适当的精密度和准确度对样品中的被分析物进行定量测定的最低量。
定量限和检测限测定方式包括:a) 视觉判断通过测定待测成分浓度已知的样品,并确定该成分能被可靠检出的最低水平来计算检测限。
如重金属测定法。
b) 信噪比法通过比较测得的已知低浓度的样品信号和空白样品的信号,建立能够监测的被测物的最低浓度所得到的方法。
如色谱法。
c) 基于空白的响应值标准偏差通过分析适当数量的空白样品并计算所得响应值的标准偏差来测量分析背景响应值的大小。
如光谱法。
检测限数据须用含量相近的样品进行验证。
应附测定图谱,说明试验过程和检测限结果;定量限数据还应包括准确度和精密度验证数据。
图1 通过信噪比评价检测限和定量检测限和定量限测定方法(信噪比法)示例:在最灵敏的仪器状态下,测定至少四个空白样品,洗脱时间需覆盖整个样品中所有组分的流出,计算平均噪声水平;然后按信噪比大于2而小于6 配制所有组分的样品溶液,每个样品进样三次,计算该组分的最小检测限;然后按信噪比等于10.0±0.5 配制样品溶液,连续进样三次计算组分的最小定量限。
耐用性耐用性系指在测定条件有小的变动时,测定结果不受影响的承受程度,为所建立的方法用于日常检验提供依据。
确定方法的耐用性时,使一系列的方法参数在一定的范围内变动,测定这些变动对结果的量化影响。
常见的耐用性考察因素示例如下表。
如果参数的影响在预先设定的允许范围内,则证实方法在该参数范围内耐用。
表1 常见耐用性考察因素耐用性试验可以确定分析方法的关键参数及其允许的容量范围,并可以帮助评估一种或某种参数变化后方法是否需要重新验证。
在方法开发阶段应考虑通过风险评估的方式确定耐用性试验因素设计,这也是“质量源于设计”(QbD)在方法开发中的体现。
体内药物分析方法的验证与实例
c1、下列关于验证的效能指标与基本要求叙述错误的是()
A、标准曲线与线性范围应覆盖所有浓度范围
B、强调特异性是为避免干扰
C、准确度是为了确保结果的可重现
D、稳定性是为了确保所有样品准确测定
E、提取回收率是为了确保准确度
a2、分析方法在用于实际生物样品分析之前必需()
A、验证分析方法的可行性与可靠性
B、考虑所有可变因素
C、评价效能指标
D、进行用药后的实际生物样品测试
b3、生物基质中待测药物稳定性的验证包括()
A、室温放置
B、高温
C、冷冻
D、冷藏
E、冻-融循环
c4、分析方法的验证需要验证()
A、特异性与线性范围
B、精密度与准确度
C、包封率与载药量
D、定量限与检测限
E、回收率与溶液稳定性
a5、盐酸环丙沙星的化学结构中具有苯环、羰基等结构,可初步选择的分析方法是()
A、HPLC
B、GC
C、TCL
D、AA
E、EIA。